Электроды материалы, используемые при электролизе
Графит применяется для производства грифелей карандашей и электродов (в промышленном электролизе). В смеси с техническими маслами используется в качестве смазочного материала его чешуйки устраняют неровности смазываемой поверхности. Поскольку он тугоплавок и хорошо переносит резкую смену температур, из смеси графита и глины изготовляют плавильные тигли для металлургии. Используется графит и в ядерных реакторах в качестве замедлителя нейтронов. [c.128]Электрофоретическое нанесение лакокрасочных материалов, растворимых в воде, представляет собой усовершенствованный способ погружения, недостатки которого устранены действием электростатического поля. Электрофорез основан на ориентированном перемещении коллоидных частиц в диэлектрической среде. При наложении электрического тока возникают два процесса. Первый — это электролиз, характеризующийся перемещением ионов, образовавшихся при диссоциации электролита.
Большое положительное значение перенапряжения можно показать на примере электрохимического выделения водорода. Электродные потенциалы цинка, кадмия, железа, никеля, хрома и многих других металлов в ряду напряжения имеют более отрицательную величину равновесного потенциала по сравнению с потенциалом водородного электрода. Благодаря перенапряжению водорода на указанных выше металлах при электролизе водных растворов их солей происходит перемещение водорода в ряду напряжений в область более отрицательных значений потенциала и — становится возможным выделение многих металлов на электродах совместно с водородом с большим выходом металла по току .
 269]
269] В косвенной кулонометрии определяемое вещество, как правило, не принимает участия в электрохимической реакции. Электролиз при постоянной силе тока используют для электрохимической генерации титранта или из вспомогательного реагента, или из материала рабочего электрода . Титрант быстро и количественно реагирует с определяемым веществом. Необходимо убедиться в достижении конечной точки титрования. Наиболее часто используемыми и чувствительными методами для определения конечной точки кулонометрического титрования являются потенциометрия и амперометрия. Кулонометрическое титрование можно автоматизировать.
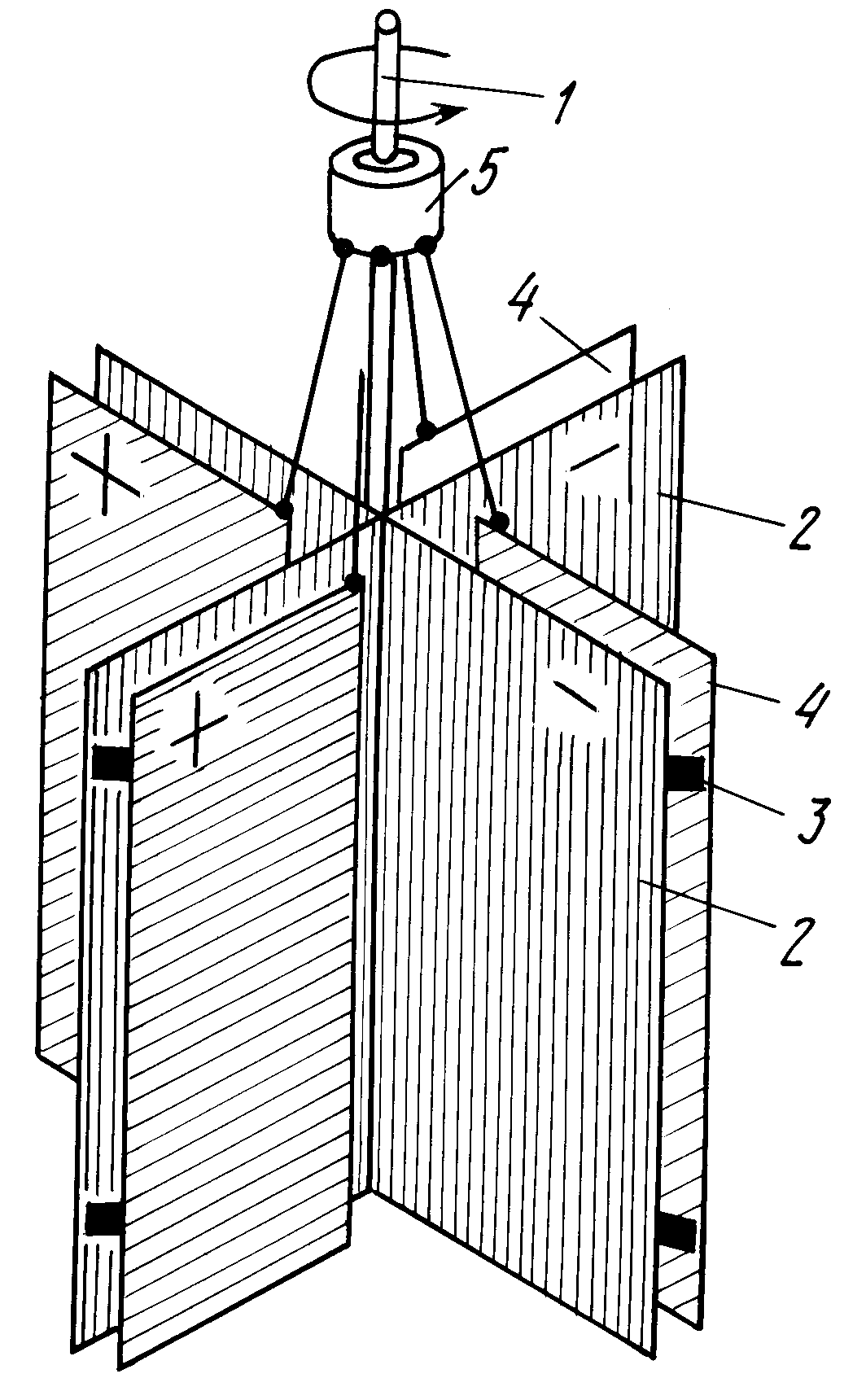
Определение ртути внутренним электролизом. Внутренний электролиз используется для определения ртути при ее содержании от 0,1 до 0,01 мг/мл раствора. В работе [95] использовали внутренний электролиз для определения ртути в биологических материалах. Биологический материал (консервы, мука, фрукты, мясо) разрушали смесью концентрированной азотной и серной кислот. Раствор помещали в пробирку емкостью 20 мл. В качестве катода использовали графитовый стержень цинковая пластина служила анодом. Максимальная ошибка определения ртути равна 4,2%. Увеличение температуры до 80° С, перемешивание и постоянное вращение электродов увеличивает скорость осаждения ртути. Время полного осаждения ртути 1 час. [c.78]
Раствор помещали в пробирку емкостью 20 мл. В качестве катода использовали графитовый стержень цинковая пластина служила анодом. Максимальная ошибка определения ртути равна 4,2%. Увеличение температуры до 80° С, перемешивание и постоянное вращение электродов увеличивает скорость осаждения ртути. Время полного осаждения ртути 1 час. [c.78]
Выходы, а часто и характер продуктов электролиза, во многом зависят от материала электрода. В качестве катода могут быть использованы многие металлы, сплавы или неметаллы, обладающие металлической проводимостью. [c.8]
Анодный процесс. Большое влияние на выход по току может оказать анодный процесс. В зависимости от материала электрода и условий электролиза — плотности тока, концентрации хлорид-иона в анолите и pH может меняться выход по току хлора, а также состав анодного газа и доля тока, расходуемого на выделение кислорода. Как уже говорилось выше, в электролизерах с фильтрующей диафрагмой используют графитовые или титановые с электрокаталитическим покрытием аноды.
Для измерения электропроводности при кондуктометрическом титровании используют мост Кольрауша с переменным источником тока для предотвращения электролиза. Мост может быть 3-х и 4-х плечевым уравновешенным шш неуравновешенным.
что это такое, применение, сущность, правила, примеры
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Что такое электролиз?
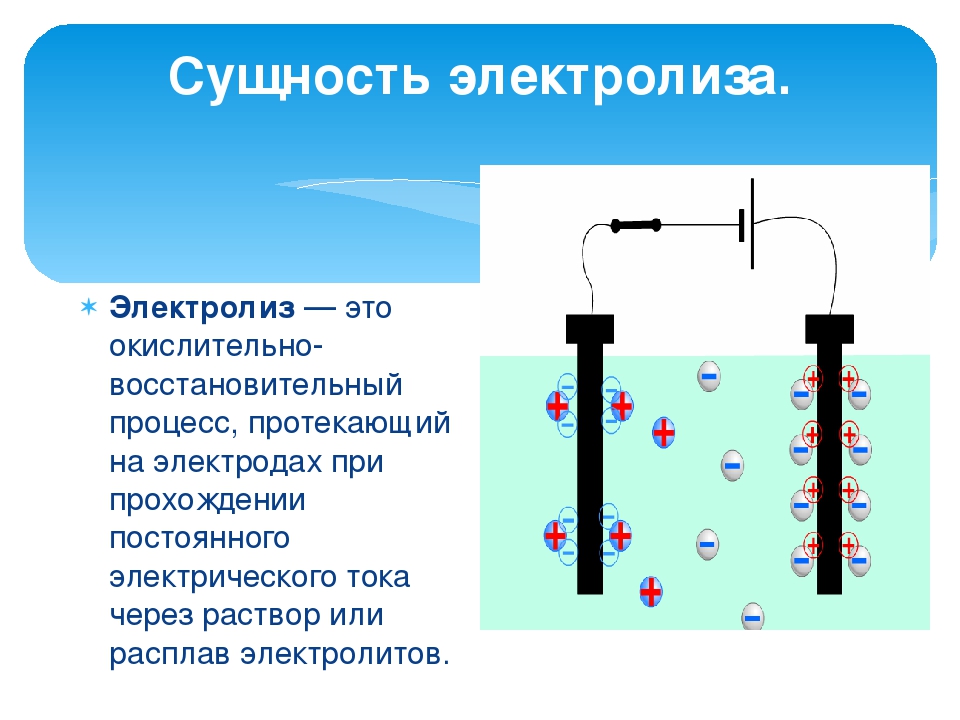
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
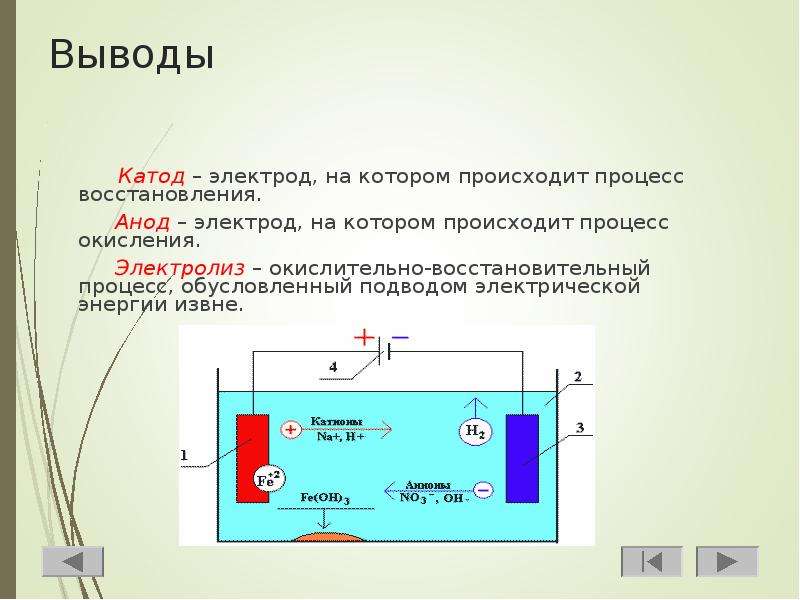
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.
Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:
k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода.
 Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита.
 С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая. - рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Электроды в электролизных процессах » Все о металлургии
18. 01.2016
01.2016
Для промышленного электролиза требуются высокоэффективные электроды, характеризующиеся хорошей проводимостью, высокой химической стабильностью, каталитической активностью, избирательностью, хорошими механическими свойствами. Такому комплексу требований удовлетворяют аморфные сплавы в следующих случаях.
В химической промышленности при электролизе горячих концентрированных растворов хлорида натрия на аноде происходит выделение хлора, а на катоде — гидроксида натрия и водорода. Среди кристаллических металлов платиновой группы Pd обладает очень высокой активностью относительно выделения хлора и низкой — относительно паразитического выделения на аноде кислорода, однако он быстро корродирует. Поэтому с целью повышения коррозионной стойкости палладия были предприняты попытки его легирования и аморфизации http://handcent.ru/.
Легирование существенно повысило коррозионную стойкость сплавов на основе Pd при поляризации в хлорной среде. Аморфные сплавы на основе Pd обладают высокой коррозионной стойкостью и пригодны для высокоэффективного производства очень чистого хлора.
 Они удовлетворяют предъявляемым требованиям длительности службы анода при низких энергетических затратах,
Они удовлетворяют предъявляемым требованиям длительности службы анода при низких энергетических затратах,Электролиз щелочной воды — Alkaline water electrolysis
| Электролиз щелочной воды | |
|---|---|
| Типичные материалы | |
| Тип электролиза: | Электролиз щелочной воды |
| Стиль мембраны / диафрагмы | NiO |
| Материал биполярной / разделительной пластины | Нержавеющая сталь |
| Катализатор на аноде | Ni / Co / Fe |
| Катализатор на катоде | Ni / C-Pt |
| Материал анода PTL | Ti / Ni / цирконий |
| Катодный материал PTL | Сетка из нержавеющей стали |
| Современные рабочие диапазоны | |
| Температура ячейки | 60-80 ° С |
| Давление в штабеле | <30 бар |
| Плотность тока | 0,2-0,4 А / см 2 |
| Напряжение ячейки | 1,8–2,40 В |
| Удельная мощность | до 1,0 Вт / см 2 |
| Диапазон частичной нагрузки | 20-40% |
| Стек удельного потребления энергии | 4,2-5,9 кВтч / Нм 3 |
| Система удельного энергопотребления | 4,5-7,0 кВтч / Нм 3 |
| Эффективность напряжения ячейки | 52–69% |
| Скорость производства водорода в системе | <760 Нм 3 / ч |
| Пожизненный стек | <90000 ч |
| Приемлемая скорость деградации | <3 мкВ / ч |
| Срок службы системы | 20-30 лет |
Электролиз щелочной воды имеет долгую историю в химической промышленности.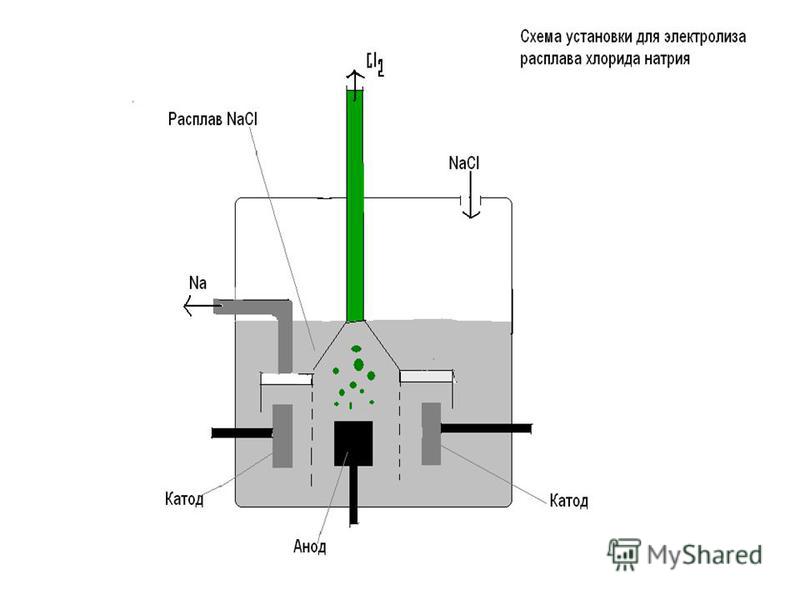 Это тип электролизера, который отличается наличием двух электродов, работающих в жидком растворе щелочного электролита гидроксида калия (КОН) или гидроксида натрия (NaOH). Эти электроды разделены диафрагмой, разделяющей газообразные продукты и переносящей ионы гидроксида (ОН — ) от одного электрода к другому. Недавнее сравнение показало, что современные водные электролизеры на основе никеля с щелочными электролитами обеспечивают конкурентоспособную или даже лучшую эффективность, чем кислотный полимерный электролит, мембранный водный электролиз с электрокатализаторами на основе металлов платиновой группы.
Это тип электролизера, который отличается наличием двух электродов, работающих в жидком растворе щелочного электролита гидроксида калия (КОН) или гидроксида натрия (NaOH). Эти электроды разделены диафрагмой, разделяющей газообразные продукты и переносящей ионы гидроксида (ОН — ) от одного электрода к другому. Недавнее сравнение показало, что современные водные электролизеры на основе никеля с щелочными электролитами обеспечивают конкурентоспособную или даже лучшую эффективность, чем кислотный полимерный электролит, мембранный водный электролиз с электрокатализаторами на основе металлов платиновой группы.
Электролиз требует наличия минералов в растворе. Водопроводная, колодезная и грунтовая вода содержит различные минералы, некоторые из которых являются щелочными, а другие — кислыми. Вода с pH выше 7,0 считается щелочной; ниже 7,0 — кислая. Требование состоит в том, что в воде должны быть ионы, которые проводят электричество для того, чтобы процесс электролиза воды происходил.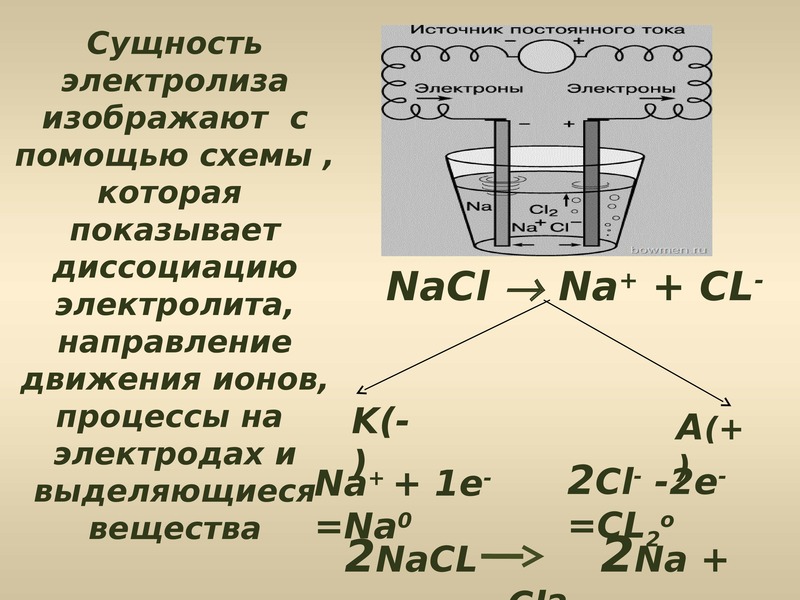
Структура и материалы
Электроды обычно разделены тонкой пористой фольгой (толщиной от 0,050 до 0,5 мм), обычно называемой диафрагмой или разделителем. Диафрагма не проводит электроны, что позволяет избежать коротких замыканий между электродами и при этом обеспечить небольшие расстояния между электродами. Ионная проводимость обеспечивается водным щелочным раствором, который проникает в поры диафрагмы. Современная диафрагма — это Цирфон, композитный материал из диоксида циркония и полисульфона. Кроме того, диафрагма предотвращает смешивание образующегося водорода и кислорода на катоде и аноде соответственно.
Обычно металлы на основе никеля используются в качестве электродов для электролиза щелочной воды. Что касается чистых металлов, Ni является наиболее активным неблагородным металлом. Недостатком является высокая цена хороших электрокатализаторов на основе благородных металлов, таких как металлы платиновой группы, и их растворение во время выделения кислорода. Ni считается более стабильным при выделении кислорода. Но нержавеющая сталь показала хорошую стабильность и лучшую каталитическую активность, чем никель, при высоких температурах во время реакции выделения кислорода (OER) .
Ni считается более стабильным при выделении кислорода. Но нержавеющая сталь показала хорошую стабильность и лучшую каталитическую активность, чем никель, при высоких температурах во время реакции выделения кислорода (OER) .
Ni-катализаторы с высокой площадью поверхности могут быть получены путем удаления сплавов никель-цинк или никель-алюминий в щелочном растворе, обычно называемом никелем Ренея . В испытаниях ячеек наиболее эффективные электроды, о которых было сообщено, состояли из никелевых сплавов, напыленных плазменным вакуумным напылением на никелевые сетки и горячеоцинкованных никелевых сеток. Последний подход может быть интересен для крупномасштабного промышленного производства, поскольку он дешев и легко масштабируется.
Преимущества по сравнению с электролизом воды из ПЭМ
По сравнению с электролизом воды с полимерным электролитом , преимущества щелочного электролиза воды заключаются в основном:
- Более дешевые катализаторы по сравнению с катализаторами на основе металлической платины, используемыми для электролиза воды на основе ПЭМ.
- Более высокая долговечность за счет заменяемого электролита и меньшего растворения анодного катализатора.
- Более высокая чистота газа за счет более низкой диффузии газа в щелочном электролите.
Ссылки
<img src=»//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Раздел статьи сайта watertester.ru Электролизер для проверки воды
Прежде чем выпить содержимое стакана, мы внимательно присматриваемся: а что там такое плавает? Это только наше восприятие, то, что мы видим и осязаем! Что же это на самом деле за странные примеси? Не обратить внимание на них невозможно! А вот с помощью прибора электролизера можно приоткрыть завесу тайны!
Процесс электролиза
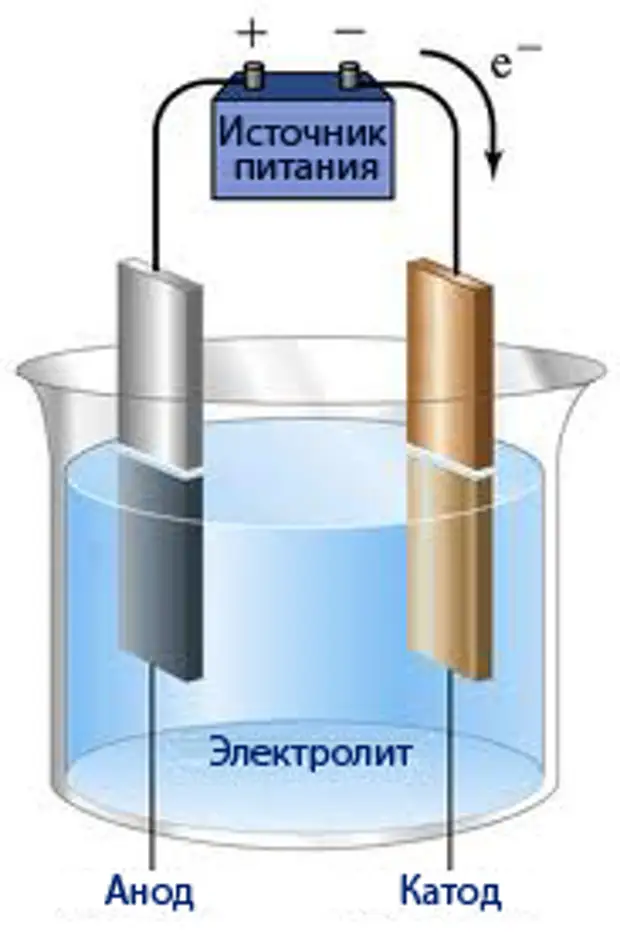
Вернемся к курсу уже полюбившейся физики и химии. Все помнят опыт с опущенными в емкость с раствором 2-мя палочками? Потом пропускали электрический ток и говорили о так называемом процессе электролиза. Так вот этот самый раствор называется электролитом, для него существуют определенные требования (среда должна проводить электрический ток), а эти самые палочки именуются электродами, один из которых является анодом (положительный заряд), а другой – катодом (отрицательно заряжен).
Электролизом называется совокупность процессов, происходящих в растворе или расплаве электролита, при прохождении через него электрического тока. Под действием постоянного тока беспорядочное движение ионов упорядочивается. Положительные ионы движутся к катоду, отрицательные ионы к аноду. Ионы обоих знаков возникают в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Данное явление и является электролитической диссоциацией.
Качественное определение примесей
Электрический ток, проходя через электролит, вызывает химические изменения, которые можно наблюдать визуально в виде продуктов разложения растворенного вещества из электролита. Другими словами, материал электрода под действием электрического тока растворяется, образуя «хлопья».
Если данную процедуру проводить с дистиллированной водой (которая не содержит ничего, кроме молекул Н2О), то визуальные изменения практически не отмечаются. Некоторые «исследователи» говорят о «высоком» качестве воды, что абсолютно не отвечает действительности.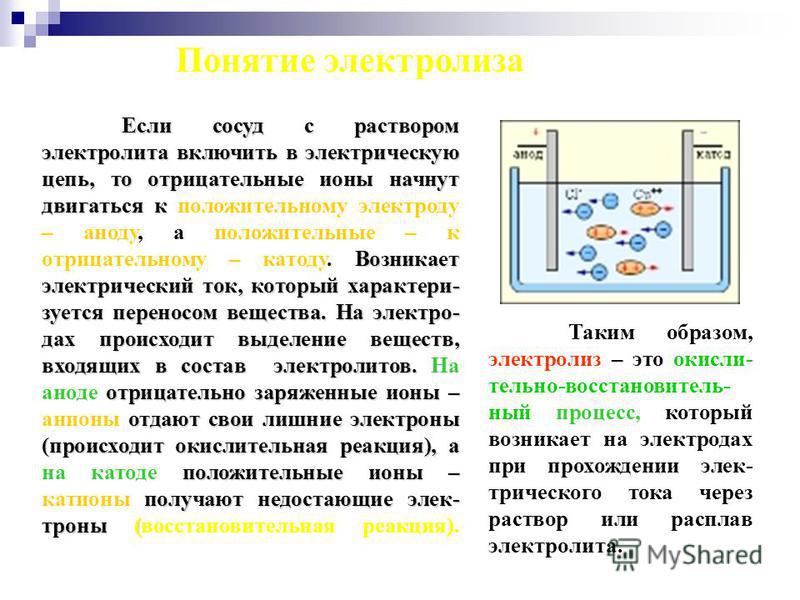 Дистиллированная вода не пригодна для употребления ни одним живым существом.
Дистиллированная вода не пригодна для употребления ни одним живым существом.
Проводя опыты с любой другой соответствующей водной средой, по цвету этих самых «хлопьев» можно судить о присутствующих примесях. Черный цвет говорит о наличии тяжелых металлов, желтый в зависимости от интенсивности — о том или ином количестве железа, зеленый – соответствует органическим соединениям.
Электролизер от компании Watertest
Электролизер предназначен для визуальной демонстрации различия качества воды, взятой из двух источников. Вы можете сравнивать качество воды из под крана и питьевой воды. В результате процесса электролиза наглядно демонстрируется уровень минерализации воды в виде окисляющихся металлов и минералов, присутствующих в воде, т.к. электролизер показывает наличие или отсутствие растворимых солей. Если использовать одну пару электродов, или одну емкость, то исследовать на примеси можно только один источник жидкости.
Приобретая электролизер компании Watertest, вы можете контролировать ту воду, которую предоставляет вам поставщик.
Перейти к товару
Электролиз и электролитическая ячейка — Учебный материал для IIT JEE
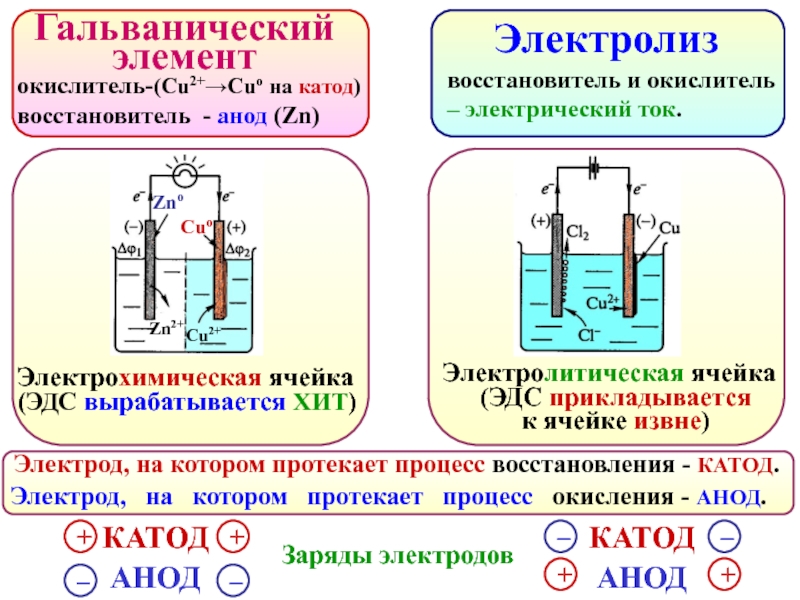
Электрохимические элементы
Ячейка, которая может преобразовывать электрическую энергию с помощью химического процесса, и наоборот, известна как электрохимическая ячейка .Лучшим примером этого является батарея, которую мы используем в дистанционных или настенных часах, которые преобразуют накопленную химическую энергию в электрическую.
Эти элементы работают по принципу окислительно-восстановительной реакции или окислительно-восстановительной реакции.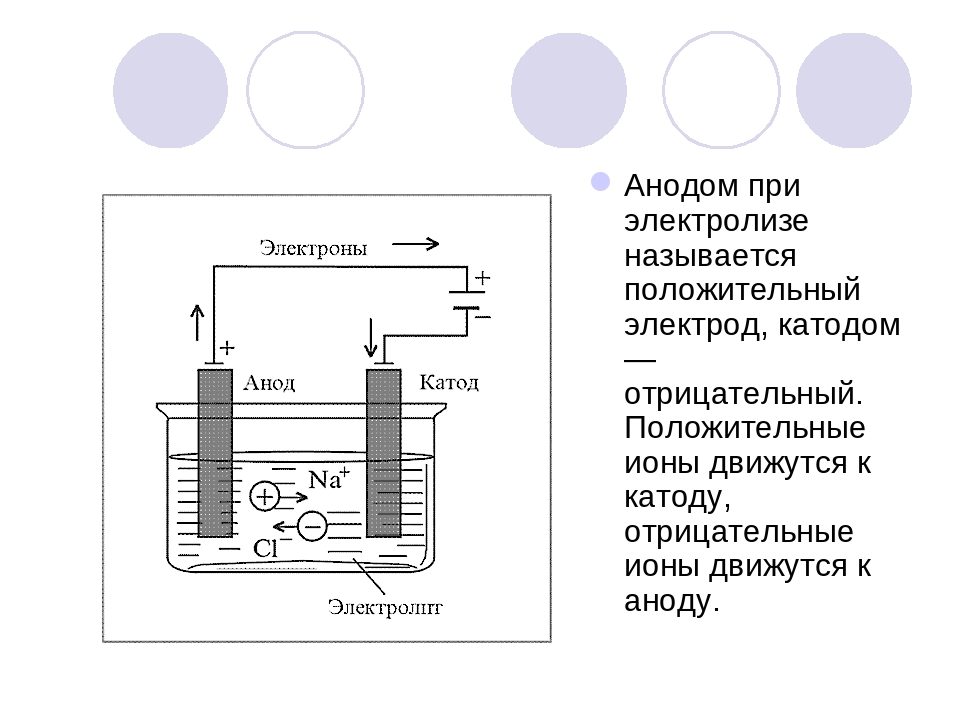
| Окисление | Редукция |
Добавление кислорода (ов) | Добавление водорода (ей) |
Удаление водорода (ов) | Потеря кислорода (ов) |
Потеря электронов | Коэффициент усиления электронов |
Увеличение степени окисления | Снижение степени окисления |
Приводит к образованию большого количества связей C-O. | Приводит к образованию множества связей C-H. |
Образовавшийся продукт будет иметь более низкую потенциальную энергию. | Образовавшийся продукт будет иметь более высокую потенциальную энергию. |
Рис. Пример окислительно-восстановительной реакции
Пример окислительно-восстановительной реакции
Типы электрохимических ячеек
Ячейки электролитические
Гальванические элементы
Электролитические ячейки
Электролитические ячейки : В этих ячейках электрическая энергия используется для проведения несамопроизвольной реакции.Говоря о скорлупе ореха, мы можем сказать, что в гальванических элементах химическая энергия преобразуется в электрическую, а в электролитической ячейке электрическая энергия преобразуется в химическую энергию.
Гальванические элементы
Гальванические элементы (также известные как гальванические элементы): Это прибор , в котором окислительно-восстановительная реакция используется для преобразования химической энергии в электрическую. Реакция, используемая для выработки электричества, происходит в двух разных ячейках. Каждая ячейка состоит из подходящего электролитического раствора и металлического стержня, известного как электрод (обычно электрод и электролит того же типа). Ячейки, состоящие из электрода и электролитического раствора, называются полуэлементами . В тот момент, когда две ячейки соединяются через солевой мостик, а электроды — через провод, связанный с гальванометром, начинает течь электричество. Это простая форма гальванического элемента, названного в честь его первооткрывателя, итальянского ученого Алессандро Вольта.
Каждая ячейка состоит из подходящего электролитического раствора и металлического стержня, известного как электрод (обычно электрод и электролит того же типа). Ячейки, состоящие из электрода и электролитического раствора, называются полуэлементами . В тот момент, когда две ячейки соединяются через солевой мостик, а электроды — через провод, связанный с гальванометром, начинает течь электричество. Это простая форма гальванического элемента, названного в честь его первооткрывателя, итальянского ученого Алессандро Вольта.
Примечание. Гальваническая ячейка является разновидностью этой ячейки. Его был изобретен британским химиком Джоном Ф. Дэниелом в 1836 году. И в этой ячейке используются электроды из ЦИНК и МЕДИ и электролит .
Электролитическая ячейка против гальванической ячейки
| Электролитическая ячейка (и) | Гальванический элемент (-ы) |
Электрическая энергия преобразуется в химическую энергию. | Химическая энергия преобразуется в электрическую. |
Анод — положительный электрод, а катод — отрицательный электрод. | Анод — отрицательный электрод, а катод — положительный электрод. |
Ионов разряжается как на аноде, так и на катоде. | Ионы разряжаются только на катоде. |
Если электроды нереактивны или инертны, концентрация электролита уменьшается, когда электрический ток циркулирует из-за электролиза. | Концентрация на стороне анодного полуэлемента увеличивается, а концентрация катодного полуэлемента уменьшается, когда два электрода соединяются проволокой. |
Оба электрода могут быть установлены в одной ячейке. | Электроды вставляются в разные ячейки. |
Электролитическая ячейка
В этой ячейке устроена такая установка, как электричество, проводимое через раствор электролита или его расплавленную или плавленую форму, которая генерирует свободные ионы, поэтому правильно сказано, что электрическая энергия преобразуется в химическую энергию в электролитических ячейках.
Принцип работы электролитической ячейки проиллюстрирован на примере ячейки, в которой электролиз расплавленного NaCl осуществляется между инертными электродами или электродами Нобеля, которые с ним не взаимодействуют.
Рис: Редокс-ячейка
Чтобы получить правильную настройку электролитической ячейки, чтобы он помогал пропускать ток через водный раствор электролита, то есть NaCl, в нем находятся два металлических стержня, которые, в свою очередь, связаны с концами источника питания.
Эти два металлических стержня называются электродами, стержень, через который ток входит в водный электролитический раствор, является анодом, его положительный конец установки, а стержень, через который ток выходит из водного раствора электролита, является катодом, его отрицательным концом установки.
Вся эта установка, за исключением внешнего источника питания или батареи, называется Cell .
 Электроны, выходящие через отрицательный электрод ячейки, принимаются отрицательной клеммой батареи.
Электроны, выходящие через отрицательный электрод ячейки, принимаются отрицательной клеммой батареи.Эти текущие электроны расходуются в реакции восстановления, которая происходит на катоде.
Число электронов, принимаемых на отрицательном выводе электрода, возвращается обратно к положительному выводу источника питания через положительный электрод ячейки, где электроны выходят из-за окисления.
Внутри установки ток осуществляется за счет движений свободных ионов, генерируемых во время прохождения электронов внутрь и из ячейки; предоставленные катионы движутся к катоду (отрицательный электрод), а анионы к аноду (положительный электрод)
Это свободное движение ионов обоих типов вызывает электролитическую проводимость.
Просто подумай
CASE-01 Наличие нескольких катионов в ячейке
Стандартные восстановительные потенциалы при 25 ° C приведены ниже для нескольких общих реакций
CASE-02: Наличие мультианионов в ячейке
Важность соляного моста
CASE-01 Наличие мультикатионов в ячейке
Давайте посмотрим на состояние, которое включает в себя более одного типа катионов. Способность катиона двигаться к катоду, где он приобретает электрон и уменьшается, зависит от таких факторов, как его масса, размер, заряд на нем и т. Д.
Способность катиона двигаться к катоду, где он приобретает электрон и уменьшается, зависит от таких факторов, как его масса, размер, заряд на нем и т. Д.
Цитируя это, мы можем сказать, что трудно количественно предсказать правильный порядок восстановления катионов. Потому что один фактор может его ускорить, а другой подавить.
Наилучший способ предсказать это — дать количественное значение или число на общий эффект всех факторов, участвующих в восстановительной способности катиона.
Это количественное число или значение называется потенциалом снижения стандарта SRP. Катион с более высоким значением SRP будет восстанавливаться предпочтительно быстрее, чем катион с более низким значением SRP.
Стандартные восстановительные потенциалы при 25 ° C приведены ниже для нескольких общих реакций
Полуреакция восстановления | E °, V | Полуреакция восстановления | E °, V |
Факс 2 + 2e — → 2Ф — | 2. | AgCl + e — → Ag + Cl — | 0,222 |
S 2 O 8 2- + 2e — → 2SO 4 2- | 2,0 | PdI 4 2- + 2e — → Pd + 4I — | 0.18 |
Co 3+ + e — → Co +2 | 1,82 | Cu 2+ + e — → Cu + | 0,15 |
H 2 O 2 + 2H + + 2e — → 2H 2 O | 1.77 | Sn 4+ + 2e — → Sn 2+ | 0,13 |
MnO 4 — + 4H + + 3e — → MnO 2 + 2H 2 O | 1,70 | Ag (S 2 O 3 ) 2 3- + e — → Ag + 2S 2 O 3 2- | 0. |
PbO 2 + 4H + + SO 4 2 + 2e — → PbSO 4 + 2H 2 O | 1,70 | 2H + + 2e — → H 2 | 0,000 |
Ce 4+ + e — → Ce 3+ | 1.70 | Pb 2+ + 2e — → Pb | –0,126 |
MnO 4 — + 8H + + 5e– → Mn +2 + 4H 2 O | 1,51 | Sn 2+ + 2e — → Sn | — 0.14 |
Au 3+ + 3e — → Au | 1,50 | 2CuO + H 2 O + 2e — → Cu 2 O + 2OH — | — 0,15 |
Класс 2 + 2e — → 2Cl — | 1. | AgI + e — → Ag + I — | — 0,151 |
Cr 2 O 7 2- + 14H + + 6e — → 2Cr +3 + 7H 2 O | 1,33 | CuI + e — → Cu + I — | — 0.17 |
Ti 3+ + 2e — → Ti + | 1,26 | Ni 2+ + 2e — → Ni | — 0,25 |
MnO 2 + 4H + + 2e — → Mn 2+ + 2H 2 O | 1.23 | Co 2+ + 2e — → Co | — 0,28 |
O 2 + 4H + + 4e — → 2H 2 O | 1,229 | PbSO 4 + 2e — → Pb + SO 4 2- | — 0. |
2IO 3 — + 12H + + 10e — → I 2 + 6H 2 O | 1,20 | Ti + + e — → Ti | — 0,336 |
Br 2 + 2e — → 2Br — | 1.09 | Cu 2 O + H 2 O + 2e — → 2Cu + 2OH — | — 0,34 |
AuCl 4 — + 3e — → Au + 4Cl — | 1,00 | Кд 2+ + 2е — → Кд | — 0.403 |
OCl — + H 2 O + 2e — → Cl — + 2OH — | 0,94 | Fe 2+ + 2e — → Fe | — 0,44 |
Pd 2+ + 2e — → Pd | 0. | Cr 3+ + 3e — → Cr | — 0,74 |
2Hg 2+ + 2e — → Hg 2 2+ | 0,92 | Zn 2+ + 2e — → Zn | — 0.7628 |
Cu 2+ + I — + e — → CuI | 0,85 | 2H 2 O + 2e — → H 2 + 2OH — | — 0,828 |
Ag + + e — → Ag | 0.799 | Mn 2+ + 2e — → Mn | и |
ЭЛЕКТРОЛИЗ РЕШЕНИЙ Эта страница посвящена электролизу водных растворов соединений. Большинство людей довольно часто сталкивались с этим на курсах химии для детей от 14 до 16 лет. Основные идеи Роль воды в электролизе водных растворов электролитов Ситуация усложняется, когда вы электролизуете раствор, а не расплав, из-за присутствия воды. Вода сама по себе является очень слабым электролитом, потому что она в очень небольшой степени расщепляется на ионы водорода и ионы гидроксида. | |
Примечание: Я, конечно, упрощаю это.Вы должны знать, что ион водорода не существует сам по себе в этих обстоятельствах — он фактически присоединяется к другой молекуле воды, давая ион гидроксония, H 3 O + . Это означает символ состояния (aq). | |
Это означает, что на каждый электрод может приходить более одного иона, и можно выбрать, какой из них будет разряжаться. Например, если вы электролизовали раствор хлорида натрия, ионы натрия и ионы водорода (из воды) притягиваются к катоду, а ионы хлорида и ионы гидроксида (из воды) притягиваются к аноду. Электрохимическая серия В таблице ниже перечислены несколько металлов (и водород), показывающих их склонность к потере электронов.Чем более отрицательным является значение E ° (обычно читаемое как «E-ноль»), тем левее находится положение равновесия. Это означает, что чем более отрицательное значение E °, тем больше у одного из этих элементов склонность к потере электронов и образованию своих ионов. Это также означает, что что-то вроде лития будет иметь небольшую тенденцию собирать электроны для образования атомов после ионизации. Напротив, что-то с положительным значением E ° будет неохотно терять электроны для образования ионов, но будет довольно легко заставить один из его ионов улавливать электроны, чтобы снова стать нейтральным элементом. Итак, золото не будет очень реактивным, потому что у него очень положительное значение E °. Нелегко удалить электроны, чтобы получить ионы золота, но ионы золота снова легко превратить в металлическое золото. Электрохимический ряд можно рассматривать как расширенный и слегка модифицированный ряд реактивности. Все, что вам действительно нужно знать об электролизе:
| |
Примечание: Для целей электролиза вам не нужно понимать, откуда берутся эти числа или к чему именно относятся равновесия. Если вы хотите узнать больше об электрохимических рядах, включая происхождение этих чисел, вы найдете их, перейдя по этой ссылке.Это вторая страница в серии страниц, посвященных окислительно-восстановительным потенциалам, и вам, вероятно, также потребуется прочитать первую страницу. Это не обязательно для просмотра остальной части текущей страницы. | |
Подводя итоги происходящего Я хочу подвести итоги этого, прежде чем подробно рассматривать конкретные примеры. Что происходит на катоде? Положительные ионы притягиваются к катоду, где они захватывают один или несколько электронов и разряжаются. Либо металл осаждается, либо водород образуется из воды. Что вы получите, зависит от положения металла в электрохимическом ряду и, в некоторых случаях, от концентрации раствора.
Чем выше элемент в электрохимическом ряду, тем легче он теряет электроны и тем труднее забирает их обратно.Гораздо легче убедить медь взять обратно электроны, чтобы превратить ион в атом, чем, скажем, сделать то же самое с литием. Что происходит на аноде? Использование инертных электродов, таких как платиновый или угольный Как правило, если у вас есть галоген, вы получите галоген. Со всеми другими распространенными анионами (отрицательными ионами) вы будете получать кислород из воды. Но концентрация здесь играет роль.Например, если у вас есть концентрированный раствор хлорида натрия, вы получите в основном хлор на аноде. Чем больше и больше разбавленных растворов, тем меньше хлора и больше кислорода. Очень и очень разбавленные растворы будут давать в основном кислород. Если анод не инертен Сложность возникает, если анод не инертен, и мы рассмотрим пару примеров этого ниже. Некоторые примеры Электролиз раствора сульфата меди (II) угольными электродами Медь находится ниже уровня водорода в электрохимическом ряду, поэтому, используя приведенное выше резюме, можно предсказать, что медь будет выделяться на катоде. Продолжая использовать приведенное выше резюме, вы можете предсказать, что кислород будет выделяться на аноде, потому что в нем нет галогена. Именно это и происходит. На катоде Ионы меди (II) и ионы водорода притягиваются к отрицательному катоду. В электрохимическом ряду медь находится ниже водорода, поэтому именно медь принимает электроны от катода. Катод покрывается медью. На аноде Ионы сульфата и ионы гидроксида притягиваются к положительному катоду, но очень трудно убедить ионы сульфата отдать электроны. Теперь все усложняется, потому что есть два способа описания анодной реакции в подобных случаях. Предполагается, что гидроксид-ионы разряжены Кислород выделяется. Проблема в том, что в растворе сульфата меди (II) будет очень мало гидроксид-ионов. Вы можете обойти это, заметив, что реакция воды, в результате которой образуются ионы водорода и гидроксида, является равновесной. Когда вы разряжаете ионы гидроксида, равновесие смещается, чтобы заменить их. Получение кислорода непосредственно из молекул воды Общий эффект точно такой же, как если бы вы выпустили ионы гидроксида, и водное равновесие сместилось, чтобы заменить их.Сдвиг равновесия также будет производить ионы водорода. Они, конечно, будут отталкиваться от анода. Итак, что правильно? Это почти наверняка зависит от pH раствора. В этом конкретном случае раствор сульфата меди (II) является умеренно кислым, а это означает, что гидроксид-ионов даже меньше, чем в чистой воде, поэтому второе уравнение (вода), вероятно, будет более точным. | |
Примечание: Что вы делаете с этим для экзамена? Вам нужно выяснить, какую версию этих уравнений используют ваши экзаменаторы, и затем придерживаться ее во всем — не беспокойтесь об изменении ее от примера к примеру.Вам необходимо проверить, какие из них они использовали в своих прошлых работах и какая форма их предпочтительнее в их схемах оценок. Вполне вероятно, что они тоже согласятся, но вы должны быть уверены. | |
Подобные футляры Любой раствор, содержащий ионы сульфата (который включает разбавленную серную кислоту), будет вести себя точно так же на инертном аноде — будет выделяться кислород. Нитрат-ионы также производят кислород. Вывести гидроксид-ионы из воды (или самой воды, если вы используете это уравнение) легче, чем из нитрат-иона. Электролиз раствора хлорида натрия угольными электродами Натрий значительно превосходит водород в электрохимическом ряду, поэтому, используя приведенное выше резюме, можно предсказать, что водород будет выделяться на катоде. Продолжая использовать приведенное выше резюме, можно предсказать, что хлор (галоген) будет выделяться на аноде. Оказывается, этот случай немного сложнее, потому что результат на аноде зависит от концентрации раствора. На катоде Прибывают ионы натрия и ионы водорода (из воды), но натрий настолько высок в электрохимическом ряду, что его ионы не разряжаются там, где есть выбор. Если вы электролизуете расплавленный хлорид натрия, то выбора нет — надо разряжать ионы натрия. Но в решении у вас есть альтернатива. К сожалению, есть два разных взгляда на это, аналогичные проблеме с анодом, описанной выше. Предполагается, что ионы водорода разряжены Выделяется водород. Вы можете преодолеть тот факт, что в растворе не очень много ионов водорода, если вспомнить, что когда вода ионизируется с образованием ионов водорода и гидроксид-ионов, это равновесие. По мере того, как ионы водорода разряжаются, больше воды расщепляется, чтобы заменить их. Получение водорода непосредственно из молекул воды Как и в случае с аналогичным анодным случаем выше, как бы вы ни смотрели на него, общий эффект будет таким же.Вы получаете газообразный водород и образование ионов гидроксида — вместе с ионами водорода, когда водное равновесие смещается, чтобы заменить высвобождаемые ионы водорода. Итак, какое уравнение вам следует использовать? Вы должны руководствоваться тем уравнением, которое используют ваши экзаменаторы в своих вопросах или в схемах выставления оценок. На практике они, вероятно, примут и то, и другое. Подобные футляры Когда вы электролизуете соединение металла над водородом в электрохимическом ряду, и вы получаете водород, применяется тот же аргумент.Однако есть некоторые случаи, когда водород не выделяется при таких обстоятельствах, и мы рассмотрим их далее на странице. На аноде Ионы хлора и ионы гидроксида притягиваются к положительному аноду.
| |
Примечание: На этом уровне это то, что вам в значительной степени просто необходимо принять. Не существует простого объяснения , которое я мог бы добавить, не делая эту длинную и часто сложную страницу еще хуже. Я думаю, очень маловероятно, что вам когда-либо придется объяснять причину этого на экзамене по химии на этом уровне. Если вы столкнетесь с вопросами от экзаменаторов, которые, по-видимому, нуждаются в надлежащих пояснениях, не могли бы вы сообщить мне об этом по адресу, указанному на странице об этом сайте.Было бы полезно, если бы вы также могли точно сказать мне, что ваши экзаменаторы ожидают от вас. | |
Образование хлора определяется уравнением: А образование кислорода задается одним из уравнений: или: Водные растворы бромидов и иодидов В обоих случаях можно предположить, что на аноде образуется бром или йод.Уравнения аналогичны разряду ионов хлора выше. Электролиз раствора хлорида натрия с использованием ртутного катода Это хороший пример случая, когда природа электрода имеет огромное значение. Когда-то это был основной промышленный метод производства раствора гидроксида натрия, а также хлора и водорода, но его в значительной степени заменили более экологически чистые методы. В прошлом были серьезные примеры опасного загрязнения из-за утечки ртути в окружающую среду. На катоде Когда ионы натрия и ионы водорода попадают на ртутный катод, именно ионы натрия выделяются в виде металлического натрия. Амальгама натрия вытекает из электролизера и вступает в реакцию с водой, освобождая ртуть для рециркуляции через электролизер и производя раствор гидроксида натрия и водород. На аноде Хлор производится, как и следовало ожидать. Электролиз раствора сульфата цинка угольными электродами Я использую соединение цинка в качестве примера довольно неожиданных результатов, которые вы получаете при электролизе растворов соединений металлов от свинца до цинка в электрохимической серии. Все они выше водорода в электрохимическом ряду, поэтому можно ожидать, что водород будет выделяться на катоде, а не на металле. Это не то, что происходит при любой разумной концентрации растворов солей этих металлов. На катоде Ионы цинка захватывают электроны с катода, образуя атомы цинка, которые прикрепляются к катоду. На аноде Это еще один случай электролиза сульфата, и мы подробно рассмотрели его далее на странице, рассказывая об электролизе раствора сульфата меди (II). | |
Примечание: Опять же, нет быстрого и простого способа объяснить, почему разряжаются ионы цинка, а не ионы водорода, и очень маловероятно, что вас попросят объяснить это на экзамене такого уровня. Если вы хотите узнать больше, вы можете погуглить перенапряжение . Вы можете встретить такие фразы, как «большое перенапряжение водорода». Использование слова «перенапряжение» на самом деле ничего не объясняет. Все, что он на самом деле говорит, — это то, что водород труднее разрядить, чем можно было бы ожидать, исходя из его положения в электрохимическом ряду — и мы знаем это, потому что экспериментально в том случае, о котором мы говорим, вы получаете цинк, а не водород. Итак, если вы хотите следить за этим (почти наверняка не требуется для экзаменов по химии на этом уровне), поищите объяснения, объясняющие, почему значение E ° водорода не применимо в реальной ситуации электролиза раствора сульфата цинка. | |
Электролиз раствора нитрата серебра с использованием серебряного анода Это пример случая, когда вы используете электрод, который химически участвует в реакции. На катоде Если вы электролизуете раствор нитрата серебра с использованием серебра в качестве анода, серебро осаждается на любом материале, из которого сделан катод, как и следовало ожидать. Может использоваться для серебряного покрытия. На аноде Но на аноде, вместо того, чтобы что-либо выгружать из раствора, серебро из анода переходит в раствор в виде ионов серебра, оставляя электроны на аноде. Анод теряет серебро, и чистое изменение — это просто перенос серебра с анода на катод. Электролиз раствора сульфата меди (II) с медным анодом Аналогичное изменение происходит при электролизе раствора сульфата меди (II) с помощью медных электродов. Используется для очистки меди, и вы можете узнать больше об этом, прочитав часть страницы о меди. Вам не нужна вся страница — только раздел про очищение. Практическая деталь Конечно, вы можете электролизовать раствор, поместив его в химический стакан с двумя угольными электродами и подключив электроды к источнику постоянного тока, например батарее. Тем не менее, вы можете собрать газы, выделяемые для проверки, и, возможно, измерить их объем. В заключительной части этой страницы рассматриваются два простых устройства, которые позволят вам это сделать. Сбор любых газов для проверки Если у вас есть газы, исходящие от обоих электродов, вам необходимо держать их отдельно, а также собирать их. Это дешевый и простой способ сделать это. Изначально обе маленькие пробирки заполнены любым раствором, который вы можете подвергать электролизу.Газы, выходящие из двух электродов, не смешиваются, и, если есть два газа, оба могут быть проверены отдельно. Помимо газов, можно ясно увидеть любые осажденные на катоде металлы, а также любые растворы брома или йода, образующиеся на аноде. Раствор брома бледно-оранжевый; Цвет раствора йода варьируется в зависимости от концентрации йода от оранжевого до темно-красного. | |
Примечание: Вы получите йод, только если будете электролизовать раствор йодида.Освободившийся йод фактически реагирует с непрореагировавшими ионами йодида с образованием растворимого иона I 3 — . Это вызывает появление красного цвета. | |
Сбор любых газов для их измерения Простым методом является использование U-образной трубки с боковым рычагом. Амперметр включен в схему, потому что, если вы измеряете выделяемые объемы, вы почти наверняка захотите узнать, какой ток протекает, чтобы делать какие-либо вычисления. Расчеты описаны на других страницах этого раздела.
В меню «Электролиз». . . В меню «Неорганическая химия».. . В главное меню. . . © Джим Кларк, 2017 | |
Электролизные электроды — Большая химическая энциклопедия
Химические вещества (водород, кислород, хлор, консервированная сода) могут образовываться при подаче электроэнергии на электроды (электролиз). [Pg.454] К электроду приложено напряжение, мы говорим, что он поляризован. Ток течет в ответ на напряжение, и электроны потребляются в электрохимических реакциях вокруг электродов.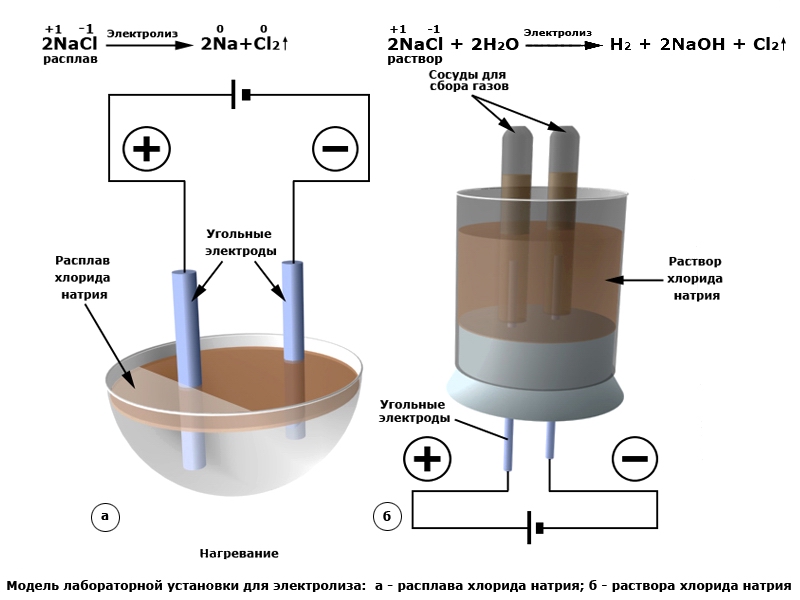 Происходит электролиз. Каждый электрон, который проходит через электрод, должен участвовать в окислительно-восстановительной реакции, будь то окисление или восстановление. Электроны, входящие или выходящие из электрода, перемещаются в результате реакций, происходящих в непосредственной близости от электрода. И наоборот, электроны могут двигаться в противоположном направлении (покидая электрод), чтобы облегчить реакции восстановления. [Pg.283]
Происходит электролиз. Каждый электрон, который проходит через электрод, должен участвовать в окислительно-восстановительной реакции, будь то окисление или восстановление. Электроны, входящие или выходящие из электрода, перемещаются в результате реакций, происходящих в непосредственной близости от электрода. И наоборот, электроны могут двигаться в противоположном направлении (покидая электрод), чтобы облегчить реакции восстановления. [Pg.283]
| Рис. 1. Типовая конфигурация трехэлектродной электролизной ячейки. |
 22.8). Таким образом, реакцию можно контролировать с помощью аналитически определенного окислительно-восстановительного потенциала субстрата, а селективность процесса можно изучать при различных потенциалах.После определения факторов, регулирующих селективность, обычно можно перейти к управлению током путем правильного выбора плотности тока и концентрации субстрата. Используя непрерывный процесс, концентрацию можно установить на желаемом уровне. Таким образом, селективность также может быть получена в этих условиях. [Pg.676]
22.8). Таким образом, реакцию можно контролировать с помощью аналитически определенного окислительно-восстановительного потенциала субстрата, а селективность процесса можно изучать при различных потенциалах.После определения факторов, регулирующих селективность, обычно можно перейти к управлению током путем правильного выбора плотности тока и концентрации субстрата. Используя непрерывный процесс, концентрацию можно установить на желаемом уровне. Таким образом, селективность также может быть получена в этих условиях. [Pg.676]Когда водный раствор слабой кислоты, HA, в подходящем контейнере подключается к клеммам источника постоянного тока (через инертные платиновые электроды), происходит электролиз.На катоде, где происходит восстановление или усиление электронов, вода диссоциирует и выделяется анион A (без учета иона гидроксония h40 +) … [Pg.269]
Включен потенциостат, и на нем появится черная пленка. форма на электроде. Затем электролиз продолжают около 30 минут. Затем черную пленку промывают и снимают с электрода для последующего анализа. [Pg.164]
[Pg.164]
Как уже было описано во Введении, первый электрохимический эксперимент ЭПР был проведен Инграмом и его сотрудниками [2], которые продемонстрировали образование ароматических ион-радикалов при электровосстановлении.Однако реальный потенциал совместного электрохимического метода ЭПР был впервые продемонстрирован в работе Maki et al. [3, 4,12-14], они получили первые спектры раствора электрохимически генерируемых радикалов и тем самым выполнили первый электрохимический эксперимент ЭПР на месте. Это было выполнено в двухэлектродной электролизной ячейке, анодом из платиновой проволоки с наружным диаметром 3 мм. капиллярная трубка, выступ которой располагался по центру, вдоль оси цилиндрической полости. Катод был отделен от анода спеками и находился вне полости ЭПР.Система … [Стр.305]
| Рис. 1.2b. Ячейка электролизная трехэлектродная (ВЭ, рабочий эл -… |
 Мы должны отделить явление в объеме раствора от явления на электродах. [Стр.10]
Мы должны отделить явление в объеме раствора от явления на электродах. [Стр.10]Электролитические ячейки представляют собой другой тип электрохимической ячейки.Они используют внешний источник напряжения, чтобы вызвать реакцию в непредсказуемом направлении. Электролиз водного раствора часто включает окисление или восстановление воды на электродах. Например, электролиз концентрированного раствора хлорида натрия дает водород на катоде. Количество веществ, выделяемых на электроде, связано с количеством заряда, прошедшего через элемент. Это соотношение является стехиометрическим и следует из электродных реакций. [Pg.844]
Электродный потенциал Потенциал электрода, измеренный относительно электрода сравнения.Электролиз. Химическое изменение электролита в результате прохождения электричества. [Pg.832]
Электроды Электролизный Электролит Электролитический элемент Гальванический (гальванический) элемент … [Pg.587]
Емкость аккумуляторного электрода Стоимость электроэнергии для электролиза Основной капитал . .. [Pg.646]
.. [Pg.646]
Электролиз. Электролиз растворов. Электролиз расплавов
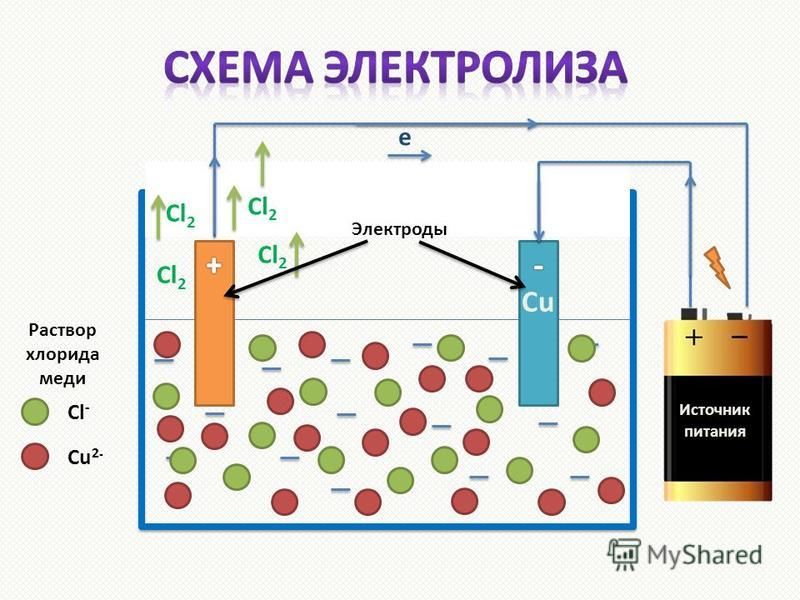
Электролиз — это окислительно-восстановительный процесс, который происходит на электродах, когда электрический ток пропускается через расплав или раствор.
Электролиз — еще один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно проводить дома. Нужен источник тока, два электрода (виды электродов, любые случаи этих процессов будут рассмотрены позже) и, конечно же, электролит. Электролит — это раствор, проводящий электрический ток.
Имеется электролизных растворов и электролизных расплавов . Оба эти процесса существенно отличаются друг от друга.Разница в том, что в наличии растворитель. При электролизе растворов помимо ионов вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Чтобы получить желаемый продукт (газ, металл или неметалл), нужно выбрать электрод и раствор электролита. Электроды могут быть из любых материалов, проводящих электрический ток. Чаще всего используются металлы и сплавы, неметаллические электроды могут быть, например, графитовыми стержнями (или углеродными).Реже в качестве электрода используется жидкость.
Электроды могут быть из любых материалов, проводящих электрический ток. Чаще всего используются металлы и сплавы, неметаллические электроды могут быть, например, графитовыми стержнями (или углеродными).Реже в качестве электрода используется жидкость.
Положительно заряженный электрод является анодом. Электрод заряжен отрицательно, является катодом. Во время электролиза происходит окисление анода (он растворяется) и восстановление катода. Следовательно, анод следует брать так, чтобы растворение не влияло на химический процесс, протекающий в растворе или расплаве. Такой анод называется инертным электродом . В качестве инертного анода может использоваться графит (углерод) или платина.
В качестве катода можно взять металлическую пластину (она не растворяется).Подходит медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавеющая сталь.
В домашних условиях из тех веществ, которые присутствуют практически в каждом, легко можно получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щелочь!
Но будьте осторожны с хлором — этот газ ядовитый !!
Первый опыт проведем с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (также можно взять кальцинированную соду), поместите в него электроды и включите блок питания.Как только через раствор пойдет ток, сразу становятся видны пузырьки газа, которые образуются на электродах: на «+» будет выделяться кислород, на «-» водород
Это связано с тем, что отрицательные ионы OH — являются накоплением около анода «+» и восстановлением кислорода, а около катода «-» аккумулируют ионы щелочного металла, содержащиеся в растворе кальцинированной соды (Na 2 CO 3 ) с положительным зарядом (Na + ) и одновременным восстановлением водорода.Восстановление ионов натрия до чистого металла (Na) не происходит, поскольку металлический натрий находится в левой части водорода в диапазоне напряжений металлов.
Li Следующим опытом электролиза будет чистая медь (Cu). Приготовьте раствор медного купороса, поместите в него электроды и включите питание. Как и в предыдущем опыте с раствором кальцинированной соды, анод «+» будет восстанавливать кислород. В то же время катод «-» будет покрывать темно-красный слой (медь-Cu), который восстанавливается из раствора до чистого металла. У нас было 2 опыта электролиза растворов и можем подвести итог: Катионы обычно все металлы и водород. Будет еще один опыт электролиза.На этот раз пропустим ток через раствор хлорида натрия (NaCl). Но должен вас предупредить, этот электролиз следует проводить в хорошо проветриваемом помещении, так как выделяющийся из раствора чистый газ — хлор (Cl 2 ) очень токсичен. если вы хотите собрать этот газ (или другой газ), вы можете использовать следующую схему. Итак, приступим. Приготовьте раствор хлорида натрия (NaCl).Положительный полюс источника питания соединяется с инертным электродом (например, графитовым стержнем), отрицательный полюс может быть из любого подходящего материала, проводящего ток. Поместите электроды в раствор и включите питание. Через несколько секунд вы уже можете почувствовать неприятный запах хлора (это хлор!). Не переборщите с запахом! Хлор выделяется на аноде в виде маленьких пузырьков («+»). Электролиз расплавов При электролизе расплавов в процесс вовлекаются ионы вещества, подвергающегося электролизу.Например, при электролизе солевого расплава (NaCl) на аноде будет выделяться тот же газ — хлор, но на катоде будет восстанавливаться чистый металл — натрий (Na) вместо водорода. Это метод, используемый в промышленности для получения металлического натрия и других щелочных металлов.
Таким же способом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)) с проведением тока через расплавы их солей. Стандартный тип: Стандартные электроды могут использоваться в вольтамперометрических ячейках SVC-2, SVC-3, VC-4 ∗ Одно уплотнительное кольцо входит в стандартную комплектацию. Также имеется дополнительное уплотнительное кольцо. 002247 Уплотнительное кольцо для CV-электрода (10 шт.) Характеристика [Привлекаются противоположные заряды]  Для этого нам понадобится раствор сульфата меди CuSO 4 , который содержит растворенную медь.Медь после водорода находится в диапазоне напряжений металлов, поэтому на электроде она будет выделяться.
Для этого нам понадобится раствор сульфата меди CuSO 4 , который содержит растворенную медь.Медь после водорода находится в диапазоне напряжений металлов, поэтому на электроде она будет выделяться.
Ток, проходящий через раствор на положительном электроде — аноде, восстанавливает отрицательно заряженные ионы (в нашем случае кислород).Отрицательно заряженные ионы называются анионами . На отрицательном электроде — катоде — положительные ионы (в данном случае водород и медь) перевернуты. Положительные ионы называются катионами . Но в некоторых химических соединениях катионы — это газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Но в некоторых химических соединениях катионы — это газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Электролиз раствора пищевой соли. Схема получения газа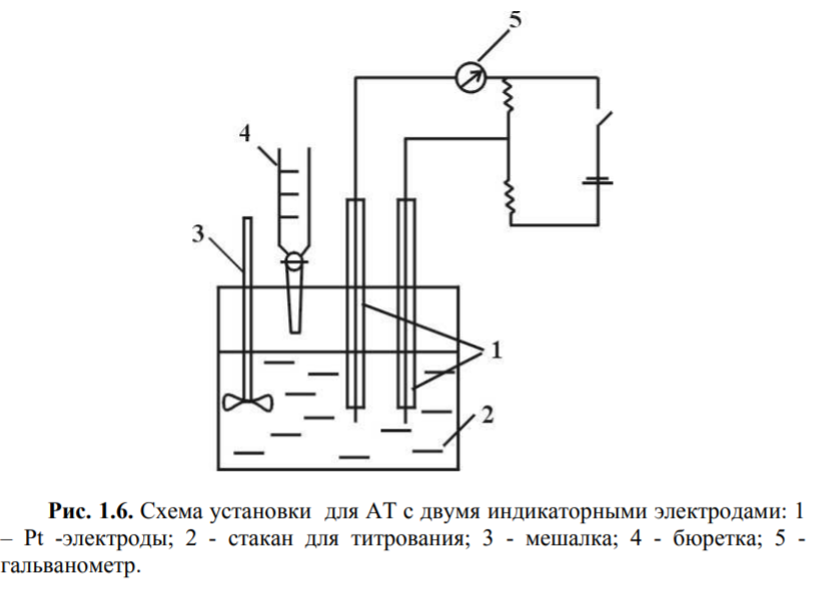 Чем дольше будет процесс электролиза, тем больше будет концентрация хлора рядом с электролитом.Если вы собираете хлор в пробирке или банке (хлор тяжелее воздуха, он найдется на дне), не пытайтесь «понюхать» его в банке — может сильно отравиться! (Статья про хлор).
Итак, чистый газообразный хлор восстанавливается на аноде. На катоде из раствора извлекают чистый водород (H 2 ) и извлекают H 2 и извлекают натрий, который немедленно реагирует с водой и образует едкий натр.
Чем дольше будет процесс электролиза, тем больше будет концентрация хлора рядом с электролитом.Если вы собираете хлор в пробирке или банке (хлор тяжелее воздуха, он найдется на дне), не пытайтесь «понюхать» его в банке — может сильно отравиться! (Статья про хлор).
Итак, чистый газообразный хлор восстанавливается на аноде. На катоде из раствора извлекают чистый водород (H 2 ) и извлекают H 2 и извлекают натрий, который немедленно реагирует с водой и образует едкий натр.
продуктов / мы / список | ALS, электрохимическая компания
TOP> Электроды и аксессуары> Линия рабочих электродов
Тип L: PEEK длинный тип с длиной 110 мм
Тип S: Внешний диаметр 3 мм, используется при измерении небольшого количества образца
Сетчатый электрод: Электролиз в объеме и т. д.Также может использоваться как противоэлектрод
∗ Для электродов диаметром 10 мм используйте режим VC-5 вольтамперометрической ячейки SVC-2.
∗ За исключением сетчатого электрода, кончик рабочего электрода полностью плоский (при изготовлении электрод с угольной пастой должен быть плоским).
∗ Что касается длины, то это ориентировочное значение.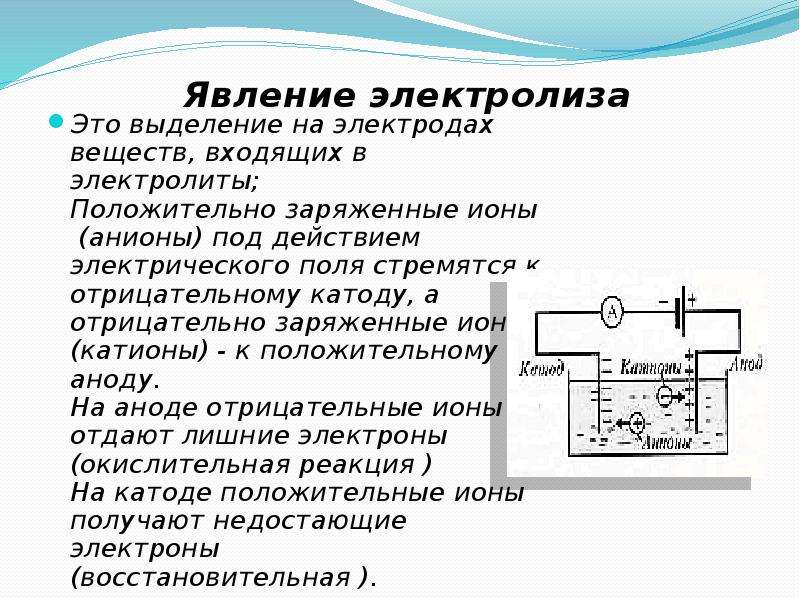
Стеклоуглеродный электрод с тефлоновым кольцом
• Обычный электрод
• Широкие перенапряжения для выделения кислорода и водорода
• Химически стабильный
• Улучшен для облегчения работы для получения химически модифицированного электрода
Для электрода из стеклоуглерода GCEt между изоляцией из ПЭЭК и диском из стеклоуглерода была включена тефлоновая прокладка.Что касается свойств материала, это позволит избежать растекания образца для получения химически модифицированной поверхности. Кат. № Описание Изоляция OD ID 013714 GCEt Стеклоуглеродный электрод PEEK 6 мм 3 мм 013715 GCEt Стеклоуглеродный электрод PEEK 10 мм 5 мм Стеклоуглеродный электрод
Характеристика
• Обычный электрод
• Большой перенапряжение для выделения кислорода и водорода
• Химически стабильный Кат. 
Описание Изоляция OD ID 002417 GCE Стеклоуглеродный электрод PEEK 10 мм 5 мм 002012 GCE Стеклоуглеродный электрод PEEK 6 мм 3 мм 012744 LGCE Стеклоуглеродный электрод PEEK 6 мм 3 мм 012297 GCE Стеклоуглеродный электрод PEEK 6 мм 1.6 мм 002411 GCE Стеклоуглеродный электрод PEEK 6 мм 1 мм 012298 GCE Стеклоуглеродный электрод PEEK 3 мм 1,6 мм 002412 SGCE Стеклоуглеродный электрод PEEK 3 мм 1 мм 002002 MCE Электрод из микрофибры Стекло 4 мм 33 мкм 002007 MCE Электрод из микрофибры Стекло 4 мм 7 мкм Золотой электрод
Характеристика
• Обычный электрод
• Нет волны адсорбции водорода
• Используется для обнаружения тиолов Кат. 
Описание Изоляция OD ID 002418 AUE Золотой электрод PEEK 10 мм 5 мм 002421 AUE Золотой электрод PEEK 6 мм 3 мм 012746 LAUE Золотой электрод PEEK 6 мм 3 мм 002014 AUE Золотой электрод PEEK 6 мм 1.6 мм 002314 SAUE Электрод золотой PEEK 3 мм 1,6 мм 002010 Электрод MAUE Micro gold Стекло 4 мм 100 мкм 002004 Электрод MAUE Micro gold Стекло 4 мм 25 мкм 002006 Электрод MAUE Micro gold Стекло 4 мм 10 мкм Платиновый электрод
Элемент
• Обычный электрод
• Генерация волны адсорбции водорода
• Используется для обнаружения h3O2 и окислителя Кат. 
Описание Изоляция OD ID 002420 PTE Платиновый электрод PEEK 10 мм 5 мм 002422 PTE Платиновый электрод PEEK 6 мм 3 мм 012745 LPTE Платиновый электрод PEEK 6 мм 3 мм 002013 PTE Платиновый электрод PEEK 6 мм 1.6 мм 002313 Электрод платиновый SPTE PEEK 3 мм 1,6 мм 002009 Электрод MPTE Micro Platinum Стекло 4 мм 100 мкм 002003 Электрод MPTE Micro Platinum Стекло 4 мм 25 мкм 002015 MPTE Микроплатиновый электрод Стекло 4 мм 15 мкм 002005 Электрод MPTE Micro Platinum Стекло 4 мм 10 мкм Серебряный электрод
Элемент
• Для обнаружения цианидов и сульфидов Кат. 
Описание Изоляция OD ID 002416 AGE Серебряный электрод PEEK 10 мм 5 мм 002419 AGE Серебряный электрод PEEK 6 мм 3 мм 002011 AGE Серебряный электрод PEEK 6 мм 1,6 мм 002315 SAGE Серебряный электрод PEEK 3 мм 1.6 мм Никелевый электрод
IGCSE Химия: Электролиз
Электролиз
1,47 понять
электрический ток как поток электронов или ионов Ток — это в основном поток заряженных частиц в металле.
проволока, это поток электронов. У них 1 отрицательный заряд. Ионы
заряженные частицы тоже, поскольку они потеряли или приобрели электроны. Движения
эти ионы отвечают за проводимость электричества.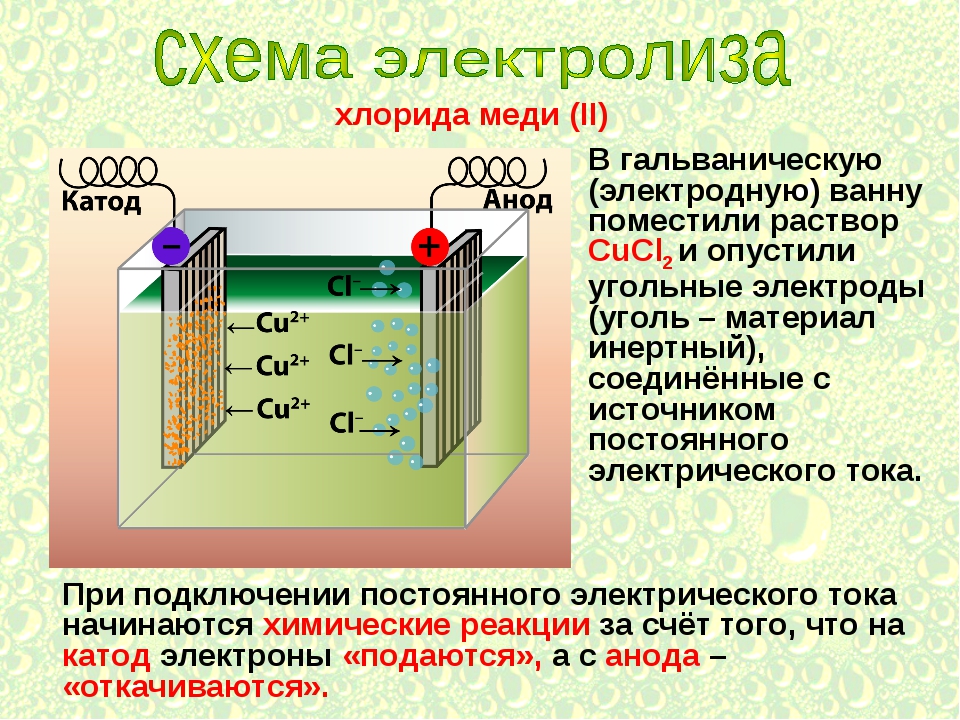 1,48 понять, почему ковалентные соединения не проводят электричество Ковалентные соединения не
иметь запасные свободные электроны, которые могут двигаться и переносить заряд; и тоже
они содержат ионы — это ковалентное соединение не ионное соединение . 1,49 понять, почему ионные соединения проводят электричество только тогда, когда
расплавленный или в растворе Когда они твердые,
ионы не могут свободно перемещаться и нести заряд. Когда они расплавлены — как в нем
находится в расплавленной форме — ионы могут свободно перемещаться.Помните в жидкостях частицы
могут скользить друг по другу и двигаться, тогда как в твердых телах частицы могут
вибрировать только в фиксированном положении. Когда ионное соединение растворяется в
растворитель, чтобы образовать раствор, ионы также получают возможность двигаться. 1,50 описать простые эксперименты, чтобы различать
электролиты и неэлектролиты 1,51 напомним, что при электролизе образуются новые
вещества, когда ионные соединения проводят электричество Пропускание электрического тока через соединение, которое либо
расплавленный или в растворе вызывает химические изменения, химические реакции производят новые
продукты — новые вещества.
1,48 понять, почему ковалентные соединения не проводят электричество Ковалентные соединения не
иметь запасные свободные электроны, которые могут двигаться и переносить заряд; и тоже
они содержат ионы — это ковалентное соединение не ионное соединение . 1,49 понять, почему ионные соединения проводят электричество только тогда, когда
расплавленный или в растворе Когда они твердые,
ионы не могут свободно перемещаться и нести заряд. Когда они расплавлены — как в нем
находится в расплавленной форме — ионы могут свободно перемещаться.Помните в жидкостях частицы
могут скользить друг по другу и двигаться, тогда как в твердых телах частицы могут
вибрировать только в фиксированном положении. Когда ионное соединение растворяется в
растворитель, чтобы образовать раствор, ионы также получают возможность двигаться. 1,50 описать простые эксперименты, чтобы различать
электролиты и неэлектролиты 1,51 напомним, что при электролизе образуются новые
вещества, когда ионные соединения проводят электричество Пропускание электрического тока через соединение, которое либо
расплавленный или в растворе вызывает химические изменения, химические реакции производят новые
продукты — новые вещества.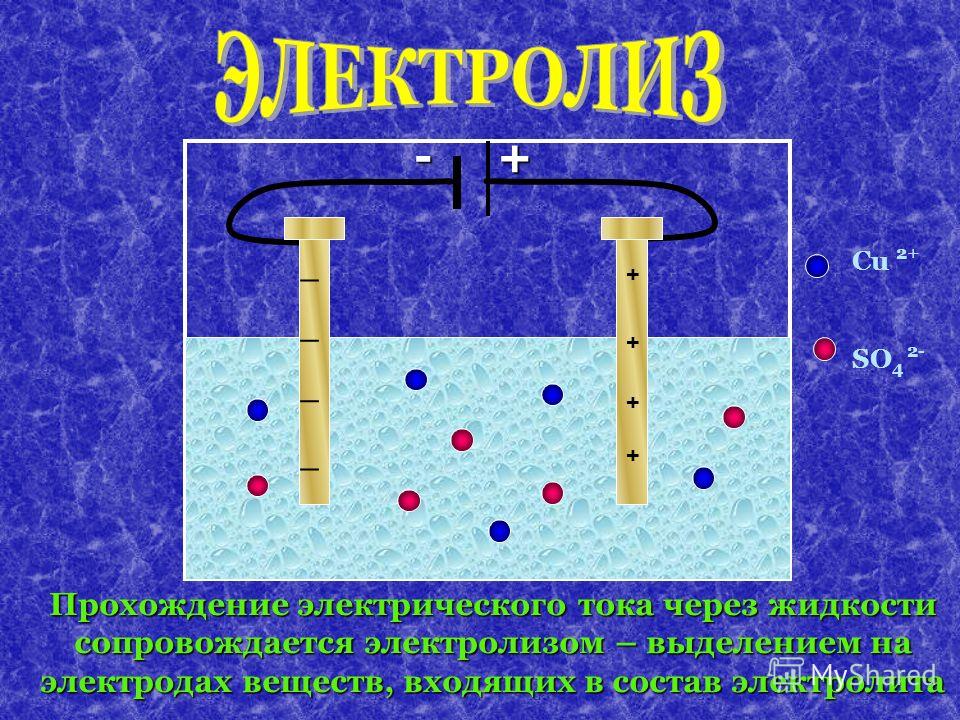 1.52 описывают простые эксперименты по электролизу с использованием инертных
электроды из расплавов солей, таких как бромид свинца (II)
1.52 описывают простые эксперименты по электролизу с использованием инертных
электроды из расплавов солей, таких как бромид свинца (II)
Правый электрод: Cat hode — притягивает ионы cat — является отрицательным электродом, так как он притягивает положительные ионы. Левый электрод: од — притягивает и ионы — является положительным электродом, так как он притягивает отрицательные ионы.
Ничего не происходит, пока
бромид свинца (II) плавится. Бромид свинца (II) является
ионное соединение. Твердое тело состоит из гигантской структуры из ионов свинца (II) и
бромид-ионы упорядочены в кристаллической решетке. У него нет мобильного
электронов, а ионы плотно заперты в решетке и не могут
переехать. Твердый бромид свинца (II) не проводит электричество.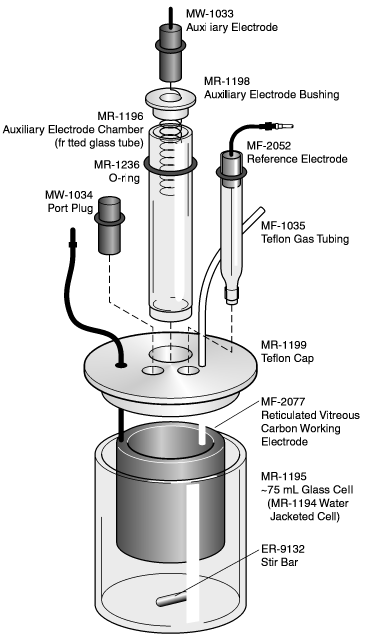 Как только твердое тело
тает, ионы действительно получают возможность двигаться, и именно это движение
позволяет электронам течь во внешней цепи.Электроды сделаны из
углерод — инертный (инертный). Как только вы подключите
источник питания, он откачивает любые подвижные электроны от левого электрода
в сторону правого. Избыток электронов в правом электроде
делает его отрицательно заряженным, называемым катодом. Левый электрод
положительно заряжен, потому что в нем мало электронов. Есть предел тому, как
много электронов могут втиснуться в отрицательный электрод (катод) из-за
отталкивание электронами уже есть.Положительный вывод (II)
ионы притягиваются к катоду, который является отрицательным электродом. Когда они
попадая туда, они получают по 2 электрона от электрода и образуют нейтральный свинец
атомы. Они падают на дно емкости в виде расплавленного свинца. Это оставляет места в
катод, в который может двигаться больше электронов. Источник энергии качает новые электроны
вдоль проволоки, чтобы заполнить эти пробелы.
Как только твердое тело
тает, ионы действительно получают возможность двигаться, и именно это движение
позволяет электронам течь во внешней цепи.Электроды сделаны из
углерод — инертный (инертный). Как только вы подключите
источник питания, он откачивает любые подвижные электроны от левого электрода
в сторону правого. Избыток электронов в правом электроде
делает его отрицательно заряженным, называемым катодом. Левый электрод
положительно заряжен, потому что в нем мало электронов. Есть предел тому, как
много электронов могут втиснуться в отрицательный электрод (катод) из-за
отталкивание электронами уже есть.Положительный вывод (II)
ионы притягиваются к катоду, который является отрицательным электродом. Когда они
попадая туда, они получают по 2 электрона от электрода и образуют нейтральный свинец
атомы. Они падают на дно емкости в виде расплавленного свинца. Это оставляет места в
катод, в который может двигаться больше электронов. Источник энергии качает новые электроны
вдоль проволоки, чтобы заполнить эти пробелы. Бромид-ионы притягиваются
к положительному аноду. Когда они попадают туда, дополнительный электрон, который заставляет
отрицательно заряженный ион бромида перемещается на анод, потому что этот электрод
не хватает электронов.Потеря лишнего
электрон превращает каждый ион бромида в атом брома. Они соединяются парами (связь
ковалентно) с образованием молекул брома. В целом: Новые электроны на
анод откачивается источником энергии, чтобы помочь заполнить создаваемые пространства
на катоде. Ионы разряжены на электродах .
Разряд иона означает просто потерю заряда — либо отказ
электрон (-ы) на электрод или получение электрон (-ов) от него. Оглянись на ионный
уравнения, видим, что ионы свинца (II) приобретают электроны на катоде.Прирост
электроны — это сокращение. Ионы свинца (II) восстанавливаются до атомов свинца. Бромид-ионы теряют
электроны на аноде. Потеря электронов — это окисление. Бромид-ионы окисляются
к молекулам брома.
Бромид-ионы притягиваются
к положительному аноду. Когда они попадают туда, дополнительный электрон, который заставляет
отрицательно заряженный ион бромида перемещается на анод, потому что этот электрод
не хватает электронов.Потеря лишнего
электрон превращает каждый ион бромида в атом брома. Они соединяются парами (связь
ковалентно) с образованием молекул брома. В целом: Новые электроны на
анод откачивается источником энергии, чтобы помочь заполнить создаваемые пространства
на катоде. Ионы разряжены на электродах .
Разряд иона означает просто потерю заряда — либо отказ
электрон (-ы) на электрод или получение электрон (-ов) от него. Оглянись на ионный
уравнения, видим, что ионы свинца (II) приобретают электроны на катоде.Прирост
электроны — это сокращение. Ионы свинца (II) восстанавливаются до атомов свинца. Бромид-ионы теряют
электроны на аноде. Потеря электронов — это окисление. Бромид-ионы окисляются
к молекулам брома.
1,54 написать ионные полууравнения, представляющие реакции в
электроды при электролизе Для электролиза бромида свинца (II) PbBr 2 .


 87
87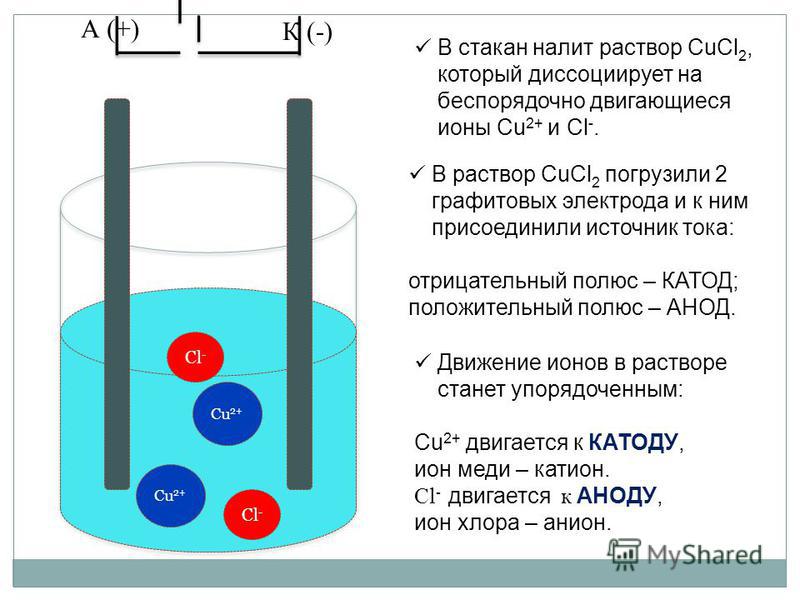 017
017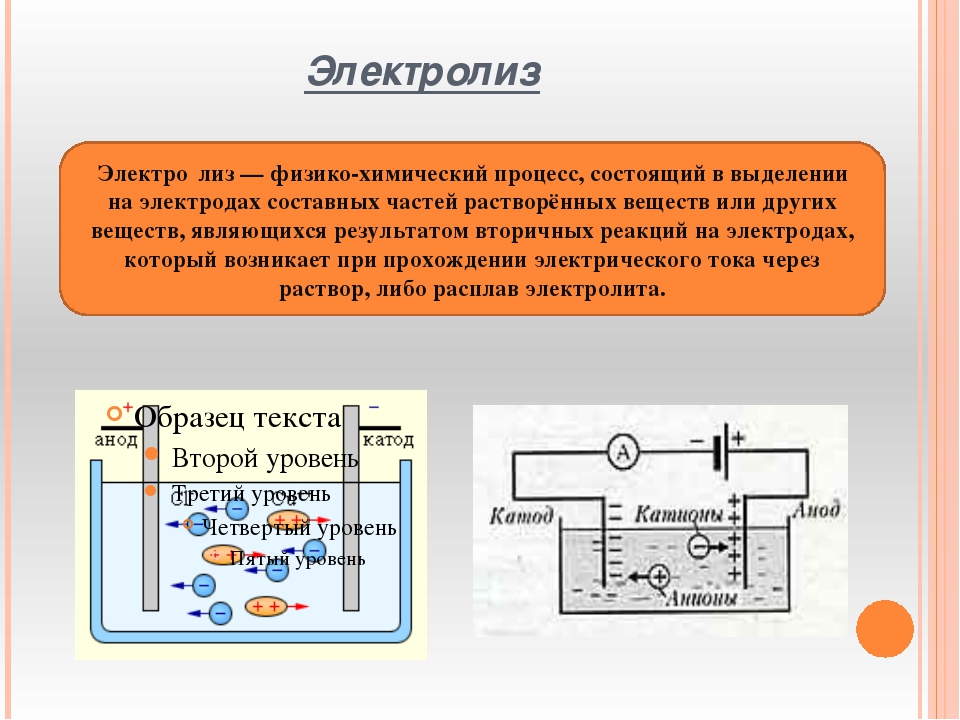 31
31 92
92


 Важно помнить шаблоны, приведенные в следующем разделе.
Важно помнить шаблоны, приведенные в следующем разделе. Если раствор очень разбавлен , вы получите водород. При промежуточных концентрациях вы можете получить и то, и другое.
Если раствор очень разбавлен , вы получите водород. При промежуточных концентрациях вы можете получить и то, и другое.
 Самый простой способ — представить это в терминах гидроксид-ионов.
Самый простой способ — представить это в терминах гидроксид-ионов.

 На самом деле, ионы гидроксида немного легче разряжать, но в основном вы получаете хлор.
На самом деле, ионы гидроксида немного легче разряжать, но в основном вы получаете хлор.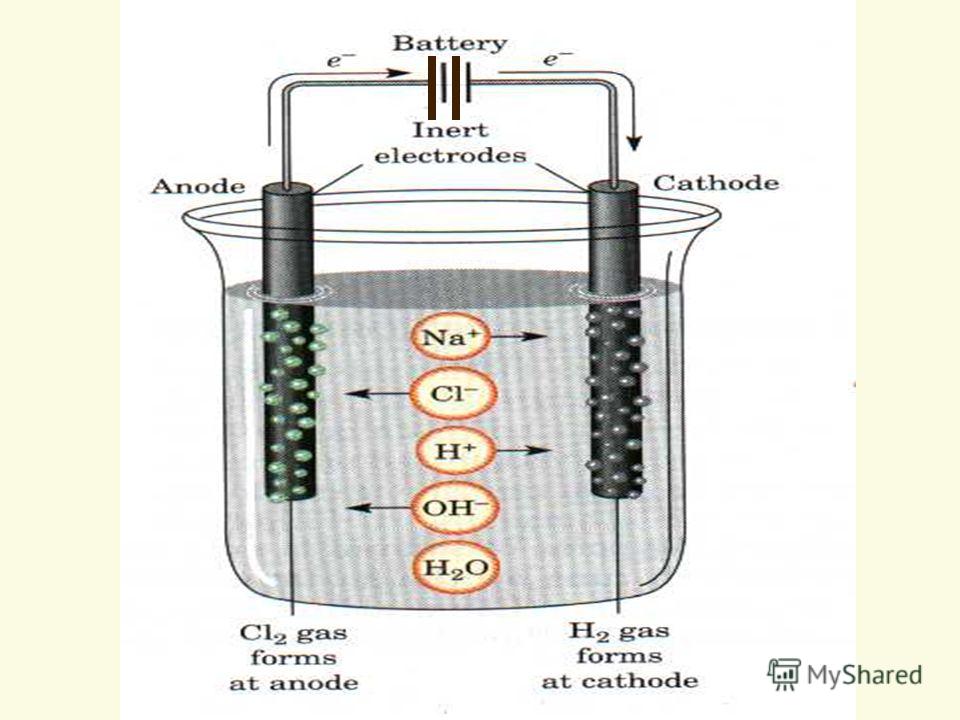
 Он растворяется в ртути с образованием раствора, известного как «натриевая амальгама».
Он растворяется в ртути с образованием раствора, известного как «натриевая амальгама».

 Медь осаждается на катоде, как и следовало ожидать, но вместо кислорода, выделяемого на аноде, ионы меди (II) переходят в раствор. Опять же, есть чистый перенос меди от анода к катоду.
Медь осаждается на катоде, как и следовало ожидать, но вместо кислорода, выделяемого на аноде, ионы меди (II) переходят в раствор. Опять же, есть чистый перенос меди от анода к катоду.
 Вы можете собирать и измерять объем выделяемых газов, собирая их над водой в перевернутые мерные цилиндры или в газовые шприцы.
Вы можете собирать и измерять объем выделяемых газов, собирая их над водой в перевернутые мерные цилиндры или в газовые шприцы.