Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.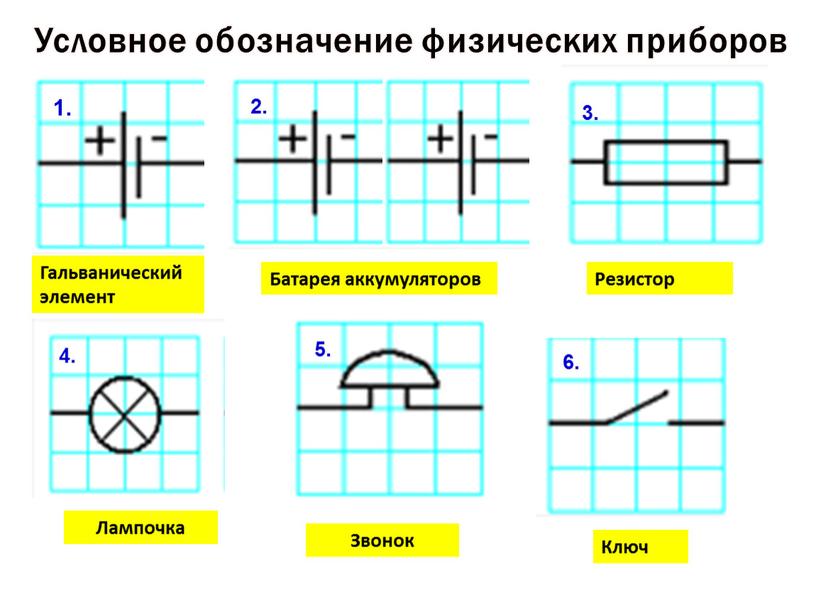
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Схемы гальванических элементов меди | Задача 650
Задача 650.
Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом — анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных Э. Д.С.
Решение:
а) Гальванический элемент, в котором медь служит катодом.
Схема гальванического элемента:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соедини-тельную трубку, обычно, заполненную раствором электролита).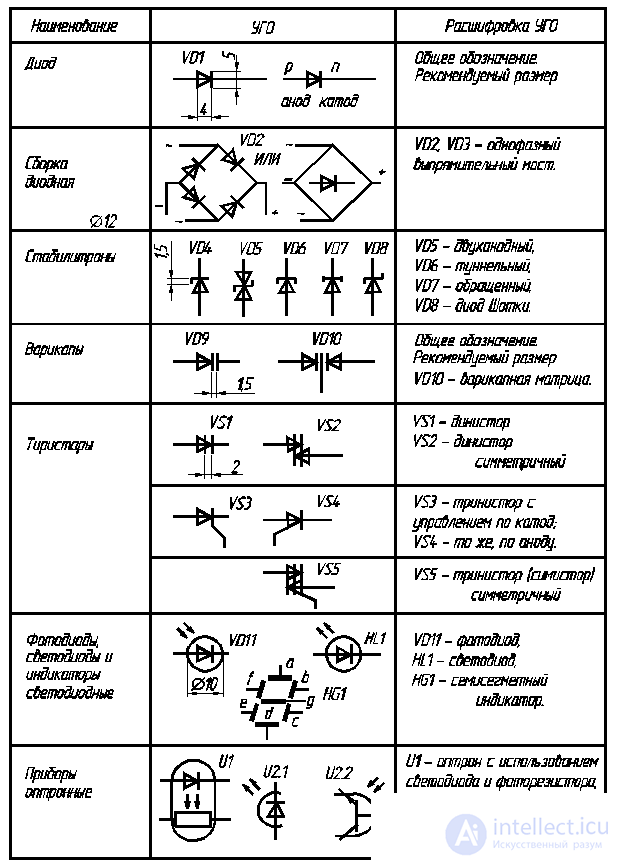 Железо имеет меньший потенциал (-0,44В) и является анодом, на котором протекает окислительный процесс:
Железо имеет меньший потенциал (-0,44В) и является анодом, на котором протекает окислительный процесс:
Fe0 — 2 = Fe2+
Медь, потенциал которой +0,34В, — катод, т. е. электрод, на котором протекает восстановительный процесс:
Cu2+ + 2 Cu0
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Fe0 + Cu2+ = Fe2+ + Cu0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
E1 = Cu — Fe;
E1 = -44 — (+33) = -0,78B.
б) Гальванический элемент, в котором медь служит катодом.
Схема гальванического элемента:
Медь имеет меньший потенциал (+0,34В) и является анодом, на котором протекает окислительный процесс:
Cu0 + 2 = Cu2+
Ртуть, потенциал которой +0,86В, — катод, т.
Hg2+ — 2 + Hg0
Рассчитаем ЭДС данного элемента:
E2 =Hg — Cu;
E2 + +o,86 — (+0,34) = 0,52B.
Задача 651.
В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев?
Решение:
а)
Поскольку потенциал магния меньше потенциала свинца, то магниевый электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от магниевого электрода к свинцовому электроду. Следовательно, магний в данном случае будет растворяться.
б)
Поскольку потенциал свинца меньше потенциала меди, то свинцовый электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от свинцового электрода к медному электроду.
в)
Поскольку потенциал меди меньше потенциала серебра, то медный электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от медного электрода к серебряному электроду. Следовательно, медь в данном элементе будет растворяться.
Ответ: а) от Mg к Pb; б) от Pb к Cu; в) от Cu к Ag.
Схема гальванического элемента. 145 — 146
Схема кобальто-хромового гальванического элемента
Задача 8.
Составить схему гальванического элемента, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л. Описать процессы, которые протекают на катоде и аноде, и вычислить ЭДС гальванического элемента.
Электродные потенциалы металлов:
E(Cr3+/Cr) = -0,74 B; E(Co2+/Co) = -0,28 B.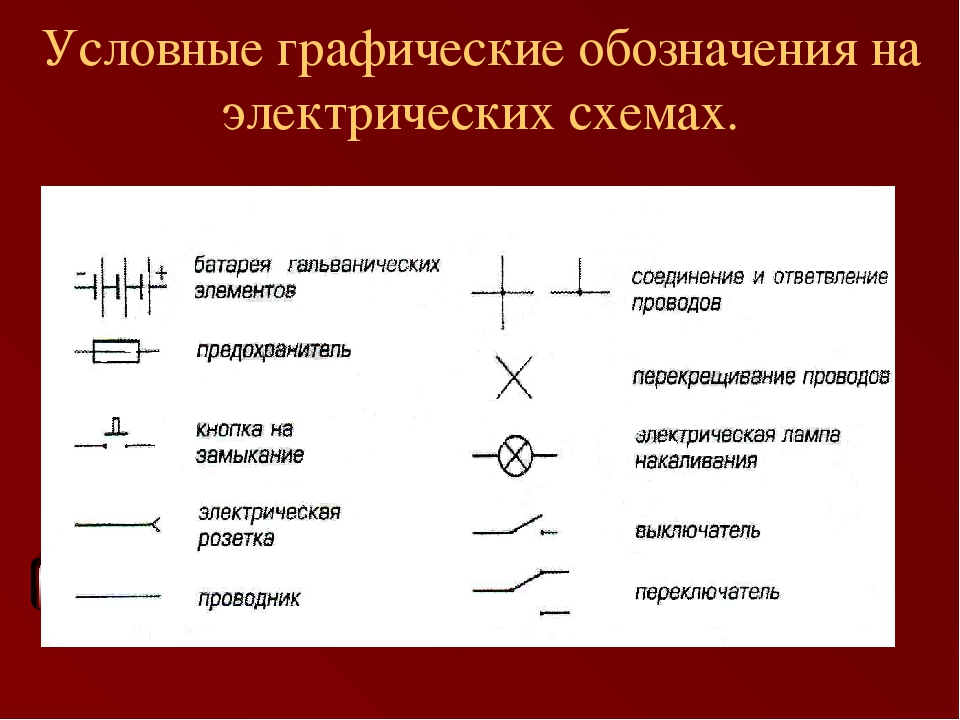
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к хромовому, т.е. кобальтовый электрод будет катодом, хромовый — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|Co2+(1M)||Cr3+(1M)|Cr(+)
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Cr0 — 3 = Cr3+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам.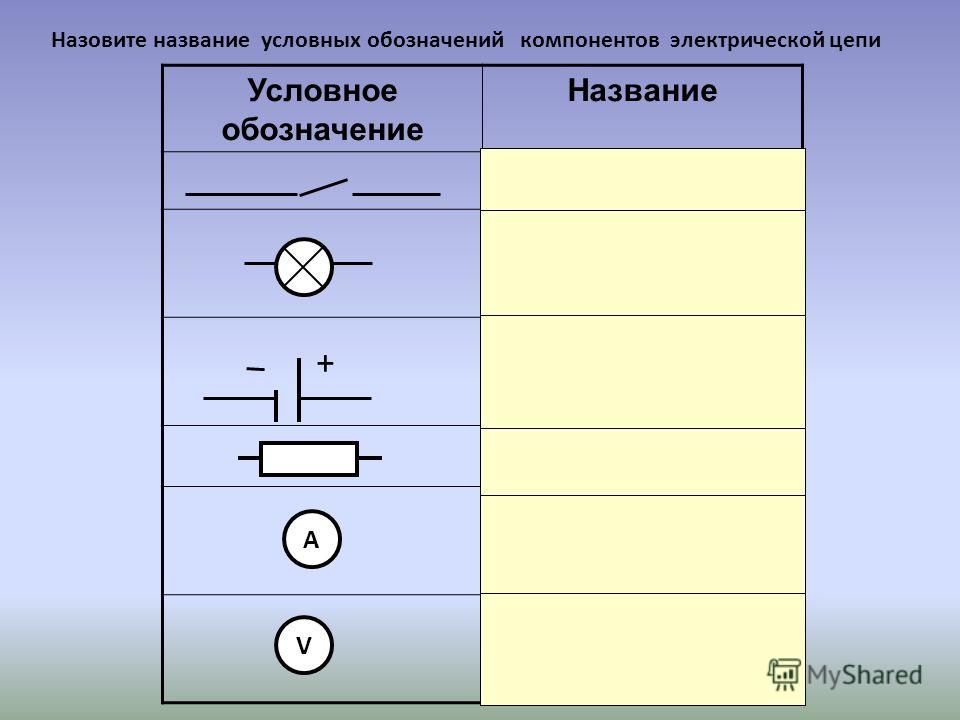
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,74) = +0,46 В.
Схема гальванического элемента составленного из кобальта и железа
Задача 146.
Дать схему гальванического элемента составленного из кобальтовой и железной пластинок, опущенных в 1М растворы их сульфатов. Указать направление движения электронов в сети и ионов в растворе. Написать уравнения катодного и анодного процессов во время работы элемента и вычислить ЭДС элемента.
Электродные потенциалы металлов:
E(Fe2+/Fe) = -0,44 B; E(Co2+/Co) = -0,28 B.
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Fe, опущенные в растворы их сульфатов с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала.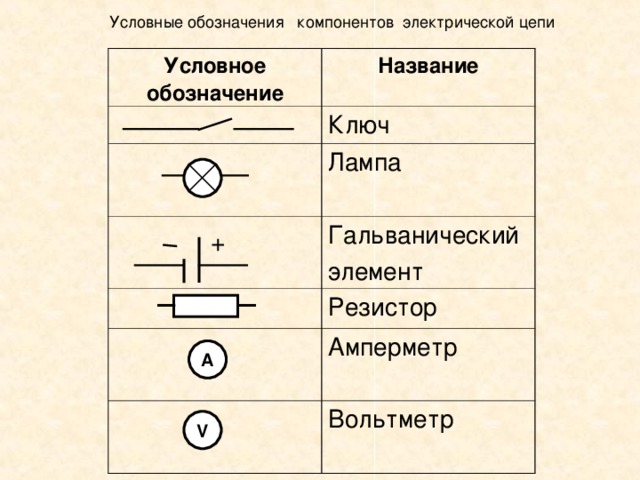 Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к железной пластинки, т.е. кобальтовая пластинка будет катодом, железная пластинка — анодом.
Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к железной пластинки, т.е. кобальтовая пластинка будет катодом, железная пластинка — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|CoSO4(1M)||FeSO4
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Fe0 — 2 = Fe2+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам. К катоду будут двигаться ионы Со2+ и там разряжаться, а к аноду будут двигаться ион SO42- которые соединяются с ионами Fe2+, образуя FeSO4:
Fe2+ + SO42- = FeSO4.
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,44) = +0,16 В.
Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них
1. В г. э. работа производится, поэтому ЭДС элемента считается величиной положительной.
2. Величина ЭДС гальванической цепи Еопределяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) – правило правого полюса.Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительным (протекает процесс восстановления).
3. Границу раздела между проводником I рода и проводником II рода обозначают одной чертой.
4. Границу между двумя проводниками II рода изображают пунктирной чертой.
5. Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами.
6. Компоненты одной фазы записывают через запятую.
7. Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме (Ох), а справа – в восстановленной (Red).
Гальванический элемент Даниэля‑Якобисостоит из цинковой и медной пластин, погруженных в соответствующие растворы ZnSO4 и CuSO4, которые разделены солевым мостиком с раствором KCl: электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствует их взаимной диффузии.
(‑) Zn | Zn 2+:: Cu 2+| Cu (+)
Реакции на электродах:
Zn0 → Zn2++ 2e¯
Cu2++ 2е¯ → Cu0
Суммарный окислительно‑восстановительный процесс:
Cu2++ Zn0 → Cu0+ Zn2+
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала.
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента Е.
ЭДС элемента EZn/Cu = φCu2+/Cu + φZn2+/Zn + φк + φдиф.
Без учета φдиф и φк: EZn/Cu = φCu2+/Cu + φZn2+/Zn = ЕCu2+/Cu + ЕZn2+/Zn – гальванические элементы, состоящие из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом случае будет являться электрод с большей концентрацией, т. к. стандартные электродные потенциалы обоих электродов равны.
Концентрационные цепи
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный.
Работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Классификация электродов
Электроды первого рода. Металлическая пластинка, погруженная в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл.
Электроды второго рода.Металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона.
Электроды сравнения – электроды с точно известными и воспроизводимыми значениями потенциалов.
Водородный электродпредставляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом.
Pt, Н2 / Н+
Электрохимическое равновесие на электроде:
2Н++ 2е¯ ↔ Н2.
Потенциал стандартного водородного электрода (с активностью ионов Н+1 моль/л и давлением водорода 101,3 кПа) принят равным нулю.
Электродный потенциал нестандартного водородного электрода:
Каломельный электродсостоит из ртутного электрода, помещенного в раствор KCl, определенной концентрации и насыщенный каломелью Hg2Cl2:
Hg / Hg2Cl2, KCl
Каломельный электрод обратим относительно анионов хлора
Хлорсеребряный электрод – обратим относительно анионов хлора:
Ag / AgCl, KCl
Если раствор KCl – насыщенный, то EAgCl = 0,2224 – 0,00065(t – 25), В.
Индикаторные электроды. Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе.
Хингидронный электродпредставляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4O2 • С6Н4(OH)2 – соединения хинона С6Н4O2 и гидрохинона С6Н4(OH)2, способных к взаимопревращению в равновесном окислительно‑восстановительном процессе, в котором участвуют ионы водорода:
С6Н4O2 + 2H++ 2е¯ → С6Н4(OH)2
Наиболее часто употребляется стеклянный электродв виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется буферным раствором с определенным значением рН, в который погружен вспомогательный электрод (обычно хлорсеребряный). Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. Шарик стеклянного электрода предварительно обрабатывают в течение длительного времени раствором кислоты. При этом ионы водорода внедряются в стенки шарика, замещая катионы щелочного металла. Электродный процесс сводится к обмену ионами водорода между двумя фазами – исследуемым раствором и стеклом: Нр‑р ↔ Нст+.
Стандартный потенциал Ест0для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
Окислительно‑восстановите льные электроды
Электрод, состоящий из инертного проводника 1‑го рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно‑восстановительнымили редокс‑электродом.
Электродная реакция: Охn++ nе¯ ↔ Red.
В данном случае инертный Meпринимает косвенное участие в электродной реакции, являясь посредником передачи электронов от восстановленной формы Me (Red) к окисленной (Ох) или наоборот.
Гальванический элемент. Понятие ЭДС. Элемент Даниэля-Якоби — Студопедия
Гальванический элемент состоит из двух электродов — анода и катода. Его устройство и принцип работы рассмотрим на примере элемента Даниэля-Якоби. В этом элементе используют медный и цинковый электроды. Каждый электрод помещен в ёмкость с раствором электролита, катионы которых «одноимённый» материалу электрода. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO4.При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления:
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал .
Между медным электродом и окружающем его раствором CuSO4 идёт реакция восстановления:
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен .
Ещё раз подчеркну, что в гальваническом элементе окисление — отдача электронов —происходит на аноде ( цинковый электрод), восстановление — приобретение электронов — на катоде (медном электроде).
Рекомендуется запомнить правило: окисление происходит на аноде, который заряжается отрицательно, — слова начинаются с гласных «о» и «а», восстановление наблюдается на положительно заряжённом катоде — слова начинаются с согласных «в» и «к».
Процесс на электродах:
(+)
(-)
Суммарная окислительно-восстоновительная реакция гальванического элемента.
Между двумя растворами — сульфата цинка и сульфата меди — находится солевой мостик (СМ). Солевой мостик обычно выполняется в виде трубки, заполненной раствором хлорида калия (КСl) или нитрата аммония (NH4NO3). На границе между насыщенным раствором солевого мостика и растворами электродов ZnSO4 и CuSO4 возникают два диффузионных потенциала, которые близки по абсолютному значению, но противоположны по знаку. Солевой мостик способствует значительному снижению диффузионного потенциала между растворами электролитов.
Характерной особенностью любого гальванического элемента является образование электрохимической цепи — последовательной совокупности всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Электрохимическую цепь медно-цинкового гальванического элемента с учётом возникших скачков потенциалов можно записать следующим образом:
(1)
Одной вертикальной чертой обозначена граница между металлом и раствором электролита, на которой возникают электродные потенциалы и .
Двумя чертами обозначена граница между двумя электролитами, проходящая через солевой мостик ( . — диффузионный потенциал на этой границе). Вертикальной пунктирной линией показана граница между двумя металлами; на этой границе возникает контактный потенциал . Солевой мостик позволяет устранить диффузионный потенциал увеличивался бы по мере работы гальванического элемента.
Смысл записи электрической цепи, если её читать слева направо, следующий: анод, т.е цинковый электрод, погружён в раствор ZnSO4, содержащий ионы Zn2+; солевой мостик соединят один раствор электролита с другим, содержанием ионы двух валентной меди; катод, погружённый в раствор CuSO4, при диссоциации которого образуются ионы меди Cu2+. Во внешней цепи электроны перемещаются от анода к катоду (это перемещение показано на рис. стрелкой).
Условие (1) определяет работу гальванического элемента, когда его цепь замкнута. Это условие выполняется в результате присоединения к клеммам гальванического элемента потребляя или измерительных приборов.
ЭДС — это предельное значение разности потенциалов гальванического элемента, которое наблюдается в условиях равенства нулю тока во внешней цепи и когда устанавливаются все химические и локальные равновесия в фазах и на границы фаз, за исключением границы электрод — электрод.
Применительно к гальваническому элементу Даниэля — Якоби разомкнутая цепь гальванического элемента представлена условием (1) без границе разделаCu(+)/Zn, которая обозначена вертикальной пунктирной линией.
В соответствии с условием (1) ЭДС разомкнутого гальванического элемента равна алгебраической сумме скачков потенциалов на границе раздела фаз:
Если пренебречь диффузионным потенциалом (при наличии солевого мостика он ничтожно мал), а контактный потенциал незначителен (или равен нулю после присоединения потребителя), то ЭДС медно-цинкового гальванического элемента будет равна:
или
ЭДС является количественной характеристикой работы гальванического элемента — она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую. Принято считать, что величина ЭДС всегда положительна.
Так как абсолютное значение потенциала нельзя измерить, то пользуются значением условного потенциала. Условный потенциал данного электрода — это ЭДС гальванического элемента, состоящего из стандартного водородного электрода ( = 0) и данного электрода на отрицательном полюсе гальванического элемента всегда идёт процесс окисления, на положительном- восстановления. полюс гальванического элемента определяется только по отношению ко второму электроду. На отрицательном полюсе гальванического элемента всегда идет процесс окисления, на положительном — восстановления. Полюс гальванического элементаопределяется только по отношению ко второму электроду.
Рассмотрим гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
Zn-2e « Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn — 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
— движение электронов во внешней цепи;
— движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток. Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента.
Она равна разности электродных потенциалов катода и анода:
(7.3)
В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии:
А = -DG0 (7.4)
В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е.
А = nFE0, (7.5)
где n — число электронов, участвующих в реакции;
F — постоянная Фарадея, равная 96500 Кл/моль;
E0 — стандартная ЭДС гальванического элемента (T = 298 К, молярная концентрация электролитов равна 1 моль/дм3). Таким образом, максимальная работа гальванического элемента равна:
А = -DG0 = nFE0. (7.6)
Стандартная ЭДС гальванического элемента равна:
(7.7)
Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные.
Химические гальванические элементы — это такие элементы, где электроды и электролиты различны. Примером химического гальванического элемента является элемент Якоби-Даниэля.
Схема гальванического элемента | Химик.ПРО – решение задач по химии бесплатно
Свинцовую и цинковую пластины опустили в раствор нитрата серебра. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником? Напишите схему гальванического элемента.
Решение задачи
Запишем уравнения химических реакций, происходящих на пластинах.
Свинцовая пластина:
Pb0 – 2e– → Pb2+
Ag+ + e– → Ag+
Цинковая пластина:
Zn0 – 2e– → Zn2+
Ag+ + e– → Ag0
Если наружные концы пластин соединить проводником, образуется гальванический элемент.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Составим схему гальванического элемента:
Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb
Сравним стандартные электродные потенциалы цинка (Zn) и свинца (Pb):
E0(Zn2+/Zn0) = – 0,76 В,
E0(Pb 2+/ Pb 0) = – 0,13 В.
Цинк (Zn) – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому является более сильным восстановителем. Следовательно, цинк (Zn) будет подвергаться окислению под действием ионов свинца (Pb), и электроны от цинка (Zn) будут переходить к свинцу(Pb):
Таким образом, Zn – анод (А) и Zn – восстановитель, Pb – катод.
(–) Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb (+)
Электроны двигаются от цинка к свинцу. Схема гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах на пластинах, и составим суммарное уравнение:
(-) (А) Zn0 – 2e– → Zn2+ – процесс окисления
(+) (K) Ag+ + e– → Ag0 – процесс восстановления
Схема гальванического элемента
Вывод:
при замыкании пластин цинковая пластина растворяется, а на свинцовой пластине осаждается серебро.
17.2 Гальванические элементы — химия 2e
17.2 Гальванические элементы — химия 2e | OpenStaxSkip to Content- Предисловие
- Введение
- 1.1 Химия в контексте
- 1.2 Фазы и классификация вещества
- 1.3 Физические и химические свойства
- 1.4 Измерения
- 1.5 Погрешность измерения, точность, точность
- 1.6 9000 Обработка результатов измерений
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- 2 Атомы, молекулы и ионы
- Введение
- 2.1 Ранние идеи в атомной теории
- 2.2 Развитие атомной теории
- 2.3 Атомная структура и символика
- 2.4 Химические формулы
- 2.5 Периодическая таблица
- 2.6 Молекулярные и ионные соединения
- 2.7 Химическая номенклатура
- Ключевые термины Уравнения
- Резюме
- Упражнения
- Введение
- 3.1 Формула массы и концепция крота
- 3.2 Определение эмпирических и молекулярных формул
- 3.3 Молярность
- 3.4 Другие единицы для концентраций растворов
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение в химический баланс
- Химические уравнения
- 4.2 Классификация химических реакций
- 4.3 Стехиометрия реакции
- 4.4 Выходы реакций
- 4.5 Количественный химический анализ
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 5.1 Основы энергетики
- 5.2 Калориметрия
- 5.3 Энтальпия
- Ключевые термины
- Ключевые слова
- Упражнения
- 6 Электронная структура и периодические свойства элементов
- Введение
- 6.1 Электромагнитная энергия
- 6.2 Модель Бора
- 6.3 Развитие квантовой теории
- 6.4 Электронная структура атомов (электронные конфигурации)
- 6.5 Периодические изменения свойств элементов
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
Связывание и молекулярная геометрия - Введение
- 7.1 Ионное связывание
- 7.2 Ковалентное связывание
- 7.3 Символы и структуры Льюиса
- 7.4 Формальные заряды и резонанс
- 7.5 Сила ионных и ковалентных связей
- 7.6 Молекулярная структура и полярность
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- Ковалентной связи 8.1 Теория валентной связи
- 8.2 Гибридные атомные орбитали
- 8.3 Множественные связи
- 8.4 Теория молекулярных орбиталей
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение1 Давление газа
- 9.2 Соотношение давления, объема, количества и температуры: закон идеального газа
- 9.3 Стехиометрия газообразных веществ, смесей и реакций
- 9.4 Истечение и диффузия газов
- 9.5 Кинетико-молекулярная теория
- 9.6 Неидеальное поведение газа
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 10.1 Межмолекулярные силы
- 10.2 Свойства жидкостей
- 10.3 Фазовые переходы
- 10.4 Фазовые диаграммы
- 10.5 Твердое состояние вещества
- 10.6 Структуры решеток в кристаллических твердых телах
- Ключевые термины
- Ключевые уравнения
- Резюме
- Введение
- 11.1 Процесс растворения
- 11.2 Электролиты
- 11.3 Растворимость
- 11.4 Коллигативные свойства
- 11.5 Коллоиды
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 12.1 Скорость химических реакций
- 12.2 Факторы, влияющие на скорость реакции
- 12.3 Законы о нормах
- Интегрированные нормы
- Теория столкновений
- 12.6 Механизмы реакций
- 12.7 Катализ
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 13.1 Химическое равновесие
- 13.2 Константы равновесия
- 13.3 Сдвиг равновесия: принцип Ле Шателье
- 13.4 Расчет равновесия
- Ключевые термины
- Ключевые уравнения
- Резюме
- Exercises
- Растворение 150004
- Введение
- Введение
- Кислоты и основания Льюиса
- 15.3 Связанные равновесия
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение
- 16.1 Спонтанность
- 16.2 Энтропия
- 16.3 Второй и третий законы термодинамики
- 16.4 Свободная энергия
- Ключевые термины
- Ключевые уравнения
- Резюме
- Упражнения
- Введение в химию
- 17.2 Гальванические элементы
- 17.3 Электроды и потенциалы элементов
- 17.4 Потенциал, свободная энергия и равновесие
- 17,5 Батареи и топливные элементы
- 17.6 Коррозия
- 17.7 Электролиз
- Ключевые термины
- Ключевые уравнения
- Сводка
- Упражнения
- Введение
- 18.1 Типичное происхождение
- Типичное происхождение
- 18.3 Структура и общие свойства металлоидов
- 18.4 Структура и общие свойства неметаллов
- 18.5 Возникновение, получение и соединения водорода
- 18.6 Возникновение, получение и свойства карбонатов
- 18.7 Возникновение, получение и свойства азота
- 18.8 Возникновение, получение и свойства фосфора
- 18.9 Возникновение, получение и соединения кислорода
- 18.10 Возникновение, приготовление и Свойства серы
- 18.11 Возникновение, получение и свойства галогенов
- 18.12 Возникновение, получение и свойства благородных газов
- Ключевые термины
- Резюме
- Упражнения
- 19.1 Возникновение, получение и свойства переходных металлов и их соединений
- 19.2 Координационная химия переходных металлов
- 19.3 Спектроскопические и магнитные свойства координационных соединений
- Ключевые термины
- Резюме
- Упражнения
PPT — Описание гальванического элемента. PowerPoint Presentation, скачать бесплатно
Описание гальванического элемента. • Полное описание гальванического элемента на основе следующих полуреакций при стандартных условиях: • Ag + + e-Ag Eocell = 0,80 В (1) • Fe3 + + e-Fe2 + Eocell = 0,77 В (2) • Дополнительно , нарисуйте ячейку и напишите обозначение линии.
Потенциал элемента, электрические работы • Работа, которая может быть выполнена при переносе электронов (ЭДС), определяется в терминах разности потенциалов (в вольтах) между двумя цепями.• ЭДС = разность потенциалов (В) = работа (Дж) • заряд (Кл) • или 1 В = 1 Дж / Кл • Работа рассматривается с точки зрения системы. • Следовательно, E = -w / q или -w = q E
Максимальная работа • Максимальная работа определяется как • wmax = -q Emax • * Достижение максимальной работы невозможно. • В любом реальном, спонтанном процессе всегда тратится немного энергии. Фактическая выполненная работа всегда меньше расчетного максимума.
Свободная энергия • Фарадея (F) определяется как заряд 1 моля электронов. • F = 96 485 Кл / моль-экв. • Назначение гальванического элемента — преобразовать изменение свободной энергии спонтанной реакции в KE электронов, движущихся по внешней цепи. • wmax = DG
Для гальванического элемента • DG = -nFEmaxor DGo = -nFEomax • Где n — количество молей электронов, перенесенных в окислительно-восстановительной реакции. • Обратите внимание, что единицей измерения F является Кл / моль, а единицей измерения E, вольт, является Дж / Кл • -nFE = (моль) (Кл / моль) (Дж / Кл) = Дж. • Это уравнение выражается в Джоулях, а не Килоджоули !!
Спонтанность • Если Ecell> 0, то DG <0 и процесс спонтанный.• Если Ecell <0, то DG> 0 и процесс не спонтанный. • Если Ecell = 0, то DG = 0 и процесс находится в равновесии.
Расчет DGo для клеточной реакции. • Используя стандартную диаграмму восстановительного потенциала, рассчитайте DGo для реакции • Cu2 + (водн.) + Fe (s) Cu (s) + Fe2 + (водн.) • Является ли реакция спонтанной? • Предскажите, будет ли 1 M HNO3 растворять металлическое золото с образованием 1 M раствора Au3 +. • Ниже представлена половина реакции азотной кислоты, действующей как окислитель • 4 H + + NO3- + 3 e- NO + 2 h3O Eo =.96 V
Связь с константой равновесия • DGo = -RT ln K и DGo = -nFEocell • поэтому -RT lnK = -nFEocell • Eocell = RT ln K / n F • Расчет K и DGo из Eocell • Когда металлический кадмий восстанавливает Cu2 + в растворе, помимо металлической меди образуется Cd2 +. Если DGo = -143 кДж, рассчитайте K при 25 ° C. Что будет за Эоцеллин в гальванической ячейке, в которой использовалась эта реакция?
Влияние концентрации на E • Для клеточной реакции • 2Al (s) + 3Mn2 + (aq) ⇌2Al3 + (aq) + 3Mn (s) Eocell = 0.48 В • предсказать, будет ли Ecell больше или меньше Eocell для следующих случаев. • a) [Al3 +] = 2,0 M, [Mn2 +] = 1,0 M • b) [Al3 +] = 1,0 M, [Mn2 +] = 3,0 M
Уравнение Нернста • Уравнение Нернста показывает связь между ячейками потенциал и концентрации компонентов клетки. • E = Eo– (0,0591 / n) log Q • Или в состоянии равновесия • Eo = (0,0591 / n) log K • Расчеты по этому уравнению были исключены из теста AP, однако качественное понимание того, как концентрация влияет на ячейка все еще находится на испытании.
Эффект Q • Ячейка, в которой концентрация не соответствует их стандартным состояниям, будет продолжать разряжаться до тех пор, пока не будет достигнуто равновесие. • Значения Q никогда не бывают отрицательными. Для значений меньше 1 концентрация реагента выше, чем продукта, и реакция смещается вправо, увеличивая Ecell по сравнению с Eocell. • Когда Q <1, [реагент]> [продукт], Ecell> Eocell. • Для значений Q больше 1, концентрация продукта выше, чем у реагента, и реакция смещается влево, уменьшая Ecell.• Когда Q> 1, [реагент] <[продукт], Ecell
Больше K и Q • При равновесии K = Q и Ecell = 0. • В равновесии компоненты в двух отсеках клетки имеют одинаковую свободную энергию, и DG = 0. • Клетка больше не может Выполнять работу!
Проблемы • Рассмотрим ячейку на основе реакции • Fe (s) + Cu2 + (водн.) Fe2 + (водн.) + Cu (s) • Если [Cu2 +] = 0,30 M, то необходимое [Fe2 +] для увеличения Ecellby 0.25 В выше Eocellat 25oC?
Опишите ячейку на основе следующих полуреакций: • VO2 + + 2H + + e-VO2 + + h3O • Eo = 1,00 В • Zn2 + + 2e- Zn Eo = -0,76 В • где T = 25oC • [VO2 +] = 2,0 M • [H +] = 0,50 M • [VO2 +] = 0,01 M • [Zn2 +] = 0,1 M
Концентрационные ячейки • Концентрационные ячейки сконструированы с точно такими же полуреакциями, с исключение разницы в концентрациях. • Напряжения обычно небольшие, так как электроны передаются от ячейки с более высокой концентрацией к ячейке с более низкой концентрацией.• Eocell = 0,00 В, но они никогда не относятся к стандартным условиям, потому что концентрации не стандартные (не 1 М).
Расчет потенциала концентрационной ячейки. • Концентрационная ячейка построена с использованием двух полуячеек Au / Au3 +. В полуячейке A [Au3 +] = 7,0 x 10-4 M, а в полуячейке B, [Au3 +] = 2,5 x10-2 M. Что такое Ecell и какой электрод является анодом?
Гальванические и электролитические элементы
Гальванические и электролитические элементы
В нашем отделении по мониторингу диабета внедрены электрохимия и электрохимические ячейки.Вы можете просмотреть эту страницу здесь. Электрохимические ячейки находятся в цепи , которая позволяет переносить электроны через нее. Ячейка включает:
- анод электрод, на котором происходит окисление
- a катод , электрод, на котором происходит восстановление
- электролит , чтобы обеспечить проводимость ионов внутри раствора в каждой половине ячейки
- солевой мостик или полупроницаемая мембрана , чтобы обеспечить проводимость ионов между половинками ячеек
- внешняя цепь , которая соединяет два электрода, включает провода, нагрузку и счетчики
Гальванические элементы
Электрохимический элемент, выделяющий энергию, называется гальваническим элементом .Электрохимическая реакция имеет отрицательное значение свободной энергии Гиббса и положительную разность потенциалов ячейки.Ниже представлен гальванический элемент, в котором реакция между A + и B является экзотермической, с G = -10 кДж / моль при стандартных условиях и значением E 0 , равным 0,10 В.
Водородный электрод и полуреакции
У нас есть таблицы, которые показывают полуреакции восстановления. Как их получить?Электрохимическая реакция в электрохимической ячейке требует как полуреакции восстановления, так и полуреакции окисления.Вольтметр в цепи показывает общее напряжение ячейки ( E до = E красный + E ox ). Мы можем определить потенциалы половины ячейки, измерив напряжение ячейки, которая включает эту половину ячейки вместе со стандартной полуячейкой с известным потенциалом.
Принятый стандартный электрод — водородный электрод. Он состоит из полуячейки с инертным металлическим электродом, H 2 (г) при давлении 1 атмосфера, и 1 М водного раствора кислоты.
В режиме восстановления:
- 2H + + 2e — H 2
E красный = 0,00 В
В режиме окисления:
- H 2 2H + + 2e —
E красный = 0,00 В
Здесь вы можете видеть, что потенциал половины ячейки, в которой Cu +2 сокращается до Cu, составляет 0,34 В.
| редукция | Cu +2 + 2e — Cu | E красный = x | ||
| окисление | H 2 2H + + 2e — | E вол = 0.00 В | ||
| нетто | Cu +2 + H 2 Cu + 2H + | E до = 0,34 В |
Ячейки электролитические
В электролитической ячейке протекает эндотермическая химическая реакция. Реакция не является спонтанной, поэтому требуется источник энергии. Энергия хранится в электрохимической ячейке. Эта энергия может быть высвобождена, когда элементу разрешено работать в гальваническом режиме.Вверху справа — гальванический элемент, который мы видели ранее. Молекулы A и B + производятся и выделяется энергия. Электрод на левой стороне ячейки является катодом, потому что A + уменьшается до A на этом электроде.
Вверху слева такая же ячейка в электролитическом режиме. Источник энергии заставляет реакцию идти в направлении, противоположном спонтанному направлению. Сейчас производятся A + и B. Электрод справа является катодом, потому что здесь B + уменьшено до B.
Назад Компас Столы Индекс Введение следующийЗарядные устройства, аккумуляторы, гальванические элементы. Бесплатные статьи
Все статьи бесплатного энциклопедии электроники и электротехники перечислены в Алфавитный порядок. За автоматический перевод статей на ваш родной язык, используйте, пожалуйста, Переведите! форма в левый верхний угол страницы.
Зарядные устройства, аккумуляторы, гальванические элементы
Зарядные устройства, аккумуляторы, гальванические элементы.Статьи с иллюстрациями и подробными пояснениями:
3-вольтовый индикатор разряда батареи
Немного о быстрой зарядке
Устройство для быстрой зарядки Ni-Cd и Ni-MH аккумуляторов
Простое автоматическое зарядное устройство для Ni-Cd аккумуляторов
Простое зарядное устройство (1)
Простое зарядное устройство (2)
Простое зарядное устройство на четыре аккумулятора
Простое зарядное устройство для Li-Ion аккумуляторов
Простое зарядное устройство для Ni-Cd и Ni-MH аккумуляторов
Простой тестер для литий-ионных аккумуляторов
Простое тиристорное зарядное устройство
Генератор стабильного тока для зарядки аккумуляторов и его использование при ремонте и проектировании радиоэлектронных средств
Бестрансформаторное зарядное устройство
Бестрансформаторное зарядное устройство, 20 В 140 мА
Аккумулятор AAA
О восстановлении и эксплуатации дисковых никель-кадмиевых аккумуляторов
Свинцово-кислотные аккумуляторные батареи
Регулируемый регулятор тока, 16 В 7 А
Расширенный ограничитель разряда батареи
Переделка блока питания компьютера в зарядное устройство
AMT TRAVEL ADAPTER Зарядное устройство для сотового телефона
Электронный выключатель защищает аккумулятор
Автоматическая зарядка резервного аккумулятора
Автоматическое зарядное устройство
Автоматическое зарядное устройство
Автоматическое зарядное устройство (1)
Автоматическое зарядное устройство (2)
Зарядное устройство для автомобильных аккумуляторов (1)
Зарядное устройство для автомобильных аккумуляторов (2)
Автоматическое зарядное устройство для Ni-Cd аккумуляторов (1)
Автоматическое зарядное устройство для Ni-Cd-аккумуляторов (2)
Автоматическое зарядное устройство для никель-кадмиевых аккумуляторов
Зарядное устройство автоматическое с управлением включением и зарядкой
Зарядное устройство автоматическое с питанием не только от сети 220 В
Устройство автоматической зарядки и запуска автомобильного аккумулятора
Устройство автоматической зарядки для Ni-Cd аккумуляторов
Автоматический заряд гальванических элементов и аккумуляторов асимметричным током
Устройство для зарядки и восстановления аккумуляторных батарей
Устройство для зарядки свинцово-кислотных аккумуляторов
Устройство автоматического разряда аккумуляторов
Разрядник для Ni-Cd аккумуляторов
Автомат для зарядки аккумуляторов
Автоматический переключатель полярности зарядного устройства
Автоматическая приставка для зарядного устройства
Автоматическое зарядное устройство для аккумуляторов
Автоматическое отключение АКБ
Автоматический стартер
Автономная зарядка мобильного телефона от батареек или аккумуляторов
Лавинная реанимация (восстановление) аккумуляторов
Измеритель емкости аккумулятора
Уход за аккумулятором
Устройство заряда-разряда аккумулятора
Зарядное устройство
Зарядное устройство от 1.От 2 до 15 В и от 0,1 до 10 Ач
Зарядное устройство, 1,2-15 В 0,1-10 Ач
Зарядное устройство, 2,5 А
Индикатор заряда аккумулятора
Индикатор тока батареи
Сигнализация разряда батареи (1)
Сигнализация разрядки аккумулятора (2)
Сигнализация разряда батареи (3)
Индикатор разряда аккумулятора (1)
Индикатор разряда аккумулятора (2)
Индикатор разряда аккумулятора (3)
Индикатор разряда аккумулятора (4)
Индикатор разряда аккумулятора (аккумулятор)
Ограничитель разряда аккумулятора
Аккумулятор для импортной видеокамеры
Устройство для обслуживания аккумуляторных батарей
Работа от аккумулятора
Работа от аккумулятора в аварийном режиме
Регенератор батареи
Электродрель для ремонта батарей
Тестер аккумулятора (1)
Тестер батареи (2)
Тестер аккумулятора (3)
Тестер батарей для портативных радиостанций
Автомобильное зарядное устройство
Автомобильное зарядное устройство (1)
Автомобильное зарядное устройство (2)
Автомобильное зарядное устройство для мобильного телефона
Автомобильное зарядное устройство для сотового телефона
Индикатор заряда автомобильного аккумулятора
Зарядное устройство
Зарядное устройство на базе регулятора мощности PR1500i
Автоматический выключатель зарядного устройства
Зарядное устройство на 12 В 4.Аккумуляторы 5 Ач
Зарядное устройство на 2,5 А
Зарядное устройство для аккумуляторов 3-6 В
Зарядное устройство на ток 300 мА
Зарядное устройство для мобильного телефона с цифровым таймером
Зарядное устройство для сельской мастерской
Зарядное устройство для небольшого литий-ионного аккумулятора
Зарядное устройство для всех типов аккумуляторов
Зарядное устройство для аккумуляторов до 24 ячеек
Зарядное устройство для восстановления аккумулятора
Зарядное устройство для аккумуляторов автомобилей и мотоциклов
Зарядное устройство для сотовых телефонов с индикацией состояния и автоматической регулировкой выходного тока
Зарядное устройство для пальчиковых аккумуляторов
Зарядное устройство для четырех никель-кадмиевых батарей
Зарядное устройство для гальванических элементов
Зарядное устройство для Li-lon-аккумуляторов
Зарядное устройство для литиевых батарей
Зарядное устройство для Ni-Cd и Ni-MH аккумуляторов на микросхеме TEA1101
Зарядное устройство для никель-кадмиевых аккумуляторов
Зарядное устройство для никель-кадмиевых аккумуляторов и аккумуляторов
Зарядное устройство для подзарядки аккумуляторов
Зарядное устройство для герметичных свинцовых (гелевых) аккумуляторов
Зарядное устройство для герметичных свинцово-кислотных аккумуляторов
Зарядное устройство для мелких элементов
Зарядное устройство для стартерных аккумуляторов (1)
Зарядное устройство для стартерных аккумуляторов (2)
Зарядное устройство от блока питания компьютера
Зарядное устройство на двухполупериодном выпрямителе
Зарядное устройство на адаптер мобильного телефона
Зарядное устройство на микроконтроллере PIC12F675
Зарядное устройство на триристоре (1)
Зарядное устройство на триристоре (2)
Зарядное устройство на тиристорном преобразователе
Защита зарядного устройства
Зарядное устройство с КПД 90% для никель-кадмиевых аккумуляторов
Зарядное устройство с автоматическим отключением для аккумуляторного фонаря
Зарядное устройство с защитой полярности аккумулятора
Зарядное устройство со стабилизацией тока
Зарядное устройство с дискретной настройкой зарядного тока
Зарядное устройство с ручным и автоматическим режимами
Зарядное устройство с контролем тока ШИ
Зарядное устройство с синхронным выпрямителем
Зарядное устройство с таймером (1)
Зарядное устройство с таймером (2)
Зарядное устройство с таймером для никель-кадмиевых аккумуляторов
Устройство с питанием от зарядного устройства с расширенными эксплуатационными возможностями
Зарядные устройства для никель-кадмиевых аккумуляторов и аккумуляторов
Зарядные устройства на микросхемах регулятора Vage
Зарядка и восстановление аккумулятора
Зарядные устройства для аккумуляторов 6F22
Зарядное устройство для аккумуляторной электродрели
Зарядка сухих элементов
Зарядка пальчиковых батареек 450 мА
Зарядные гальванические элементы
Зарядка гальванических элементов
Зарядка стабильным током
Зарядка с предупреждением
Зарядно-силовое устройство
Проверочные элементы пальца
Ввод в эксплуатацию свинцовых аккумуляторов
Компактный тестер батарей
Сравнительные характеристики гальванических элементов типоразмера AA
Бесконтактное зарядное устройство
Бесконтактная память для радиоприемника
Источник тока для компенсации саморазряда аккумулятора
Зарядное устройство постоянного тока с повышающим напряжением
Устройство для автоматической зарядки аккумуляторов 12 В в системе аварийного питания
Устройство автоматической подзарядки аккумуляторов в системе аварийного питания
Устройство для зарядки и формирования аккумуляторов
Устройство для зарядки аккумуляторов
Устройство для зарядки автомобильных аккумуляторов
Устройство для зарядки аккумуляторов
Устройство для быстрой зарядки аккумуляторов (1)
Устройство для быстрой зарядки аккумуляторов (2)
Диагностика аккумуляторов сотовых телефонов
Цифровой измеритель уровня заряда батареи
Зарядное устройство для цифровой камеры
Цифровое зарядное устройство
Двухканальное зарядное устройство
Двухрежимное зарядное устройство с битом
Двухрежимное зарядное устройствоЗарядное устройство для электробритвы
Электромеханическая защита в зарядных устройствах
Электронная нагрузка для проверки зарядного устройства
Зарядное устройство для электронной защиты
Тестер для гальванических покрытий
Зарядное устройство экспоненциальное для аккумуляторов
Высокоэффективное зарядное устройство для никель-кадмиевых аккумуляторов
Аккумуляторы для бытовой техники
Самодельный аккумулятор
Как продлить срок службы Ni-MH аккумуляторов сотовых телефонов
Индикатор зарядки 14.Отвертка на 4 В
Индикатор процесса зарядки в зарядном устройстве на базе компьютерного блока питания
Индикатор минимального уровня заряда аккумулятора
Индикаторы степени разряда АКБ
Интеллектуальное зарядное устройство
Интеллектуальное зарядное устройство для никель-кадмиевых аккумуляторов
Вариант замены свинцовой батареи
Ограничение зарядного тока конденсатора выпрямителя ИИП
Маленькие секреты батарейного фонарика
Увеличенный срок службы батареи
Индикатор низкого заряда батареи
Преобразователь малой мощности для питания 9-вольтовой нагрузки от 3.Литий-ионный аккумулятор 7 В
Маломощный лабораторный источник питания с функцией зарядного устройства, 220 / 1,25 … 14 В 150 … 400 мА
Зарядное устройство для горных фонарей
Сетевой гальванический элемент 373, 220 / 1,5 В
Никель-кадмиевые батареи
Стабилизатор заряда Ni-Cd аккумулятора
Зарядное устройство для никель-кадмиевых аккумуляторов
Зарядное устройство для разряда никель-кадмиевых аккумуляторов
Устройство для разряда никель-кадмиевых аккумуляторов
Зарядное устройство для никель-металлгидридных аккумуляторов с функцией измерения емкости
Зарядное устройство нестандартное для цифрового фотоаппарата
Старое зарядное устройство
Работа герметичных Ni-Cd аккумуляторов
Обзор схем восстановления АКБ
Пелометр
Портативный аккумулятор
Блок питания + зарядное устройство для устройств на 3 В
Блок питания для больного аккумулятора
Блок питания с автоматическим зарядным устройством на компараторе
Питание радиоаппаратуры от аккумуляторов
Приставка для проверки аккумуляторов
Проблемы экономии свинцово-кислотных аккумуляторов
Защита аккумулятора ИБП от перезарядки
Зарядное устройство импульсное для NiCd-аккумуляторов
Импульсное зарядное устройство с простой индикацией тока заряда
Импульсная диагностика аккумуляторов
Восстановление и зарядка аккумулятора
Восстановление заряда от аккумуляторов
Выпрямители с электронным регулятором для зарядки аккумуляторов
Снижение температуры в системном блоке ЭБУ
Доработка сетевого зарядного устройства
Регенерация гальванических элементов
Регенерация гальванических элементов и батарей
Регенерация гальванических элементов часов
Блок питания регулируемый для ремонта автомобильного электрооборудования и зарядки аккумуляторов, 3-5 В 10 А
Ремонт и доработка зарядных устройств НС-307 и НС-314
Ремонт и доработка зарядных устройств Sonar UZ 205
Ремонт зарядного устройства для сотовых телефонов
Ремонт импульсных источников питания.Конденсатор вместо лампы
Ремонт аккумулятора ноутбука
Ремонт зарядного устройства для плеера MPEG4
Замена аккумулятора в компактном светодиодном фонарике
Правила зарядки щелочных никель-кадмиевых и никель-металлогидратных аккумуляторов
Безопасное зарядное устройство (1)
Безопасное зарядное устройство (2)
Безопасная зарядка литий-ионных аккумуляторов
Герметичные свинцово-кислотные батареи в любительском радио
Зарядное устройство простое автоматическое
Простое зарядное устройство (1)
Простое зарядное устройство (2)
Простое зарядное устройство для TC-200
Зарядное устройство для простого запуска
Источник для ремонта автомобильного электрооборудования и зарядки аккумуляторов
Стабилизатор-зарядное устройство с регулируемым ваге и током
Ступенчатое зарядное устройство-разрядник
Коммутационное устройство с автоматическим зарядным устройством
Зарядное устройство с температурной компенсацией
Зарядное устройство простейшее
Тепловое восстановление гальванических элементов
Тиристорный зарядный блок
Туристическое зарядное устройство
Универсальный аккумулятор 1 шт.5-12 В
Универсальное зарядное устройство
Универсальное зарядное устройство для компактных аккумуляторов
Универсальное зарядное устройство для никель-кадмиевых аккумуляторов
Универсальное зарядное устройство LiIon, NiCd, NiMH аккумуляторов на микросхеме MAX1501
Универсальное устройство зарядки и разрядки малогабаритных аккумуляторных батарей
Универсальное зарядное устройство для микроконтроллера
Универсальный выпрямитель для зарядки аккумуляторов
Универсальный выпрямитель с электронным регулированием для зарядки аккумуляторов
Универсальный таймер для зарядного устройства
Зарядное устройство с повышающим преобразователем
Индикатор заряда батареи ИБП
Зарядное устройство USB для LiIon аккумуляторов
Использование оптопары в цепи обратной связи регулятора Vage или зарядного устройства
Использование встроенного таймера для автоматического управления Vage при зарядке батарей
VIPER-100A и карманное зарядное устройство на его основе
Преобразователь напряжения + зарядное устройство
Заряжаем аккумулятор ноутбука от зарядного устройства мобильного телефона
Все статьи раздела Электроснабжение:
Электроснабжение.Зарядные устройства, аккумуляторы, гальванические элементы
Электроснабжение. Регуляторы тока, Vage и регуляторы мощности
Электроснабжение. Защита оборудования от аварийных режимов, блоки бесперебойного питания
Электроснабжение. Разное
Электроснабжение. Блоки питания
Электроснабжение. Стабилизаторы Vage
Электроснабжение. Преобразователи, выпрямители, инверторы vage
Клетки, ткани, функции и болезни
Наша иммунная система необходима для нашего выживания.Без иммунной системы наши тела были бы открыты для атак бактерий, вирусов, паразитов и многого другого. Именно наша иммунная система поддерживает наше здоровье, пока мы дрейфуем сквозь море патогенов.
Эта обширная сеть клеток и тканей постоянно ищет захватчиков, и как только враг обнаружен, начинается сложная атака.
Иммунная система распространяется по всему телу и включает в себя множество типов клеток, органов, белков и тканей. Что особенно важно, он может отличить нашу ткань от чужеродной — собственную от чужой.Мертвые и поврежденные клетки также распознаются и удаляются иммунной системой.
Если иммунная система встречает патоген, например, бактерию, вирус или паразит, у нее возникает так называемый иммунный ответ. Позже мы объясним, как это работает, но сначала мы познакомим вас с некоторыми из основных персонажей иммунной системы.
Поделиться на PinterestЛейкоцит (желтый), атакующий бактерии сибирской язвы (оранжевый). Белая линия внизу составляет 5 микрометров.Изображение предоставлено: Фолькер Бринкманн
Лейкоциты также называют лейкоцитами.Они циркулируют в организме в кровеносных и лимфатических сосудах, которые проходят параллельно венам и артериям.
Лейкоциты постоянно патрулируют и ищут патогены. Когда они находят цель, они начинают размножаться и посылать сигналы другим типам клеток, чтобы сделать то же самое.
Наши лейкоциты хранятся в разных частях тела, которые называются лимфоидными органами. К ним относятся следующие:
- Тимус — железа между легкими и чуть ниже шеи.
- Селезенка — орган, фильтрующий кровь. Он находится в верхнем левом углу живота.
- Костный мозг — находится в центре костей, он также производит красные кровяные тельца.
- Лимфатические узлы — небольшие железы, расположенные по всему телу и связанные лимфатическими сосудами.
Существует два основных типа лейкоцитов:
1. Фагоциты
Эти клетки окружают и поглощают патогены и разрушают их, эффективно поедая их.Существует несколько типов, в том числе:
- Нейтрофилы — это наиболее распространенный тип фагоцитов, который имеет тенденцию атаковать бактерии.
- Моноциты — это самый крупный тип, выполняющий несколько функций.
- Макрофаги — патрулируют патогены, а также удаляют мертвые и умирающие клетки.
- Тучные клетки — они выполняют множество функций, в том числе помогают заживлять раны и защищаться от патогенов.
2. Лимфоциты
Лимфоциты помогают организму запоминать предыдущих захватчиков и распознавать их, если они снова атакуют.
Лимфоциты начинают свою жизнь в костном мозге. Некоторые остаются в костном мозге и развиваются в В-лимфоциты (В-клетки), другие направляются в тимус и становятся Т-лимфоцитами (Т-лимфоцитами). Эти два типа клеток имеют разные роли:
- B-лимфоциты — они вырабатывают антитела и помогают предупреждать Т-лимфоциты.
- Т-лимфоциты — они разрушают поврежденные клетки в организме и помогают предупредить другие лейкоциты.
Иммунная система должна уметь отличать себя от чужого.Он делает это, обнаруживая белки, которые находятся на поверхности всех клеток. Он учится игнорировать свои собственные или собственные белки на ранней стадии.
Антиген — это любое вещество, которое может вызвать иммунный ответ.
Во многих случаях антигеном является бактерия, грибок, вирус, токсин или инородное тело. Но это также может быть одна из наших собственных ячеек, неисправная или мертвая. Первоначально ряд типов клеток работают вместе, чтобы распознавать антиген как захватчика.
Роль В-лимфоцитов
Как только В-лимфоциты обнаруживают антиген, они начинают секретировать антитела («антиген» — это сокращение от «генераторы антител»).Антитела — это особые белки, которые связываются со специфическими антигенами.
Каждая В-клетка вырабатывает одно специфическое антитело. Например, один может создать антитело против бактерий, вызывающих пневмонию, а другой может распознать вирус простуды.
Антитела являются частью большого семейства химических веществ, называемых иммуноглобулинами, которые играют множество ролей в иммунном ответе:
- Иммуноглобулин G (IgG) — маркирует микробы, чтобы другие клетки могли распознавать их и бороться с ними.
- IgM — специалист по уничтожению бактерий.
- IgA — накапливается в жидкостях, таких как слезы и слюна, где он защищает ворота в организм.
- IgE — защищает от паразитов, а также вызывает аллергию.
- IgD — остается связанным с В-лимфоцитами, помогая им запустить иммунный ответ.
Антитела фиксируют антиген, но не убивают его, а лишь отмечают смерть. Убийство — это работа других клеток, таких как фагоциты.
Роль Т-лимфоцитов
Существуют различные типы Т-лимфоцитов:
Т-хелперы (Th-клетки) — они координируют иммунный ответ. Некоторые связываются с другими клетками, а некоторые стимулируют В-клетки производить больше антител. Другие привлекают больше Т-клеток или фагоцитов, поедающих клетки.
Т-киллеры (цитотоксические Т-лимфоциты) — как следует из названия, эти Т-клетки атакуют другие клетки. Они особенно полезны для борьбы с вирусами.Они работают, распознавая небольшие части вируса снаружи инфицированных клеток и уничтожая инфицированные клетки.
Иммунная система у всех разная, но, как правило, она становится сильнее в зрелом возрасте, поскольку к этому времени мы подвергаемся воздействию большего количества патогенов и выработаем больший иммунитет.
Именно поэтому подростки и взрослые болеют реже, чем дети.
После того, как антитело было произведено, его копия остается в организме, так что, если тот же антиген появится снова, с ним можно будет справиться быстрее.
Вот почему при некоторых заболеваниях, таких как ветряная оспа, вы получаете их только один раз, поскольку в организме есть антитела к ветряной оспе, готовые и ждущие, чтобы уничтожить их в следующий раз, когда они появятся. Это называется иммунитетом.
У людей есть три типа иммунитета, которые называются врожденным, адаптивным и пассивным:
Врожденный иммунитет
Все мы рождаемся с некоторым уровнем иммунитета к захватчикам. Иммунная система человека, как и иммунная система многих животных, будет атаковать иностранных захватчиков с первого дня.Этот врожденный иммунитет включает внешние барьеры нашего тела — первую линию защиты от патогенов, например кожу и слизистые оболочки горла и кишечника.
Это более общий и неспецифический ответ. Если патогену удается увернуться от врожденной иммунной системы, срабатывает адаптивный или приобретенный иммунитет.
Адаптивный (приобретенный) иммунитет
Эта защита от патогенов развивается по мере того, как мы идем по жизни. Когда мы подвергаемся болезням или вакцинируемся, мы создаем библиотеку антител к различным патогенам.Иногда это называют иммунологической памятью, потому что наша иммунная система помнит предыдущих врагов.
Пассивный иммунитет
Этот тип невосприимчивости «заимствован» из другого источника, но не действует бесконечно. Например, ребенок получает антитела от матери через плаценту до рождения и с грудным молоком после рождения. Этот пассивный иммунитет защищает ребенка от некоторых инфекций в первые годы его жизни.
Иммунизация
Иммунизация вводит человеку антигены или ослабленные патогены таким образом, что человек не заболевает, но все еще производит антитела.Поскольку в организме сохраняются копии антител, оно защищено, если угроза снова появится в более позднем возрасте.
Поскольку иммунная система очень сложна, существует множество потенциальных причин, по которым она может пойти не так. Типы иммунных расстройств делятся на три категории:
Иммунодефициты
Они возникают, когда одна или несколько частей иммунной системы не функционируют. Иммунодефицит может быть вызван разными причинами, включая возраст, ожирение и алкоголизм. В развивающихся странах недоедание — частая причина.СПИД — это пример приобретенного иммунодефицита.
В некоторых случаях иммунодефицит может передаваться по наследству, например, при хронической гранулематозной болезни, когда фагоциты не функционируют должным образом.
Аутоиммунитет
При аутоиммунных состояниях иммунная система ошибочно нацелена на здоровые клетки, а не на чужеродные патогены или дефектные клетки. В этом сценарии они не могут отличить себя от чужого.
Аутоиммунные заболевания включают целиакию, диабет 1 типа, ревматоидный артрит и болезнь Грейвса.
Гиперчувствительность
При гиперчувствительности иммунная система слишком остро реагирует, повреждая здоровые ткани.
