Порошок медный электролитический «Легкий» МАРОК ПМЛ-0, ПМЛ-2 и ПМЛ-3
По вопросам приобретения продукции:
Начальник отдела продаж основной продукции Серебрякова Наталия Васильевна
+7(34368) 4-73-73
e-mail: [email protected]
Неустроев Максим Владимирович
+7(34368)4-62-16
e-mail: [email protected]
Назначение и описание
Порошок медный электролитический «легкий» выпускают по ТУ 1793–087–00194429–2013.
Предназначен для применения в электротехнической, машиностроительной и других отраслях промышленности и для поставки на экспорт.
Технические характеристики
| Параметр | Массовая доля, % | |||
| ПМЛ–0 | ПМЛ–2 | ПМЛ–3 | ||
| Cu | Медь, не менее | 99,5 | 99,6 | |
| Примеси, не более: | ||||
| O2 | Кислород | 0,4 | 0,3 | 0,25 |
| Насыпная плотность, г/см3 | 0,75 ± 0,1 | 1,0 ± 0,1 | 1,35 ± 0,1 | |
| Размер частиц, мкм | Гранулометрический состав, % | |||
| ≥ 63 | 5 max | 5 max | 10 max | |
| < 63 | 95 min | 95 min | 90 min | |
Упаковка и транспортировка
Упаковку и транспортировку осуществляют в соответствии с ГОСТ 4960.
Гарантийный срок хранения
4 месяца с момента изготовления.
Качество
Система менеджмента качества АО «Уралэлектромедь» сертифицирована компанией LRQA на соответствие требованиям ISO 9001:2015. Системы экологического менеджмента, управления охраной труда и промышленной безопасностью, энергетического менеджмента сертифицированы Ассоциацией по сертификации Русский Регистр на соответствие требованиям международных стандартов ISO 14001:2015, ISO 45001:2018, ISO 50001:2011.
Продукция зарегистрирована в соответствии с европейским регламентом о безопасности химической продукции REACH.
Сертификаты качества
1 ISO 9001:2015 (ссылка для скачивания)
2 ISO 14001:2015 (ссылка для скачивания)
3 ISO 45001:2018 (ссылка для скачивания)
4 ISO 50001:2011 (ссылка для скачивания)
Пускатель электромагнитный серии ПМЛ-2161ДМ 25А 230В EKF Basic pml-s-25-230-nc-basic
Характеристики
Описание товара
Наличие в магазинах
Отзывы (0)
Вопрос-ответ
Производитель:
EKF
Артикул:
pml-s-25-230-nc-basic
Вес:
0,56
Объем:
0,001
г.
 Краснодар, ул Онежская, 60
Краснодар, ул Онежская, 60Под заказ0
г. Краснодар, ул. Кр. Партизан, 194
Под заказ0
г. Краснодар, ул. Солнечная, 25
Под заказ0
Под заказ0
г. Краснодар, ул. Дзержинского, 98/3
Под заказ0
г. Краснодар, ул. Уральская, 87
Под заказ0
г. Краснодар, ул. Российская, 252
Под заказ0
г. Краснодар Центральный склад
В наличии4
г. Краснодар, ул. Западный обход, 34
В наличии1
Раздел не найден.
| ПМЛ 10-500 НК | Провод заземления | иное | 10 | 10 | 500 | Стренговая структура плетения: 24х9х0. 24 24 |
| ПМЛ 16-500 НК | Провод заземления | иное | 10 | 16 | 500 | Стренговая структура плетения: 24х14х0.24 |
| ПМЛ 16-600 НК | Провод заземления | иное | 10 | 16 | 600 | Стренговая структура плетения: 24х14х0.24 |
| ПМЛ 16-800 НК | Провод заземления | иное | 10 | 16 | 800 | Стренговая структура плетения: 24х14х0.24 |
| ПМЛ 25-500 НК | Провод заземления | иное | 10 | 25 | 500 | Стренговая структура плетения: 24х23х0.24 |
| ПМЛ 25-600 НК | Провод заземления | иное | 10 | 25 | 600 | Стренговая структура плетения: 24х23х0.24 |
| ПМЛ 25-800 НК | Провод заземления | иное | 10 | 25 | 800 | Стренговая структура плетения: 24х23х0. 24 24 |
| ПМЛ 10-1000 | Провод заземления | иное | 10 | 10 | 1000 | Стренговая структура плетения: 24х9х0.24 |
| ПМЛ 16-1000 | Провод заземления | иное | 10 | 16 | 1000 | Стренговая структура плетения: 24х14х0.24 |
| ПМЛ 25-1000 | Провод заземления | иное | 10 | 25 | 1000 | Стренговая структура плетения: 24х23х0.24 |
| ПМЛ 25-250 | Провод заземления | иное | 10 | 25 | 250 | Стренговая структура плетения: 24х23х0.24 |
| ПМЛ-25-300 | Провод заземления | иное | 10 | 25 | 300 | Стренговая структура плетения: 24х23х0.24 |
| ПМЛ-25-400 | Провод заземления | иное | 10 | 25 | 400 | Стренговая структура плетения: 24х23х0. 24 24 |
Pamira PML 611 Нержавеющая сталь декор
- Диаметр выпуска
- 3 1/2»
- Отверстие под смеситель
- Нет
- Расположение чаши
- Оборачиваемая
- Ширина шкафа
- 450.00 mm
- Шаблон выреза
- Да
- Длина
- 770.
 00 mm
00 mm - Ширина
- 500.00 mm
- Длина чаши
- 410.00 mm
- Глубина чаши
- 165.00 mm
Контакторы и пускатели ПМЛ, ПМ12; реле РТЛ; аксессуары.
ГлавнаяПродукция КЭАЗКонтакторы и пускатели ПМЛ, ПМ12; реле РТЛ; аксессуары.Пускатель ПМЛ
Пускатель магнитный ПМЛ (электромагнитный пускатель) — аппарат, предназначенный для управления электродвигателями. Это необходимый элемент силовой электроцепи для включения/отключения, а также реверсирования различных механизмов. Пускатель магнитный подходит для управления:
Это необходимый элемент силовой электроцепи для включения/отключения, а также реверсирования различных механизмов. Пускатель магнитный подходит для управления:
- Вентиляторами
- Грузоподъемными механизмами (краны, лифты и др.)
- Освещением
- Тепловыми завесами
- Печами
- Станками и т.п.
Контакторы серии ПМЛ, электромагнитные контакторы, довольно просты в использовании, имеют универсальный способ монтажа, а также дают возможность заменить управляющую катушку самостоятельно пользователем. Востребованными эти аппараты являются еще и потому, что имеют дополнительные контакты. Например, тепловые реле РТЛ, что дает возможность защищать электродвигатели от перегрузки.
Пускатели ПМЛ Курского электроаппаратного завода (КЭАЗ) — это надежность и долговечность.
Пускатель ПМ12
Основные характеристики пускателей электромагнитных ПМ12:
- Применение в цепях с напряжением до 660В
- Частотой до 60 Гц
- Запускают, останавливают, защищают от чрезмерной нагрузки электродвигатели
Принцип работы контаторов ПМ12 схож с принципом серии ПМЛ.
«Брэйн» — официальный дилер КЭАЗ
Мы являемся официальным дилером Курского завода и предлагаем купить пускатель магнитный ПМЛ, ПМ12 высокого качества и по приятной цене.
На сегодняшний день КЭАЗ является одним из немногих российских заводов, производящих пускатель высокого качества. В связи с событиями на Украине, которая была основным поставщиком данных аппаратов, наблюдаются перебои с поставками. Чтобы избежать простоев, закажите продукцию КЭАЗ, которая порадует Вас своим качеством, продолжительностью службы и стоимостью.
Пишите/звоните нам по любым вопросам приобретения электромагнитных пускателей серий ПМЛ и ПМ12, а также другой продукции завода.
Комплексное снабжение всех видов инструментов, сварочным, грузоподъемным оборудованием и материалами
Название:
Артикул:
Текст:
Выберите категорию:
Все
Сварочное оборудование
» Горелки сварочные
» Горелки газовоздушные
» Резаки инжекторные
» Редукторы газовые
»» Редукторы кислородные
»» Редукторы пропановые
»» Редукторы углекислотные, азотные, аргоновые,гелиевые
Пневмоинструмент
» Гайковерты
» Молотки отбойные и бетоноломы
» Сверлильные машины
» Шлифовальные машины
Абразивный инструмент
» Круги шлифовальные на керамической связке
» Круги шлифовальные и обдирочные на бакелитовой связке
» Круги отрезные
» Круги зачистные
» Шлифовальная шкурка (шлифшкурка)
» Изделия из шлифшкурки: круги лепестковые, ленты и бобины шлифовальные
» Головки шлифовальные на керамической связке
» Сегменты
Алмазный инструмент
» 1A1 Круги алмазные шлифовальные прямого профиля 1A1
» 9А3 Круги алмазные шлифовальные плоские с двухсторонней выточкой
» 12А245 Круги алмазные шлифовальные чашечные
» Карандаши алмазные правящие
» Алмазные пасты
» Сегментные алмазные круги тип 1A1RSS
» Алмазные круги тип 1A1R «КОРОНА»
» Алмазные круги тип «TURBO»
» Корончатые сверла (кольцевые фрезы)
» Алмазные фрезы Полировальный инструмент
» Алмазные сверла и коронки
Металлорежущий инструмент
» Гребенки резьбонакатные
» Долбяки
» Зенковки
» Метчики
» Ножи
» Пилы Геллера и сегменты
» Плашки
»» ПЛАШКА КРУГЛАЯ ДЛЯ МЕТРИЧЕСКОЙ РЕЗЬБЫ, КЛАСС ТОЧНОСТИ 6g,6h сталь 9ХС, Р6М5 ГОСТ 9740-71
»»» 123. ПЛАШКА КРУГЛАЯ ДЛЯ ЛЕВОЙ МЕТРИЧЕСКОЙ РЕЗЬБЫ, КЛАСС ТОЧНОСТИ 6g, СТАЛЬ 9ХС, ГОСТ 9740-71
»» ПЛАШКА КРУГЛАЯ ДЛЯ КОНИЧЕСКОЙ ДЮЙМОВОЙ РЕЗЬБЫ,СТАЛЬ 9ХС, ГОСТ 6228-80
»» ПЛАШКА КРУГЛАЯ ДЛЯ ТРУБНОЙ КОНИЧЕСКОЙ РЕЗЬБЫ, СТАЛЬ 9ХС, ГОСТ 6228-80
»» ПЛАШКА КРУГЛАЯ ДЛЯ ТРУБНОЙ ЦИЛИНДРИЧЕСКОЙ РЕЗЬБЫ,СТАЛЬ 9ХС, ГОСТ 9740-71
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ УИТВОРТА (BSF), УГОЛ 55°,СТАЛЬ 9ХС, DIN EN 22 568
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ (UNС), УГОЛ 60°,СТАЛЬ 9ХС, DIN EN 22 568
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ (UNF), УГОЛ 60°,СТАЛЬ 9ХС, DIN EN 22 568
» Полотна ножовочные и машинные
» Развертки
» Резцы
» Сверла по металлу
» Фрезы
» Пластины твердосплавные сменные
Измерительный инструмент
» Индикаторы часового типа
» Калибры
» Линейки
» Микрометры
» Нутромеры
» Плиты поверочные
» Резьбомеры
» Рулетки
» Угольники
» Уровни
» Штангенглубиномеры
» Штангенциркули
» Штативы
» Щупы
Слесарно-монтажный инструмент
Станочная остнастка и приспособления
Электроинструмент
Рукава для газовой сварки
Хозяйственный инвентарь
Грузоподъемное оборудование
» Захваты
»» Захваты листовые
»» Захваты для сендвич-панелей ТГ-СП, ТГ-СПС, ТГ-СПК
»» Захваты для блоков, бордюрного камня
»» Захват для труб торцевой
»» Захваты для бочек: DL-350, LM-800, DM-500, ETM-SL148
»» Захваты магнитные PML-A
»» Захват для натяжения каната и кабеля
» Блоки монтажные
»» Блоки монтажные однорольные HQG(L)
»» Блоки монтажные многорольные HQG
»» Блоки монтажные опорные
» Тали ручные цепные ТРШ тип С
»» Тали ручные цепные ТРШ/622-А
» Тележки к ручным талям
»» Тележки к ручным талям приводные GCL
»» Тележки к ручным талям не приводные (холостые) GCT
» Тали ручные рычажные ТРР
» Таль электрическая
»» Таль электрическая канатная РА стационарная
»» Таль электрическая канатная РА передвижная
»» Таль электрическая канатная CD 1
» Лебедки ручные барабанные
»» Лебедка ручная барабанная FD
»» Лебедка ручная барабанная LHW
»» Лебедка ручная барабанная BHW
»» Лебедка ручная барабанная Дина
»» Лебедка ручная барабанная JHW
»» Лебедка ручная барабанная ТЛ
»» Лебедка ручная червячная VS
» Лебедки ручные рычажные
»» Механизм тяговый монтажный МТМ
»» Лебедка ручная рычажная ЛР
»» Лебедка ручная рычажная GL
ПЛАШКА КРУГЛАЯ ДЛЯ ЛЕВОЙ МЕТРИЧЕСКОЙ РЕЗЬБЫ, КЛАСС ТОЧНОСТИ 6g, СТАЛЬ 9ХС, ГОСТ 9740-71
»» ПЛАШКА КРУГЛАЯ ДЛЯ КОНИЧЕСКОЙ ДЮЙМОВОЙ РЕЗЬБЫ,СТАЛЬ 9ХС, ГОСТ 6228-80
»» ПЛАШКА КРУГЛАЯ ДЛЯ ТРУБНОЙ КОНИЧЕСКОЙ РЕЗЬБЫ, СТАЛЬ 9ХС, ГОСТ 6228-80
»» ПЛАШКА КРУГЛАЯ ДЛЯ ТРУБНОЙ ЦИЛИНДРИЧЕСКОЙ РЕЗЬБЫ,СТАЛЬ 9ХС, ГОСТ 9740-71
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ УИТВОРТА (BSF), УГОЛ 55°,СТАЛЬ 9ХС, DIN EN 22 568
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ (UNС), УГОЛ 60°,СТАЛЬ 9ХС, DIN EN 22 568
»» ПЛАШКА КРУГЛАЯ ДЛЯ ДЮЙМОВОЙ РЕЗЬБЫ (UNF), УГОЛ 60°,СТАЛЬ 9ХС, DIN EN 22 568
» Полотна ножовочные и машинные
» Развертки
» Резцы
» Сверла по металлу
» Фрезы
» Пластины твердосплавные сменные
Измерительный инструмент
» Индикаторы часового типа
» Калибры
» Линейки
» Микрометры
» Нутромеры
» Плиты поверочные
» Резьбомеры
» Рулетки
» Угольники
» Уровни
» Штангенглубиномеры
» Штангенциркули
» Штативы
» Щупы
Слесарно-монтажный инструмент
Станочная остнастка и приспособления
Электроинструмент
Рукава для газовой сварки
Хозяйственный инвентарь
Грузоподъемное оборудование
» Захваты
»» Захваты листовые
»» Захваты для сендвич-панелей ТГ-СП, ТГ-СПС, ТГ-СПК
»» Захваты для блоков, бордюрного камня
»» Захват для труб торцевой
»» Захваты для бочек: DL-350, LM-800, DM-500, ETM-SL148
»» Захваты магнитные PML-A
»» Захват для натяжения каната и кабеля
» Блоки монтажные
»» Блоки монтажные однорольные HQG(L)
»» Блоки монтажные многорольные HQG
»» Блоки монтажные опорные
» Тали ручные цепные ТРШ тип С
»» Тали ручные цепные ТРШ/622-А
» Тележки к ручным талям
»» Тележки к ручным талям приводные GCL
»» Тележки к ручным талям не приводные (холостые) GCT
» Тали ручные рычажные ТРР
» Таль электрическая
»» Таль электрическая канатная РА стационарная
»» Таль электрическая канатная РА передвижная
»» Таль электрическая канатная CD 1
» Лебедки ручные барабанные
»» Лебедка ручная барабанная FD
»» Лебедка ручная барабанная LHW
»» Лебедка ручная барабанная BHW
»» Лебедка ручная барабанная Дина
»» Лебедка ручная барабанная JHW
»» Лебедка ручная барабанная ТЛ
»» Лебедка ручная червячная VS
» Лебедки ручные рычажные
»» Механизм тяговый монтажный МТМ
»» Лебедка ручная рычажная ЛР
»» Лебедка ручная рычажная GL
Производитель:
ВсеБАМЗНордПТЦДжетКрассСварогКАЛИБРSKYWAYЭНКОРJETRYOBICHAMPIONSTALEXEUROLIFTERKENOVOTORПРАКТИКFITEUROLUXFUBAGWESTERУДАРНИКBESTWELDCOLTКРАТОН
Новинка:
Вседанет
Спецпредложение:
Вседанет
Результатов на странице: 5203550658095
Найти
О нас | PMI Россия
В соответствии с соглашением между Советом Министров СССР и «Филип Моррис, Инк. », в 1975 году, в ознаменование первой совместной советско-американской космической программы, в СССР была выпущена марка сигарет Союз-Аполлон.
», в 1975 году, в ознаменование первой совместной советско-американской космической программы, в СССР была выпущена марка сигарет Союз-Аполлон.
Другим немаловажным этапом сотрудничества стал период с 1977 по 1986 годы, когда ведущую марку сигарет компании – Marlboro – производили по лицензии в пяти городах бывшего Советского Союза: в Москве, Ленинграде, Кишиневе, Баку и Сухуми.
В ответ на просьбу советского правительства, «Филип Моррис» осуществила срочную поставку в СССР 20 миллиардов сигарет. В то время этот экспортный заказ являлся одним из самых крупных для табачной промышленности.
Открытие представительства компании в Москве.
Компания
«Филип Моррис Инвестмент Корпорэйшн» приобрела контрольный пакет акций
Краснодарской табачной фабрики (ОАО «Краснодартабакпром»), которая стала нашей
первой производственной площадкой в России. К настоящему моменту мы инвестировали
около 200 миллионов долларов США в модернизацию этого предприятия. Теперь это
современное, оснащённое по последнему слову техники производство в Краснодаре
называется «Филип Моррис Кубань».
Теперь это
современное, оснащённое по последнему слову техники производство в Краснодаре
называется «Филип Моррис Кубань».
Мы начали расширение компании в российские регионы. Были открыты первые 14 представительств в крупнейших городах страны, в т.ч. во Владивостоке, Екатеринбурге, Казани, Нижнем Новгороде, Новосибирске, Омске, Санкт-Петербурге и Челябинске. Открытие этих филиалов расширило географию присутствия компании и обеспечило необходимое продвижение наших торговых марок.
Наше длительное присутствие и инвестиции в России начали приносить плоды, марки сигарет «Филип Моррис Интернэшнл» заняли лидирующее положение на рынке. Несмотря на негативные последствия финансового кризиса, потрясшего страну в августе 1998 года, мы подтвердили свои намерения продолжать работу в стране и даже расширили свою инвестиционную программу. В результате, уже в феврале 2000 года мы открыли фабрику «Филип Моррис Ижора» в Ленинградской области — высокотехнологичный производственный комплекс, крупнейший среди предприятий «Филип Моррис Интернэшнл» в мире.
Компания «Филип Моррис Интернэшнл Инк.» объявила о приобретении 20% акций Megapolis Distribution BV, владеющей ЗАО ТК «Мегаполис», которая является дистрибутором ФМИ в России. Сделка заложила основу для дальнейшего развития инфраструктуры и улучшения операционных процессов в такой стратегической для нас области, как дистрибуция и, в конечном итоге, создала преимущество для нашего широкого портфеля ведущих брендов.
МЫ в социальных сетях
Ru-1 связывается с доменом безымянного пальца PML и возмущает белок …
Context 1
… связывание мышьяка играет центральную роль в SUMOylation PML 8. Поскольку Ru-1 эффективно индуцирует деградацию PML-RARα, мы поэтому проверили, может ли рутениевый комплекс также связываться с кольцевым доменом PML. Титрование флуоресценции показало, что Ru-1 подавлял флуоресценцию PML (Zn-связанный белок) в зависимости от концентрации (фиг. 4A). Это наблюдение согласуется с недавним сообщением о том, что связывание Ru ведет к тушению флуоресценции белков цинковых пальцев 18. Сообщалось, что связывание многих металлопрепаратов, таких как мышьяк, платина и рутений, с белками цинковых пальцев вызывает высвобождение ионов цинка из белка 18-20 …
Сообщалось, что связывание многих металлопрепаратов, таких как мышьяк, платина и рутений, с белками цинковых пальцев вызывает высвобождение ионов цинка из белка 18-20 …
Context 2
. .. Реакцию проводили на 0,2 мМ 15 N-меченого PML с 5 экв. Ru-1 в 20 мМ фосфатном буфере (pH = 7,0) при 37 ° C в течение 2 часов. спектрометрический анализ (ESI-MS) показал, что реакция Ru-1 привела к увеличению массы PML на 183,2 Да, что является прямым доказательством связывания фрагмента (η 6 -bip) Ru (en) с белком при высвобождении ионов цинка (рис.4С). Поскольку координация цинка имеет решающее значение для сворачивания белка PML, нарушение структуры PML связыванием Ru-1 было проанализировано с использованием спектров кругового дихроизма (CD). Результат показал, что реакция Ru-1 привела к уменьшению отрицательной полосы при 228 нм, и полученные спектры стали более похожими на апо-PML с увеличенным …
Контекст 3
… координация критически важное для сворачивания белка PML, структурное возмущение PML связыванием Ru-1 было проанализировано с использованием спектров кругового дихроизма (CD). Результат показал, что реакция Ru-1 привела к уменьшению отрицательной полосы при 228 нм, и полученные спектры стали более похожими на апо-PML с повышенной концентрацией Ru-1 (фиг. 4D). Кроме того, спектры 2D 1 H-15 N HSQC ЯМР показали, что большое количество сигналов PML исчезло после реакции Ru-1, в то время как некоторые новые пики появились примерно при 8 ppm по измерению 1 H, подтверждая, что белок разворачивается на Ru- 1 реакция (рис. 4E). Этот результат подобен разворачиванию PML 8, вызванному связыванием мышьяка…
Результат показал, что реакция Ru-1 привела к уменьшению отрицательной полосы при 228 нм, и полученные спектры стали более похожими на апо-PML с повышенной концентрацией Ru-1 (фиг. 4D). Кроме того, спектры 2D 1 H-15 N HSQC ЯМР показали, что большое количество сигналов PML исчезло после реакции Ru-1, в то время как некоторые новые пики появились примерно при 8 ppm по измерению 1 H, подтверждая, что белок разворачивается на Ru- 1 реакция (рис. 4E). Этот результат подобен разворачиванию PML 8, вызванному связыванием мышьяка…
Context 4
… результат показал, что реакция Ru-1 привела к уменьшению отрицательной полосы при 228 нм, и полученные спектры стали более похожими на апо-PML с повышенной концентрацией Ru- 1 (рис. 4D). Кроме того, спектры 2D 1 H-15 N HSQC ЯМР показали, что большое количество сигналов PML исчезло после реакции Ru-1, в то время как некоторые новые пики появились примерно при 8 ppm по измерению 1 H, подтверждая, что белок разворачивается на Ru- 1 реакция (рис.
Контекст 5
… этих уровней белка происходило в зависимости от времени, и значительные изменения произошли после лечения препаратом в течение 4-8 часов. Тем временем наблюдалось расщепление белка репарации ДНК PARP-1, который является субстратом казепазы-3. Для дальнейшего анализа апоптоза клеток, индуцированного Ru-1, клетки окрашивали PI и аннексином V (фиг. 6B и S4). Результаты ясно показывают, что Ru-1 индуцировал апоптоз клеток NB4. Соотношение апоптозных клеток увеличивалось со временем, и более высокая концентрация Ru-1 вызывала усиление апоптоза.Этот результат четко подтвердил, что лечение вызванного Ru-1 повреждения ДНК вызывает апоптоз клеток NB4. Слитый белок PML-RARα отвечает за …
Контекст 6
… в клеточных анализах. Это расхождение может быть связано либо с различным клеточным захватом, либо с неспецифическими реакциями двух биядерных Ru-агентов в клетках. Чтобы проверить эту гипотезу, клеточное поглощение этих Ru-агентов было измерено с помощью ICP-MS. Результат показал, что Ru-1 усваивается более эффективно, чем Ru-2, но меньше, чем Ru-3 (рис.S4). Этот результат предполагает, что эффективное поглощение лекарственного средства необходимо, но это не единственный фактор, определяющий лекарство …
Чтобы проверить эту гипотезу, клеточное поглощение этих Ru-агентов было измерено с помощью ICP-MS. Результат показал, что Ru-1 усваивается более эффективно, чем Ru-2, но меньше, чем Ru-3 (рис.S4). Этот результат предполагает, что эффективное поглощение лекарственного средства необходимо, но это не единственный фактор, определяющий лекарство …
Pml имеет решающее значение для образования Nd10 и привлекает Pml-взаимодействующий белок Daxx в эту структуру ядра при модификации Sumo-1 | Журнал клеточной биологии
Ядерный домен 10 (ND10), также называемый ядерными тельцами, представляет собой дискретные межхромосомные скопления нескольких белков, включая белок промиелоцитарного лейкоза (PML) и Sp100.В этом исследовании мы исследовали механизм сборки ND10 путем идентификации белков, которые необходимы для этого процесса, с использованием линий клеток, в которых отсутствуют отдельные белки, связанные с ND10. Мы идентифицировали адаптерный белок Daxx и BML, геликазу RecQ, отсутствующую при синдроме Блума, как новые белки, ассоциированные с ND10. Было обнаружено, что PML, но не BLM или Sp100, отвечает за правильную локализацию всех других белков, связанных с ND10, поскольку они диспергированы в клетках PML — / -. Введение PML в эту клеточную линию путем временной экспрессии или слияния с продуцирующими PML клетками рекрутировало ND10-ассоциированные белки в образованный de novo ND10, что свидетельствует о существенной природе PML в образовании ND10.В отсутствие PML Daxx сильно обогащен конденсированным хроматином. Его рекрутирование на ND10 из конденсированного хроматина требует модификации PML с помощью небольшого ubiquitin-related modifier (SUMO-1) и отражает взаимодействие между COOH-концевым доменом Daxx и PML. Сегрегация Daxx из конденсированного хроматина в отсутствие PML на ND10 за счет повышенного накопления SUMO-1-модифицированного PML предполагает наличие переменного равновесия между этими двумя ядерными сайтами. Наши находки идентифицируют основные требования для образования ND10 и предполагают динамический механизм рекрутирования белков в эти ядерные домены, контролируемые состоянием модификации SUMO-1 PML.
Было обнаружено, что PML, но не BLM или Sp100, отвечает за правильную локализацию всех других белков, связанных с ND10, поскольку они диспергированы в клетках PML — / -. Введение PML в эту клеточную линию путем временной экспрессии или слияния с продуцирующими PML клетками рекрутировало ND10-ассоциированные белки в образованный de novo ND10, что свидетельствует о существенной природе PML в образовании ND10.В отсутствие PML Daxx сильно обогащен конденсированным хроматином. Его рекрутирование на ND10 из конденсированного хроматина требует модификации PML с помощью небольшого ubiquitin-related modifier (SUMO-1) и отражает взаимодействие между COOH-концевым доменом Daxx и PML. Сегрегация Daxx из конденсированного хроматина в отсутствие PML на ND10 за счет повышенного накопления SUMO-1-модифицированного PML предполагает наличие переменного равновесия между этими двумя ядерными сайтами. Наши находки идентифицируют основные требования для образования ND10 и предполагают динамический механизм рекрутирования белков в эти ядерные домены, контролируемые состоянием модификации SUMO-1 PML.
Специфические ядерные домены, ND10 1 (также называемые ядерными тельцами PML или промиелоцитарным онкогенным доменом), но более конкретно составляющие их белки были интенсивно исследованы после открытия, что некоторые белки, связанные с ND10, связаны с определенными процессами заболевания. Одним из белков, постоянно присутствующих в ND10, является Sp100, аутоантитела к которому преобладают при первичном билиарном циррозе (Szostecki et al.1990). Другой белок в ND10 — это белок промиелоцитарного лейкоза (PML), который слит с рецептором ретиноевой кислоты α при остром промиелоцитарном лейкозе (APL) (deThe et al., 1990; Goddard et al. 1991; Kakizuka et al. 1991; Pandolfi) и др., 1991). Присутствие PML дикого типа в ND10 и дисперсия этой структуры в APL предполагает участие этих доменов в дифференцировке промиелоцитов (Dyck et al. 1994; Weis et al. 1994). Кроме того, PML недавно стал центром внимания в других контекстах.Он был идентифицирован как белок-супрессор опухолей (Mu et al. 1994), участвующий в апоптозе (Quignon et al. 1998; Wang et al. 1998), регулятор экспрессии MHC (Zheng et al. 1998) и вместе с Sp100 , активируется интерфероном (Lavau et al. 1995; Grotzinger et al. 1996). Разрозненная информация о ND10 как о ядерной структуре тайно накапливается по нескольким направлениям исследований. Концентрированный подход к решению вопроса о том, как формируется и поддерживается такой выдающийся ядерный домен, отсутствовал.Мы сосредотачиваемся здесь на том, как собираются ND10 и как его образование и поддержание контролируются в рамках концептуальной основы, которая определяет ND10 как потенциальное ядерное депо, где определенные белки регулируются посредством рекрутирования и высвобождения.
1994), участвующий в апоптозе (Quignon et al. 1998; Wang et al. 1998), регулятор экспрессии MHC (Zheng et al. 1998) и вместе с Sp100 , активируется интерфероном (Lavau et al. 1995; Grotzinger et al. 1996). Разрозненная информация о ND10 как о ядерной структуре тайно накапливается по нескольким направлениям исследований. Концентрированный подход к решению вопроса о том, как формируется и поддерживается такой выдающийся ядерный домен, отсутствовал.Мы сосредотачиваемся здесь на том, как собираются ND10 и как его образование и поддержание контролируются в рамках концептуальной основы, которая определяет ND10 как потенциальное ядерное депо, где определенные белки регулируются посредством рекрутирования и высвобождения.
ND10 структурно определяются иммуногистохимической локализацией определенных белков в определенных пунктированных ядерных участках. Поэтому новые ассоциированные с ND10 белки часто обнаруживаются случайно, когда такие паттерны обнаруживаются при работе с данным белком в других контекстах. Так было с двумя белками, которые будут представлены в настоящей попытке оценить структуру ND10. Один из них, Daxx, был идентифицирован как белок, который своим COOH-концом связывается с доменом смерти Fas (Yang et al. 1997), центромерным белком CENP-C (Pluta et al. 1998), фактором транскрипции. Pax3 (Hollenbach et al. 1999) и ДНК-метилтрансфераза I (Michaelson et al. 1999). Ни один из этих белков не располагается преимущественно в ND10. Также было обнаружено, что Daxx взаимодействует с последовательностью ДНК промотора гена стероидогенного острого регуляторного белка (Kiriakidou et al.1997), а антитела против Daxx показали ядерное распределение, подобное ND10. Поэтому его дальнейшее исследование было проведено в контексте структуры ND10. Подобно Daxx, BLM, геликаза RecQ, отсутствующая у пациентов с синдромом Блума, имела точечное распределение в большинстве клеток (Neff et al. 1999), которое в ходе этого исследования оказалось ND10. Следовательно, BLM — / — фибробласты можно использовать для проверки того, какое влияние отсутствие BLM оказывает на структуру ND10.
Так было с двумя белками, которые будут представлены в настоящей попытке оценить структуру ND10. Один из них, Daxx, был идентифицирован как белок, который своим COOH-концом связывается с доменом смерти Fas (Yang et al. 1997), центромерным белком CENP-C (Pluta et al. 1998), фактором транскрипции. Pax3 (Hollenbach et al. 1999) и ДНК-метилтрансфераза I (Michaelson et al. 1999). Ни один из этих белков не располагается преимущественно в ND10. Также было обнаружено, что Daxx взаимодействует с последовательностью ДНК промотора гена стероидогенного острого регуляторного белка (Kiriakidou et al.1997), а антитела против Daxx показали ядерное распределение, подобное ND10. Поэтому его дальнейшее исследование было проведено в контексте структуры ND10. Подобно Daxx, BLM, геликаза RecQ, отсутствующая у пациентов с синдромом Блума, имела точечное распределение в большинстве клеток (Neff et al. 1999), которое в ходе этого исследования оказалось ND10. Следовательно, BLM — / — фибробласты можно использовать для проверки того, какое влияние отсутствие BLM оказывает на структуру ND10.
Стабильность, функция и локализация белков могут быть изменены посттранскрипционной модификацией.По крайней мере четыре белка ND10, Sp100, PML, CBP и pRB, являются фосфопротеинами, а PML и Sp100 ковалентно модифицируются с помощью небольшого убиквитин-связанного модификатора (SUMO-1) (Sternsdorf et al. 1997; Kamitani et al. 1998b; Muller et al. 1998). Модификация SUMO-1 PML была предложена для нацеливания этого белка на ND10 (Muller et al. 1998), а удаление сайтов для модификации SUMO-1 из PML, по-видимому, предотвращает накопление PML в ND10 (Kamitani et al. 1998a). Напротив, такая модификация не повлияла на характер локализации Sp100 (Sternsdorf et al.1997). Следовательно, модификация PML как детерминанта его взаимодействия с др. Белками предполагает себя как потенциальный механизм контроля накопления белков в ND10. Эффект модификации SUMO-1 или отсутствие такой модификации может иметь центральное значение для структурной целостности ND10 и требует оценки.
Замечательной особенностью ND10 является отложение ДНК-вирусов, таких как вирус простого герпеса типа 1, цитомегаловирус, аденовирус 5 и SV40, на ND10, и то, что их транскрипция и репликация начинается с этих сайтов (Ishov and Maul 1996; Maul et al. al.1996; Ишов и др. 1997). За исключением SV40, эти вирусы экспрессируют белки, которые модифицируют ND10. В частности, ICP0 вируса простого герпеса типа 1 накапливается в ND10 и вызывает деградацию белков, связанных с ND10 (Maul et al. 1993; Everett and Maul 1994; Maul and Everett 1994; Everett et al. 1998, Everett et al. 1999; Chelbi) -Alix and de The 1999). Деградация PML включает десумофикацию с последующим гидролизом по пути убиквитин / протеосома (Everett et al. 1998, Everett et al. 1999).Это открытие предполагает участие десумофификации и / или гидролиза PML в разрушении ND10, хотя преимущества для вируса пока не очевидны.
ND10 модифицированы другими эффекторами ядерных функций. Стресс в виде теплового шока или воздействия тяжелых металлов приводит к диспергированию белков, связанных с ND10 (Maul et al. 1995). Сообщалось, что увеличение количества и размера ND10 происходит из-за индуцированной интерфероном активации PML и Sp100 (Lavau et al.1995; Grotzinger et al. 1996). Кроме того, самыми ранними наблюдаемыми изменениями в ND10 были изменения размера, связанные с гормональными изменениями в эндометрии матки и эпителиальных клетках молочной железы (Padykula et al. 1981; Fitzgerald and Padykula 1983). Общим для всех агентов, вызывающих модификации в ND10, является их глобальное влияние на ядерный метаболизм, хотя сигнальный путь, который влияет на изменения в ND10, полностью не изучен, и к нему можно подойти только после того, как мы узнаем о механизмах набора и высвобождения в этом ядре. сайт.
Стресс в виде теплового шока или воздействия тяжелых металлов приводит к диспергированию белков, связанных с ND10 (Maul et al. 1995). Сообщалось, что увеличение количества и размера ND10 происходит из-за индуцированной интерфероном активации PML и Sp100 (Lavau et al.1995; Grotzinger et al. 1996). Кроме того, самыми ранними наблюдаемыми изменениями в ND10 были изменения размера, связанные с гормональными изменениями в эндометрии матки и эпителиальных клетках молочной железы (Padykula et al. 1981; Fitzgerald and Padykula 1983). Общим для всех агентов, вызывающих модификации в ND10, является их глобальное влияние на ядерный метаболизм, хотя сигнальный путь, который влияет на изменения в ND10, полностью не изучен, и к нему можно подойти только после того, как мы узнаем о механизмах набора и высвобождения в этом ядре. сайт.
ND10 диспергируются при вирусной инфекции и в APL и повторно собираются при лечении этого заболевания ретиноевой кислотой и мышьяком (As 2 O 3 ). Это убедительно свидетельствует о том, что эта ядерная структура важна для ряда патологических процессов. Следовательно, изучение механизма сборки является важным шагом к пониманию функции ND10 в процессах болезни, а также в нормальной ядерной активности.Поскольку механизм сборки ND10, вероятно, связан с межбелковыми взаимодействиями, мы провели исследования, чтобы идентифицировать белки, которые необходимы для образования этих доменов. В ходе этого исследования мы обнаружили следующее: (1) PML, но не Sp100 или новый компонент BLM ND10, важен для сборки ND10; (2) недавно охарактеризованный Daxx (Kiriakidou et al. 1997; Yang et al. 1997; Pluta et al. 1998; Hollenbach et al. 1999; Michaelson et al. 1999) представляет собой новый ассоциированный с ND10 белок и взаимодействует с PML; (3) это взаимодействие необходимо для рекрутирования Daxx с гетерохроматина на ND10; и (4) это рекрутирование контролируется модификацией PML SUMO-1.Взятые вместе, эти результаты предоставляют нам основы образования ND10 и предлагают механизм для его динамического контроля.
Это убедительно свидетельствует о том, что эта ядерная структура важна для ряда патологических процессов. Следовательно, изучение механизма сборки является важным шагом к пониманию функции ND10 в процессах болезни, а также в нормальной ядерной активности.Поскольку механизм сборки ND10, вероятно, связан с межбелковыми взаимодействиями, мы провели исследования, чтобы идентифицировать белки, которые необходимы для образования этих доменов. В ходе этого исследования мы обнаружили следующее: (1) PML, но не Sp100 или новый компонент BLM ND10, важен для сборки ND10; (2) недавно охарактеризованный Daxx (Kiriakidou et al. 1997; Yang et al. 1997; Pluta et al. 1998; Hollenbach et al. 1999; Michaelson et al. 1999) представляет собой новый ассоциированный с ND10 белок и взаимодействует с PML; (3) это взаимодействие необходимо для рекрутирования Daxx с гетерохроматина на ND10; и (4) это рекрутирование контролируется модификацией PML SUMO-1.Взятые вместе, эти результаты предоставляют нам основы образования ND10 и предлагают механизм для его динамического контроля.
Для анализа внутриядерного распределения различных мутантов Daxx мы сначала сконструировали плазмиду pET, кодирующую GFP с сигналом ядерной локализации от большого Т-антигена SV40 (аминокислота PKKKRKV). Два синтетических олигонуклеотида (5′-AATTCTCCTAAGAAGAAGCGTAAGG-3 ‘и 5′-TCGACCTTACGCTTCTTCTTAGGAG-3′) были отожжены и вставлены в COOH-конец открытой рамки считывания GFP между сайтами EcoRI и SalI на pEGFP-Laboratories (CLONTACG). .Различные делеционные мутанты hDaxx были сконструированы путем субклонирования в вектор pET, разрезанный BamHI. Соответствующие фрагменты продуктов ПЦР, разрезанных с помощью BamHI, амплифицировали с помощью смыслового праймера 5’-CACACGGATCCGCCACCGCTAACAGC-3 ‘и антисмысловых праймеров: 5′-GTGGTGGATCCCTCCTCTGATTGCTTCCTGG-3′ для Daxx 1-595 аминокислот; 5’-GTGGTGGATCCATCAGAGTCTGAGAGCACGATG-3 ‘для Daxx 1-740 аминокислот; или фрагмент ПЦР, разрезанный BglII-BamHI, амплифицированный с 5’-CACACAGATCTGATTCTGGTCCCCCCTGC-3 ‘в качестве смыслового и антисмыслового праймеров 5′-GTGGTGGATCCATCAGAGTCTGAGAGCACGATG-3’ для Daxx 624–740 аминокислот с использованием высокоточной полимеразы Daxx 624–740 и p-VDX-30 (новая полимераза, Англия). (Kiriakidou et al.1997) в качестве матрицы для гена Daxx. Все конструкции были проверены секвенированием. Плазмиды PML-K65,160,490R (называемые здесь PMLΔSUMO), PML-K65R и PML-K65,160R (Kamitani et al. 1998a), основанные на плазмиде pcDNA3 (Invitrogen), экспрессируют мутанты PML, слитые с RGS-His. с соответствующими лизинами, замещенными аргининами. Временные трансфекции проводили с использованием реагента DOSPER (Boehringer) в соответствии с рекомендациями производителя.
(Kiriakidou et al.1997) в качестве матрицы для гена Daxx. Все конструкции были проверены секвенированием. Плазмиды PML-K65,160,490R (называемые здесь PMLΔSUMO), PML-K65R и PML-K65,160R (Kamitani et al. 1998a), основанные на плазмиде pcDNA3 (Invitrogen), экспрессируют мутанты PML, слитые с RGS-His. с соответствующими лизинами, замещенными аргининами. Временные трансфекции проводили с использованием реагента DOSPER (Boehringer) в соответствии с рекомендациями производителя.
Чтобы ответить на вопрос, какие белки необходимы для образования или поддержания ND10, мы идентифицировали клеточные линии, которые не экспрессируют определенные белки, связанные с ND10.Первая идентифицированная клеточная линия возникла в результате наблюдения, что белок BLM, член DExH-бокса, содержащий ДНК-геликазы, локализован в дискретных ядерных доменах в большинстве клеток (Neff et al. 1999). Иммуноокрашивание BML — / — фибробластов, полученных от пациентов с синдромом BLM, не выявило какого-либо окрашивания дискретных доменов, что подтверждает специфичность локализации BML на таких участках в нормальных клетках. Эти пациенты гомозиготны по мутации в гене BLM, которая приводит к раннему усечению геликазы BLM.Двойное мечение первичных фибробластов человека антителами против PML, конститутивного белка, ассоциированного с ND10, и антител против BLM показало, что эти два антитела помечены ND10 (рис. 1, A – C). Чтобы определить, влияет ли отсутствие геликазы BLM на ND10, фибробласты BML — / — были дважды помечены антителами против нескольких белков, связанных с ND10 (PML, Sp100, SUMO-1 и CBP). Все они были обнаружены в ND10 (показаны для PML на рис. 1, D – F). Таким образом, геликаза BLM не важна для образования ND10.
Эти пациенты гомозиготны по мутации в гене BLM, которая приводит к раннему усечению геликазы BLM.Двойное мечение первичных фибробластов человека антителами против PML, конститутивного белка, ассоциированного с ND10, и антител против BLM показало, что эти два антитела помечены ND10 (рис. 1, A – C). Чтобы определить, влияет ли отсутствие геликазы BLM на ND10, фибробласты BML — / — были дважды помечены антителами против нескольких белков, связанных с ND10 (PML, Sp100, SUMO-1 и CBP). Все они были обнаружены в ND10 (показаны для PML на рис. 1, D – F). Таким образом, геликаза BLM не важна для образования ND10.
В предыдущих исследованиях мы обнаружили, что ядра большинства клеток мозга не содержат скоплений Sp100 (Cho et al. 1998). Поэтому мы проверили экспрессию Sp100 в клетках эмбриокарциномы NT2 человека, которые могут быть индуцированы к дифференцировке в нервноподобные клетки с помощью ретиноевой кислоты (Dyck et al. 1995). Используя клетки HEp-2 в качестве контроля, мы проверили с помощью вестерн-блоттинга наличие Sp100 и PML в клетках NT2. Поскольку Sp100, как и PML, имеет элементы ответа на интерферон в своих промоторных областях (Grotzinger et al.1996), мы стимулировали клетки в течение 24 часов с помощью интерферона α, чтобы повысить уровень экспрессии, потенциально необнаруживаемый. Обе клеточные линии содержали PML (фиг. 1J, дорожки 5 и 7), хотя количество PML было выше в клетках HEp-2. Лечение интерфероном резко увеличивало количество ПМЛ (сравните дорожки 5 и 6 с дорожками 7 и 8). Неспецифическая полоса, отмеченная звездочкой, указывает на одинаковую нагрузку. Sp100 не был обнаружен в клетках NT2 даже после активации интерферона (дорожки 1 и 2), тогда как в клетках HEp2 обработка интерфероном приводила к значительному усилению сигнала Sp100 (дорожки 3 и 4).Результаты вестерн-блоттинга были подтверждены иммуноокрашиванием двумя разными антителами против Sp100 человеческого и кроличьего происхождения.
1995). Используя клетки HEp-2 в качестве контроля, мы проверили с помощью вестерн-блоттинга наличие Sp100 и PML в клетках NT2. Поскольку Sp100, как и PML, имеет элементы ответа на интерферон в своих промоторных областях (Grotzinger et al.1996), мы стимулировали клетки в течение 24 часов с помощью интерферона α, чтобы повысить уровень экспрессии, потенциально необнаруживаемый. Обе клеточные линии содержали PML (фиг. 1J, дорожки 5 и 7), хотя количество PML было выше в клетках HEp-2. Лечение интерфероном резко увеличивало количество ПМЛ (сравните дорожки 5 и 6 с дорожками 7 и 8). Неспецифическая полоса, отмеченная звездочкой, указывает на одинаковую нагрузку. Sp100 не был обнаружен в клетках NT2 даже после активации интерферона (дорожки 1 и 2), тогда как в клетках HEp2 обработка интерфероном приводила к значительному усилению сигнала Sp100 (дорожки 3 и 4).Результаты вестерн-блоттинга были подтверждены иммуноокрашиванием двумя разными антителами против Sp100 человеческого и кроличьего происхождения. Накопления Sp100 не наблюдались в клетках NT2 с активацией интерферона или без нее (показано для кроличьих антител к Sp100 на рис. 1, G – I). Однако большинство клеток NT2 содержали ND10, о чем судили по присутствию PML в определенных сайтах. Анализ с использованием всей панели ND10-специфических антител выявил присутствие всех соответствующих антигенов в PML-положительных сайтах.Отрицательный фенотип Sp100 также сохранялся после дифференцировки, индуцированной обработкой ретиноевой кислотой, и в клетках нейробластомы NGP (данные не показаны). Таким образом, мы пришли к выводу, что Sp100 отсутствует в клетках NT2 и что присутствие Sp100 не является существенным для поддержания ND10.
Накопления Sp100 не наблюдались в клетках NT2 с активацией интерферона или без нее (показано для кроличьих антител к Sp100 на рис. 1, G – I). Однако большинство клеток NT2 содержали ND10, о чем судили по присутствию PML в определенных сайтах. Анализ с использованием всей панели ND10-специфических антител выявил присутствие всех соответствующих антигенов в PML-положительных сайтах.Отрицательный фенотип Sp100 также сохранялся после дифференцировки, индуцированной обработкой ретиноевой кислотой, и в клетках нейробластомы NGP (данные не показаны). Таким образом, мы пришли к выводу, что Sp100 отсутствует в клетках NT2 и что присутствие Sp100 не является существенным для поддержания ND10.
Вопрос о том, важен ли PML для сборки и обслуживания ND10, был протестирован в ячейках PML — / — MPEF. Чтобы получить разумную уверенность в том, что ND10 присутствует или отсутствует в клетках PML — / — MPEF, нам понадобилась панель антител, которые реагировали с несколькими белками, ассоциированными с ND10 мыши. Мы идентифицировали кроличьи антитела, которые реагировали с PML человека и мыши и меченные ND10 в фибробластах мыши (рис. 2, A – C). Это антитело использовали для идентификации антител, специфичных для белков мыши, расположенных в ND10. Проведя скрининг нескольких Sp100-положительных аутоантител человека, мы идентифицировали одно, которое взаимодействует с мышиным Sp100 (рис. 2А и рис. D). Специфичность антитела подтверждали вестерн-блоттингом с использованием рекомбинантного Sp100. Кроме того, mAb против NDP55 помечены ND10 (фиг. 2B и фиг. E).Кроме того, SUMO-1, который может модифицировать как PML, так и Sp100, был обнаружен у мышей ND10 (фиг. 2C и фиг. F). Чтобы показать, что Sp100, NDP55 и SUMO-1 сосредоточены в ND10, они представлены в виде отдельных зеленых изображений под объединенным изображением в верхнем ряду. Эта панель из четырех антител распознала мышиный ND10 и использовалась для исследования присутствия ND10 в PML — / — MPEF.
Мы идентифицировали кроличьи антитела, которые реагировали с PML человека и мыши и меченные ND10 в фибробластах мыши (рис. 2, A – C). Это антитело использовали для идентификации антител, специфичных для белков мыши, расположенных в ND10. Проведя скрининг нескольких Sp100-положительных аутоантител человека, мы идентифицировали одно, которое взаимодействует с мышиным Sp100 (рис. 2А и рис. D). Специфичность антитела подтверждали вестерн-блоттингом с использованием рекомбинантного Sp100. Кроме того, mAb против NDP55 помечены ND10 (фиг. 2B и фиг. E).Кроме того, SUMO-1, который может модифицировать как PML, так и Sp100, был обнаружен у мышей ND10 (фиг. 2C и фиг. F). Чтобы показать, что Sp100, NDP55 и SUMO-1 сосредоточены в ND10, они представлены в виде отдельных зеленых изображений под объединенным изображением в верхнем ряду. Эта панель из четырех антител распознала мышиный ND10 и использовалась для исследования присутствия ND10 в PML — / — MPEF.
Когда PML — / — MPEF были протестированы на распределение различных белков, связанных с ND10, ни Sp100, NDP55, ни SUMO-1 не были обнаружены в типичном ND10. Вместо этого эти белки появляются по всему ядру без каких-либо скоплений ND10 (Fig. 2, сравните D – F с G – I). Характер распределения трех ассоциированных с ND10 белков в отсутствие PML предполагает, что PML является вероятным кандидатом для установления целостности ND10. Чтобы проверить эту возможность, мы экспрессировали PML в клетках PML — / — MPEF с помощью временной трансфекции и исследовали расположение Sp100, NDP55 и SUMO-1. При низких уровнях экспрессии PML появлялся в доменах с частотой и распределением ND10 в клетках дикого типа (рис.2, J – L). При накоплении PML появлялись более крупные агрегаты с более низкой частотой (рис. 2 J, сравните нижние левые и верхние левые клетки), а иногда наблюдались скопления цитоплазмы (рис. 2 L, нижние клетки). Все протестированные белки ND10 мыши были разделены на PML-положительные структуры. Эти наблюдения установили, что PML важен для сборки ND10 и для сегрегации и накопления белков, ассоциированных с ND10.
Вместо этого эти белки появляются по всему ядру без каких-либо скоплений ND10 (Fig. 2, сравните D – F с G – I). Характер распределения трех ассоциированных с ND10 белков в отсутствие PML предполагает, что PML является вероятным кандидатом для установления целостности ND10. Чтобы проверить эту возможность, мы экспрессировали PML в клетках PML — / — MPEF с помощью временной трансфекции и исследовали расположение Sp100, NDP55 и SUMO-1. При низких уровнях экспрессии PML появлялся в доменах с частотой и распределением ND10 в клетках дикого типа (рис.2, J – L). При накоплении PML появлялись более крупные агрегаты с более низкой частотой (рис. 2 J, сравните нижние левые и верхние левые клетки), а иногда наблюдались скопления цитоплазмы (рис. 2 L, нижние клетки). Все протестированные белки ND10 мыши были разделены на PML-положительные структуры. Эти наблюдения установили, что PML важен для сборки ND10 и для сегрегации и накопления белков, ассоциированных с ND10.
Ранее было показано, что PML не может напрямую взаимодействовать с Sp100 (Sternsdorf et al. 1997). Однако он может рекрутировать Sp100 в ND10 при временной экспрессии в клетках PML — / — MPEF. Мы пришли к выводу, что некоторые адаптерные белки д. Опосредовать это взаимодействие, и провели поиск новых белков, которые были частью ND10 и взаимодействовали с PML. В предыдущих исследованиях мы клонировали человеческий Daxx благодаря его способности связываться со стероидогенным фактором-1-подобным сайтом связывания в последовательности ДНК промотора гена стероидогенного острого регуляторного белка человека (Kiriakidou et al. 1997). Кроличьи антитела, продуцируемые против этого белка, показали ядерное распределение, подобное ND10.По сравнению с PML, Daxx прекрасно колокализуется в ND10 (рис. 3, A – C). Поскольку Daxx взаимодействует с доменом смерти Fas (Yang et al. 1997) и, следовательно, ожидалось, что это цитоплазматический белок, мы подтвердили расположение Daxx в ND10 с двумя другими независимо созданными антителами, чтобы гарантировать, что антиген, обнаруженный в ND10, был действительно идентичен Daxx.
1997). Однако он может рекрутировать Sp100 в ND10 при временной экспрессии в клетках PML — / — MPEF. Мы пришли к выводу, что некоторые адаптерные белки д. Опосредовать это взаимодействие, и провели поиск новых белков, которые были частью ND10 и взаимодействовали с PML. В предыдущих исследованиях мы клонировали человеческий Daxx благодаря его способности связываться со стероидогенным фактором-1-подобным сайтом связывания в последовательности ДНК промотора гена стероидогенного острого регуляторного белка человека (Kiriakidou et al. 1997). Кроличьи антитела, продуцируемые против этого белка, показали ядерное распределение, подобное ND10.По сравнению с PML, Daxx прекрасно колокализуется в ND10 (рис. 3, A – C). Поскольку Daxx взаимодействует с доменом смерти Fas (Yang et al. 1997) и, следовательно, ожидалось, что это цитоплазматический белок, мы подтвердили расположение Daxx в ND10 с двумя другими независимо созданными антителами, чтобы гарантировать, что антиген, обнаруженный в ND10, был действительно идентичен Daxx. Как коммерческие кроличьи антитела, так и мышиные антитела, продуцируемые против рекомбинантного фрагмента hDaxx, реагировали с той же структурой, что и антитела к PML.Специфичность антител к Daxx подтверждали вестерн-блоттингом транслированного in vitro hDaxx (не показано). Эти эксперименты убедительно опровергли возможность того, что антитела идентифицировали ложную локализацию.
Как коммерческие кроличьи антитела, так и мышиные антитела, продуцируемые против рекомбинантного фрагмента hDaxx, реагировали с той же структурой, что и антитела к PML.Специфичность антител к Daxx подтверждали вестерн-блоттингом транслированного in vitro hDaxx (не показано). Эти эксперименты убедительно опровергли возможность того, что антитела идентифицировали ложную локализацию.
В дополнение к Fas, Daxx, как было установлено, взаимодействует с CENP-C и локализуется на центромерах зависимым от клеточного цикла способом (Pluta et al. 1998). Когда мы использовали человеческие аутоантитела против центромерных белков вместе с антителами к Daxx в фибробластах мыши дикого типа, мы обнаружили, что некоторые сайты действительно колокализовались.Однако в большинстве случаев Daxx располагался рядом с центромерами или не проявлялся на центромерах (Fig. 3 D). Мы пришли к выводу, что Daxx находится в самой высокой концентрации в ND10 и, следовательно, является новым белком, связанным с ND10.
Чтобы исследовать возможность того, что локализация Daxx отражает взаимодействие между Daxx и другим белком, связанным с ND10, мы использовали дрожжевой двухгибридный анализ. Мы определили, может ли Daxx взаимодействовать с Sp100 и / или PML, слитым с GAL4DB.Daxx сливали с VP16, и плазмиду, продуцирующую VP16, использовали в качестве отрицательного контроля. Для количественной оценки силы взаимодействия мы использовали анализ жидкой β-галактозидазы. Используя этот анализ, мы не наблюдали никаких доказательств взаимодействия между Daxx и Sp100. Напротив, Daxx сильно взаимодействовал с PML (таблица).
Чтобы оценить специфичность этого взаимодействия, мы нанесли на карту область Daxx, которая необходима для взаимодействия с PML (подробности см. В таблице).Мутант с делецией спирально-спиральной области PML все еще может взаимодействовать с Daxx, хотя он также может взаимодействовать только с Vp16 (см. Также Ahn et al. 1998). Неожиданно два из Daxx NH 2 -концевых делеционных мутантов (аминокислоты 488-740 и 625-740) взаимодействовали с PML примерно в три раза сильнее, чем полноразмерная молекула. Концевая область NH 2 Daxx может снижать силу его взаимодействия с PML, вероятно, в результате сворачивания белка. Напротив, мутант с COOH-терминальной делецией (аминокислоты 1-625) и самая маленькая конструкция COOH-терминала (аминокислоты 661-740) вообще не могли взаимодействовать.Другой мутант с делецией Daxx (аминокислоты 433-740) показал взаимодействие в ~ 20 раз более слабое, чем мутант Daxx 488-740 по аминокислотам. Более слабый сигнал может отражать воздействие богатой кислыми аминокислотами области между аминокислотами 434 и 485, уменьшая взаимодействие. Таким образом, домен взаимодействия PML, как определено в дрожжевом двугибридном анализе, находится между аминокислотами 625 и 740, а аминокислоты 625–661 важны для этого взаимодействия. Вместе эти данные демонстрируют, что Daxx взаимодействует с PML и предполагает, что пространственная совместная локализация PML и Daxx в ND10 отражает взаимодействие между этими двумя белками.
Также Ahn et al. 1998). Неожиданно два из Daxx NH 2 -концевых делеционных мутантов (аминокислоты 488-740 и 625-740) взаимодействовали с PML примерно в три раза сильнее, чем полноразмерная молекула. Концевая область NH 2 Daxx может снижать силу его взаимодействия с PML, вероятно, в результате сворачивания белка. Напротив, мутант с COOH-терминальной делецией (аминокислоты 1-625) и самая маленькая конструкция COOH-терминала (аминокислоты 661-740) вообще не могли взаимодействовать.Другой мутант с делецией Daxx (аминокислоты 433-740) показал взаимодействие в ~ 20 раз более слабое, чем мутант Daxx 488-740 по аминокислотам. Более слабый сигнал может отражать воздействие богатой кислыми аминокислотами области между аминокислотами 434 и 485, уменьшая взаимодействие. Таким образом, домен взаимодействия PML, как определено в дрожжевом двугибридном анализе, находится между аминокислотами 625 и 740, а аминокислоты 625–661 важны для этого взаимодействия. Вместе эти данные демонстрируют, что Daxx взаимодействует с PML и предполагает, что пространственная совместная локализация PML и Daxx в ND10 отражает взаимодействие между этими двумя белками.
Результаты дрожжевого двугибридного анализа показали, что Daxx и PML взаимодействуют, и совместная локализация двух белков в ND10 согласуется с физиологической ассоциацией. Чтобы проверить, будут ли различные делеции в Daxx влиять на локализацию Daxx в контексте клеток млекопитающих, мы слили мутанты с GFP-NLS. В соответствии с результатами непрямой иммунофлуоресценции, слитый белок GFP-Daxx, как было обнаружено, эффективно накапливается в PML-положительных сайтах (рис.4, А – В). Напротив, мутант с COOH-концевой делецией (аминокислоты 1-595), у которого отсутствует область взаимодействия с PML, диффузно присутствует по всему ядру и не накапливается в PML-положительных сайтах (Fig. 4, D-F). Результаты дрожжевого двугибридного взаимодействия были также подтверждены обнаружением того, что Daxx COOH-терминальной области (аминокислоты 624-740) одной достаточно для локализации GFP на ND10 (Fig. 4, G-I). Эти данные предполагают, что взаимодействие Daxx с PML необходимо для локализации ND10.
4, G-I). Эти данные предполагают, что взаимодействие Daxx с PML необходимо для локализации ND10.
Если Daxx накапливается в ND10 посредством взаимодействия с PML, можно предсказать другое распределение Daxx в ячейках без PML. В нормальных фибробластах мышей Daxx специфически колокализуется с PML в ND10 (Fig. 3, A – G). Однако в отсутствие PML (мышиные PML — / — фибробласты) мы обнаружили, что локализация Daxx совершенно иная. Daxx был локализован в участках, которые при контрастном окрашивании на ДНК оказались конденсированным хроматином (рис.3, E – G). Следовательно, в отсутствие ND10 конденсированный хроматин является альтернативным ядерным компартментом накопления Daxx.
Для дальнейшего изучения взаимосвязи между PML и Daxx мы проверили, может ли PML рекрутировать эндогенный Daxx в ND10 при временной экспрессии в клетках PML — / — MPEF. Как показано на фиг. 3H – J, нетрансфицированные клетки PML — / — MPEF обнаруживают пятнистое распределение Daxx, характерное для его локализации в конденсированном хроматине.В клетках, трансфицированных PML (Fig. 3, HJ, верхние клетки), Daxx не обнаруживается на конденсированном хроматине, а вместо этого теперь колокализуется почти исключительно с PML. Эти PML-индуцированные структуры, как было обнаружено, также содержат др. Ассоциированные с ND10 белки (Fig. 2, J – L) и, следовательно, рассматриваются как ND10.
Как показано на фиг. 3H – J, нетрансфицированные клетки PML — / — MPEF обнаруживают пятнистое распределение Daxx, характерное для его локализации в конденсированном хроматине.В клетках, трансфицированных PML (Fig. 3, HJ, верхние клетки), Daxx не обнаруживается на конденсированном хроматине, а вместо этого теперь колокализуется почти исключительно с PML. Эти PML-индуцированные структуры, как было обнаружено, также содержат др. Ассоциированные с ND10 белки (Fig. 2, J – L) и, следовательно, рассматриваются как ND10.
Чтобы проверить, может ли PML восстанавливать накопление Daxx на ND10 без сильной сверхэкспрессии, вызванной временной трансфекцией, мы провели эксперимент слияния клеток, в котором клетки PML — / — MPEF были слиты с человеческими фибробластами в качестве источника PML.Видовую специфичность клеток определяли по распределению ДНК, которое показало сильно конденсированный хроматин для клеток мыши (рис. 3К, сравните левую и нижнюю клетки с той, что находится в правом верхнем углу). В неслитых клетках мыши (рис. 3, K – N, нижняя клетка) Daxx обнаруживается в максимальной концентрации только в конденсированном хроматине. Но в другой мышиной клетке (верхняя левая клетка), которая стала положительной для человеческого PML в результате слияния с HF (верхняя правая клетка), Daxx начал появляться в дополнительных доменах, которые совместно локализовались с PML.В этом эксперименте мы не смогли различить Daxx человека и мыши. Однако обнаружение того, что mDaxx после сверхэкспрессии hPML в PML — / — MPEF клетках рекрутируется в ND10 (Fig. 3 J), делает вероятным, что в эксперименте слияния mDaxx может накапливаться в PML-позитивных структурах. Таким образом, мы пришли к выводу, что физиологические количества PML могут вызывать образование ND10 в ядрах, которые в норме их не имеют.
3К, сравните левую и нижнюю клетки с той, что находится в правом верхнем углу). В неслитых клетках мыши (рис. 3, K – N, нижняя клетка) Daxx обнаруживается в максимальной концентрации только в конденсированном хроматине. Но в другой мышиной клетке (верхняя левая клетка), которая стала положительной для человеческого PML в результате слияния с HF (верхняя правая клетка), Daxx начал появляться в дополнительных доменах, которые совместно локализовались с PML.В этом эксперименте мы не смогли различить Daxx человека и мыши. Однако обнаружение того, что mDaxx после сверхэкспрессии hPML в PML — / — MPEF клетках рекрутируется в ND10 (Fig. 3 J), делает вероятным, что в эксперименте слияния mDaxx может накапливаться в PML-позитивных структурах. Таким образом, мы пришли к выводу, что физиологические количества PML могут вызывать образование ND10 в ядрах, которые в норме их не имеют.
PML модифицируется по крайней мере на трех участках. Модификация SUMO-1 казалась необходимой для отложения PML в ND10 (Kamitani et al. 1998a; Muller et al. 1998). Поэтому нас интересовало, влияет ли эта модификация на взаимодействие с Daxx. Двойное мечение клеток HEp-2 для SUMO-1 и сверхэкспрессированного PML показало, что PML в ядре колокализуется с SUMO-1 в больших агрегатах, и что цитоплазматические агрегаты PML не окрашиваются на SUMO-1. Это свидетельствует о том, что только ядерный ПМЛ был модифицирован SUMO-1 (рис. 5А и рис.E, сравните желтые ядерные домены, возникающие в результате совместной локализации PML / SUMO-1 и красного окрашивания цитоплазматического PML). Мы проверили, влияет ли удаление сайтов модификации SUMO-1 в PML на агрегацию SUMO-1 в PML-положительных сайтах. Сайты модификации SUMO-1 были идентифицированы ранее у лизинов 65, 160 и 490 (Kamitani et al. 1998a). Мы трансфицировали клетки HEp-2 мутантами PML, меченными RGS-His, содержащими последовательно уменьшающееся количество лизинов, модифицированных SUMO-1, и проанализировали локализацию этих сверхэкспрессированных мутантов PML и эндогенного SUMO-1.
Модификация SUMO-1 казалась необходимой для отложения PML в ND10 (Kamitani et al. 1998a; Muller et al. 1998). Поэтому нас интересовало, влияет ли эта модификация на взаимодействие с Daxx. Двойное мечение клеток HEp-2 для SUMO-1 и сверхэкспрессированного PML показало, что PML в ядре колокализуется с SUMO-1 в больших агрегатах, и что цитоплазматические агрегаты PML не окрашиваются на SUMO-1. Это свидетельствует о том, что только ядерный ПМЛ был модифицирован SUMO-1 (рис. 5А и рис.E, сравните желтые ядерные домены, возникающие в результате совместной локализации PML / SUMO-1 и красного окрашивания цитоплазматического PML). Мы проверили, влияет ли удаление сайтов модификации SUMO-1 в PML на агрегацию SUMO-1 в PML-положительных сайтах. Сайты модификации SUMO-1 были идентифицированы ранее у лизинов 65, 160 и 490 (Kamitani et al. 1998a). Мы трансфицировали клетки HEp-2 мутантами PML, меченными RGS-His, содержащими последовательно уменьшающееся количество лизинов, модифицированных SUMO-1, и проанализировали локализацию этих сверхэкспрессированных мутантов PML и эндогенного SUMO-1. Мы наблюдали, что уменьшение накопления SUMO-1 в доменах PML соответствовало количеству мутантных лизинов. На фиг. 5B и F показаны клетки, трансфицированные мутантом PMLΔSUMO, меченным RGS-His, в котором все три остатка лизина замещены аргинином. При высоком накоплении PMLΔSUMO появляются аналогичные увеличенные, а затем искаженные ND10, как при сверхэкспрессии PML дикого типа, за исключением того, что эти накопления не метились антителами SUMO-1, как скопления PML дикого типа (рис.5 A, сравните верхнюю правую ячейку с нижней правой ячейкой). Вопреки опубликованным сообщениям, все мутанты PML накапливались в ND10 (распознаваемом по локализации эндогенного SUMO-1) на низком уровне экспрессии (фиг. 5B и фиг. F, две верхние клетки трансфицированы, нижняя правая — нет). Это накопление PMLΔSUMO указывает на то, что либо модификация SUMO-1 не является необходимой для нацеливания на ND10 PML и / или обусловлена потенциальным образованием димеров между PMLΔSUMO и PML дикого типа, где PML дикого типа может служить в качестве нацеленного на ND10 носителя.
Мы наблюдали, что уменьшение накопления SUMO-1 в доменах PML соответствовало количеству мутантных лизинов. На фиг. 5B и F показаны клетки, трансфицированные мутантом PMLΔSUMO, меченным RGS-His, в котором все три остатка лизина замещены аргинином. При высоком накоплении PMLΔSUMO появляются аналогичные увеличенные, а затем искаженные ND10, как при сверхэкспрессии PML дикого типа, за исключением того, что эти накопления не метились антителами SUMO-1, как скопления PML дикого типа (рис.5 A, сравните верхнюю правую ячейку с нижней правой ячейкой). Вопреки опубликованным сообщениям, все мутанты PML накапливались в ND10 (распознаваемом по локализации эндогенного SUMO-1) на низком уровне экспрессии (фиг. 5B и фиг. F, две верхние клетки трансфицированы, нижняя правая — нет). Это накопление PMLΔSUMO указывает на то, что либо модификация SUMO-1 не является необходимой для нацеливания на ND10 PML и / или обусловлена потенциальным образованием димеров между PMLΔSUMO и PML дикого типа, где PML дикого типа может служить в качестве нацеленного на ND10 носителя. Мы пришли к выводу, что PML, модифицированный SUMO-1, появляется только в ядре, и подтвердили in situ, что PMLΔSUMO не является модифицированным SUMO-1.
Мы пришли к выводу, что PML, модифицированный SUMO-1, появляется только в ядре, и подтвердили in situ, что PMLΔSUMO не является модифицированным SUMO-1.
Мы проверили, влияет ли на эндогенное рекрутирование Daxx в ND10 уровень модификации PML SUMO-1. Клетки HEp-2 трансфицировали плазмидами экспрессии PML и PMLΔSUMO и тестировали на локализацию эндогенного Daxx. Мы обнаружили, что Daxx накапливается в доменах, образованных PML дикого типа, но не в доменах, образованных PMLΔSUMO (рис.5 сравните нижнюю ячейку в C и G с нижней левой ячейкой в D и H; клетка в верхнем левом углу D и H не трансфицирована). Эти данные демонстрируют, что накопление Daxx в ND10 и потенциально взаимодействие PML-Daxx зависит от модификации PML SUMO-1 (рис. 5, сравните A и B с C и D). Если PMLΔSUMO не рекрутирует эндогенный Daxx в домены, оба белка не должны колокализоваться при сверхэкспрессии. Когда мы котрансфицировали Daxx и PML в клетки HEp-2, мы обнаружили, что два белка колокализовались в ядре (рис. 5I и рис. J). Однако PMLΔSUMO и Daxx образуют отдельные агрегаты при сверхэкспрессии (фиг. 5K и фиг. L). Взятые вместе, эти результаты показывают, что модификация SUMO-1 PML определяет способность PML разделять Daxx на ND10.
5I и рис. J). Однако PMLΔSUMO и Daxx образуют отдельные агрегаты при сверхэкспрессии (фиг. 5K и фиг. L). Взятые вместе, эти результаты показывают, что модификация SUMO-1 PML определяет способность PML разделять Daxx на ND10.
Ядро все больше сегментируется на разные домены, которые связаны с традиционными ядерными функциями репликации и транскрипции. Эти домены определяются конкретными хромосомными территориями (Lichter et al.1988), сайты репликации (Wei et al. 1998), сайты транскрипции (Jackson et al. 1993) или домены, которые содержат избыточные компоненты сплайсинга (Spector et al. 1991). Подобно ядрышку, спиральные тельца, как предполагается, отражают высокие скорости транскрипции из-за локализации определенных генов в этих сайтах (Gao et al. 1997; Smith et al. 1995). Ядерные домены, такие как ND10 и Gemini, привлекли внимание благодаря своей связи с конкретными заболеваниями (Szostecki et al. 1990; Maul et al. 1993; Dyck et al.1994; Лю и Дрейфус 1996; Лю и др. 1997) или вирусных инфекций (Maul et al. 1993, Maul et al. 1996; Maul and Everett 1994; Ishov and Maul 1996; Ishov et al. 1997). Для ND10 также постулируется функция транскрипции (LaMorte et al. 1998). Роль ND10 как структуры остается неясной, хотя мы предположили, что эти домены функционируют как ядерные депо для ряда белков (Maul 1998). Такая модель отделяет функцию соответствующих белков, ассоциированных с ND10, от их положения в ND10.Это также предполагает, что физиологически релевантные взаимодействия этих белков с другими белками могут происходить в разных местах. Рекрутирование белков из нуклеоплазмы в ND10, приводящее к изменениям внутриядерного белкового баланса, может влиять на клеточные функции.
1990; Maul et al. 1993; Dyck et al.1994; Лю и Дрейфус 1996; Лю и др. 1997) или вирусных инфекций (Maul et al. 1993, Maul et al. 1996; Maul and Everett 1994; Ishov and Maul 1996; Ishov et al. 1997). Для ND10 также постулируется функция транскрипции (LaMorte et al. 1998). Роль ND10 как структуры остается неясной, хотя мы предположили, что эти домены функционируют как ядерные депо для ряда белков (Maul 1998). Такая модель отделяет функцию соответствующих белков, ассоциированных с ND10, от их положения в ND10.Это также предполагает, что физиологически релевантные взаимодействия этих белков с другими белками могут происходить в разных местах. Рекрутирование белков из нуклеоплазмы в ND10, приводящее к изменениям внутриядерного белкового баланса, может влиять на клеточные функции.
Модификация ND10 в ряде патологических процессов убедительно свидетельствует о том, что исследование механизма сборки ND10 является важным шагом на пути к пониманию функции этой ядерной структуры. Используя клетки, в которых отсутствует либо Sp100, либо недавно описанный белок BML, связанный с ND10, мы продемонстрировали, что ни отсутствие Sp100, ни отсутствие BLM не влияют на структуру ND10. Напротив, клетки, лишенные PML, демонстрируют дисперсию всех белков, связанных с ND10. ND10 может быть реконструирован путем введения PML в клетки PML — / — либо путем трансфекции, либо, при более физиологических концентрациях PML, посредством слияния с клетками, содержащими PML. Эта реконструкция включает рекрутирование всех белков ND10, включая Sp100, который не взаимодействует с PML, что позволяет предположить присутствие белков-посредников.Наше наблюдение устанавливает, что PML является важным белком для сборки ND10 в физиологических условиях.
Используя клетки, в которых отсутствует либо Sp100, либо недавно описанный белок BML, связанный с ND10, мы продемонстрировали, что ни отсутствие Sp100, ни отсутствие BLM не влияют на структуру ND10. Напротив, клетки, лишенные PML, демонстрируют дисперсию всех белков, связанных с ND10. ND10 может быть реконструирован путем введения PML в клетки PML — / — либо путем трансфекции, либо, при более физиологических концентрациях PML, посредством слияния с клетками, содержащими PML. Эта реконструкция включает рекрутирование всех белков ND10, включая Sp100, который не взаимодействует с PML, что позволяет предположить присутствие белков-посредников.Наше наблюдение устанавливает, что PML является важным белком для сборки ND10 в физиологических условиях.
Деструкция ND10, индуцированная продуктами немедленного раннего гена вируса герпеса (IE1 HCMV и ICP0 HSV; Everett and Maul, 1994; Kelly et al. 1995; Ishov et al. 1997; Ahn et al. 1998; Everett et al. 1998) поддерживает идею о том, что PML играет центральную роль в поддержании ND10. В частности, прямое взаимодействие IE1 с PML (Ahn et al.1998) может лишить ND10 PML и тем самым привести к их разрушению. В соответствии с этим эффектом конститутивная экспрессия IE1 в клетках астроцитомы и человеческих фибробластах также приводит к потере детектируемого ND10 (Ishov, A.M., неопубликованное наблюдение).
1998; Everett et al. 1998) поддерживает идею о том, что PML играет центральную роль в поддержании ND10. В частности, прямое взаимодействие IE1 с PML (Ahn et al.1998) может лишить ND10 PML и тем самым привести к их разрушению. В соответствии с этим эффектом конститутивная экспрессия IE1 в клетках астроцитомы и человеческих фибробластах также приводит к потере детектируемого ND10 (Ishov, A.M., неопубликованное наблюдение).
Было обнаружено, что образование ND10 сопровождает ремиссию APL в промиелоцитах (Dyck et al. 1995). После обработки ретиноевой кислотой клеток NB4, полученных из APL, доминантный отрицательный слитый белок PML – рецептор ретиноевой кислоты α (PML-RARα) селективно гидролизуется через протеосомный путь, высвобождая PML дикого типа (Muller et al.1998). Это, в свою очередь, может быть причиной образования ND10 в обработанных RA клетках NB4, которые обычно имеют только диспергированные белки, ассоциированные с ND10. Следовательно, восстановление ND10 может быть следствием доступности PML, что приводит к сегрегации других белков ND10.
Следовательно, восстановление ND10 может быть следствием доступности PML, что приводит к сегрегации других белков ND10.
Центральная роль PML в образовании ND10 предполагает присутствие белков, которые накапливаются в ND10 посредством взаимодействия с PML. Мы обнаружили, что недавно клонированный ДНК-связывающий белок Daxx (Kiriakidou et al.1997; Ян и др. 1997) был сильно сконцентрирован в ND10. Более того, мы обнаружили, что Daxx взаимодействует с PML в дрожжевом двугибридном анализе, картирует домен взаимодействия Daxx и демонстрирует, что локализация Daxx на ND10 зависит от присутствия домена взаимодействия PML, а также от модификации PML SUMO-1. Несоответствие между ранее описанными взаимодействиями Daxx с Fas (Yang et al. 1997), CENP-C (Pluta et al. 1998) и локализацией ND10 этого белка предполагает, что Daxx не накапливается вместе со всеми партнерами по взаимодействию, а преимущественно накапливается. в ND10.
в ND10.
В отсутствие PML в клетках PML — / — MPEF ND10 разрушаются. Следовательно, ожидается, что белки, ассоциированные с ND10, будут обнаружены в их альтернативных местах связывания. Большинство этих белков были рассредоточены по ядру и, таким образом, не поддались микроскопическому анализу. Только Daxx был обнаружен в более высоких концентрациях в областях конденсированного хроматина. Daxx удаляли из этих областей хроматина путем введения PML с помощью временной трансфекции, сопровождающейся образованием ND10.Следовательно, эти области хроматина имеют значительное количество ненасыщенных сайтов связывания Daxx. Мы предполагаем, что Daxx действует на сайтах, отличных от ND10, посредством взаимодействий с ДНК (Kiriakidou et al. 1997) или другими белками (Yang et al. 1997; Pluta et al. 1998; Hollenbach et al. 1999) во множестве клеточных местоположений. Может ли баланс Daxx между ND10 и конденсированным хроматином быть изменен в физиологических условиях, окончательно не установлено; однако такой баланс может представлять собой потенциальный механизм контроля.
Ключевым открытием нашего исследования было то, что накопление Daxx в ND10 зависит от модификации PML SUMO-1. В дрожжевой двугибридной системе SMT3, дрожжевой гомолог SUMO-1 (Lapenta et al. 1997), возможно, способствовал взаимодействию PML-Daxx. Более того, конъюгации SMT3 с другими дрожжевыми белками способствует Ubc9 (Johnson and Blobel 1997; Schwarz et al. 1998), дрожжевой гомолог человеческого Ubc9, который участвует в модификации SUMO-1 PML (Duprez et al.1999). Неспособность коиммунопреципитировать транслированный in vitro Daxx с рекомбинантным PML (не показан) согласуется с идеей, что модификация SUMO-1 PML опосредует это взаимодействие.
Уровень модификации SUMO-1 PML может быть определяющим для количества рекрутируемых Daxx и жадности, с которой Daxx удерживается на ND10. Следовательно, регулируемая посттрансляционная модификация PML может уравновешивать количество Daxx, доступного в ядре. В противоположность предыдущим сообщениям (Kamitani et al. 1998a; Muller et al. 1998), мы обнаружили, что модификация SUMO-1 может не быть существенной для отложения PML в ND10, а скорее приводит к накоплению Daxx в этом домене. Центральная роль PML в формировании ND10 предполагает присутствие белковой сети, где некоторые адаптерные белки могут обеспечивать рекрутирование белков, не взаимодействующих с PML, на ND10. Daxx может действовать как такой адаптер и привлекать другие белки, связанные с ND10, которые не связываются напрямую с PML (Negorev, D., неопубликованные результаты).
В противоположность предыдущим сообщениям (Kamitani et al. 1998a; Muller et al. 1998), мы обнаружили, что модификация SUMO-1 может не быть существенной для отложения PML в ND10, а скорее приводит к накоплению Daxx в этом домене. Центральная роль PML в формировании ND10 предполагает присутствие белковой сети, где некоторые адаптерные белки могут обеспечивать рекрутирование белков, не взаимодействующих с PML, на ND10. Daxx может действовать как такой адаптер и привлекать другие белки, связанные с ND10, которые не связываются напрямую с PML (Negorev, D., неопубликованные результаты).
Возникающая иерархическая модель образования ND10 представлена схематически на рис. 6. Появление ND10 после митоза д. Быть результатом события нуклеации, возможно, посредством гомо- или гетеромультимеризации PML. Это событие может иметь место на определенных участках ядерных отложений, как предполагалось ранее (Maul 1998). Активация транскрипции, например, интерфероном, может усиливать экспрессию ПМЛ (Lavau et al. 1995), зарождающие дополнительные сайты агрегации. Модификация-демодификация SUMO-1 PML (третий уровень) может привести к обратимому накоплению Daxx до ND10 (четвертый уровень), увеличивая или уменьшая доступность этого белка для альтернативных партнеров по связыванию (ДНК, CENP-C, Fas, Pax3, ДНК-метилтрансфераза) и, таким образом, регулируют соответствующие функции. Сложность и пластичность такого супрамолекулярного регуляторного механизма очевидны и структурно рассматриваются как сеть взаимодействующих белков с PML в своей основе.
1995), зарождающие дополнительные сайты агрегации. Модификация-демодификация SUMO-1 PML (третий уровень) может привести к обратимому накоплению Daxx до ND10 (четвертый уровень), увеличивая или уменьшая доступность этого белка для альтернативных партнеров по связыванию (ДНК, CENP-C, Fas, Pax3, ДНК-метилтрансфераза) и, таким образом, регулируют соответствующие функции. Сложность и пластичность такого супрамолекулярного регуляторного механизма очевидны и структурно рассматриваются как сеть взаимодействующих белков с PML в своей основе.
Мы благодарим Qinwu Lin (Институт Вистар) за техническую помощь, P. Freemont, J. Frey, R. Evans и N. Stuurman (University of Amsterdam) за предоставление антител и плазмид, а также доктора P. Pandolfi за PML — / — клетки. Мы также благодарим С. Бергера за предоставленные штаммы дрожжей и векторы для дрожжевых тестов, а также Г. Прендергаста (Институт Вистар) и Дж. Дайка (Институт Солка) за критическое прочтение рукописи.
Дайка (Институт Солка) за критическое прочтение рукописи.
Это исследование было поддержано фондами Национальных институтов здравоохранения (AI 41136; NIH GM 57599, NIH HD 34612, NSF MCB9728398) и Фонда Мазерса. Грант CA-10815 NIH Core признан за поддержку лаборатории микроскопии.
PML — датчик АФК, активирующий р53 при окислительном стрессе | Журнал экспериментальной медицины
Хронический окислительный стресс ускоряет старение.Таким образом, мы исследовали выживаемость BALB. Pml — / — и BALB. Pml + / + мышей, полученных в результате гетерозиготных скрещиваний. Значительное преимущество в выживаемости наблюдалось для самцов Pml — / — по сравнению с Pml + / + самцов (рис. 4 h). Подобная разница пограничной значимости наблюдалась у самок, которые живут значительно дольше, независимо от их статуса Pml . Патологические анализы не выявили серьезных различий между профессиональными или неполноценными самцами Pml (рис.S3). Очевидными причинами смерти были тромбоз и порок сердца. Замедленное старение может отражать дефектное старение, управляемое p53, хотя мы не можем исключить вклад других Pml -зависимых путей ( HIF1a и PPAR ; Carracedo et al., 2012). Таким образом, в контексте этого склонного к окислительному стрессу штамма отсутствие Pml задерживает старение, несмотря на высокие базальные уровни ROS и повреждение ДНК.
Патологические анализы не выявили серьезных различий между профессиональными или неполноценными самцами Pml (рис.S3). Очевидными причинами смерти были тромбоз и порок сердца. Замедленное старение может отражать дефектное старение, управляемое p53, хотя мы не можем исключить вклад других Pml -зависимых путей ( HIF1a и PPAR ; Carracedo et al., 2012). Таким образом, в контексте этого склонного к окислительному стрессу штамма отсутствие Pml задерживает старение, несмотря на высокие базальные уровни ROS и повреждение ДНК.
PML — это чувствительный к окислению белок (Jeanne et al., 2010; Сахин и др., 2014b; Рибет и др., 2017; Рис.1, а и б). Наши текущие данные показывают, что ПМЛ действует как широкий сенсор АФК, который регулирует гомеостаз АФК, по крайней мере частично, путем усиления ответов p53 (Рис. 5). Подобно p53, PML выполняет двойную роль, обеспечивая базальную защиту от ROS (фиг. 2 и 5) и облегчая апоптоз, запускаемый ROS (фиг. 3 и 5). Механически множественные петли обратной связи и перекрестные помехи существуют между ROS, PML и p53. Например, р53 транскрипционно индуцирует экспрессию PML (de Stanchina et al., 2004), увеличивая рекрутирование NB p53 и его активирующих киназ / ацетилаз (Pearson et al., 2000; Rokudai et al., 2013). Помимо стимулирования антиоксидантных реакций, ПМЛ может также непосредственно вести себя как поглотитель АФК из-за своей внутренней чувствительности к АФК (рис. 1). Было высказано предположение, что PML вмешивается в митохондриальный комплекс II, что объясняет продукцию базальных ROS и усиление активности NFR2 (Guo et al., 2014). Если дефектная функция митохондрий является причиной primum movens , объясняющей продукцию ROS у животных Pml — / — , можно ожидать, что высокие уровни ROS и повреждение ДНК будут повышать чувствительность как к NRF2, так и к p53.PML также был предложен для того, чтобы способствовать деградации NRF2 (Malloy et al.
2 и 5) и облегчая апоптоз, запускаемый ROS (фиг. 3 и 5). Механически множественные петли обратной связи и перекрестные помехи существуют между ROS, PML и p53. Например, р53 транскрипционно индуцирует экспрессию PML (de Stanchina et al., 2004), увеличивая рекрутирование NB p53 и его активирующих киназ / ацетилаз (Pearson et al., 2000; Rokudai et al., 2013). Помимо стимулирования антиоксидантных реакций, ПМЛ может также непосредственно вести себя как поглотитель АФК из-за своей внутренней чувствительности к АФК (рис. 1). Было высказано предположение, что PML вмешивается в митохондриальный комплекс II, что объясняет продукцию базальных ROS и усиление активности NFR2 (Guo et al., 2014). Если дефектная функция митохондрий является причиной primum movens , объясняющей продукцию ROS у животных Pml — / — , можно ожидать, что высокие уровни ROS и повреждение ДНК будут повышать чувствительность как к NRF2, так и к p53.PML также был предложен для того, чтобы способствовать деградации NRF2 (Malloy et al. , 2013), но потеря этого механизма отрицательной обратной связи PML должна приводить к низким базальным уровням ROS. Мы предполагаем, что, по крайней мере, in vivo, первичной мишенью PML является p53 и что активация NRF2 является компенсаторным эффектом, возникающим в результате недостаточной передачи сигналов антиоксиданта, управляемой p53 (рис. 5). NB PML также могут служить в качестве молекулярного переключателя, активирующего мишени p53 за счет мишеней NRF2. Наши исследования подчеркивают, как ПМЛ связывает АФК и вызванные стрессом изменения ядерной организации для контроля экспрессии генов.Используя специфический, подверженный стрессу генетический фон (рис. 4), мы раскрыли неожиданную роль ПМЛ в старении. Хотя последний может быть связан с путем p53, это заслуживает дальнейшего изучения. Нарушение гомеостаза АФК у животных Pml — / — может объяснить множественность PML-чувствительных биологических путей, включая PTEN / AKT или HIF1A (Bernardi et al., 2006; Trotman et al.
, 2013), но потеря этого механизма отрицательной обратной связи PML должна приводить к низким базальным уровням ROS. Мы предполагаем, что, по крайней мере, in vivo, первичной мишенью PML является p53 и что активация NRF2 является компенсаторным эффектом, возникающим в результате недостаточной передачи сигналов антиоксиданта, управляемой p53 (рис. 5). NB PML также могут служить в качестве молекулярного переключателя, активирующего мишени p53 за счет мишеней NRF2. Наши исследования подчеркивают, как ПМЛ связывает АФК и вызванные стрессом изменения ядерной организации для контроля экспрессии генов.Используя специфический, подверженный стрессу генетический фон (рис. 4), мы раскрыли неожиданную роль ПМЛ в старении. Хотя последний может быть связан с путем p53, это заслуживает дальнейшего изучения. Нарушение гомеостаза АФК у животных Pml — / — может объяснить множественность PML-чувствительных биологических путей, включая PTEN / AKT или HIF1A (Bernardi et al., 2006; Trotman et al. , 2006; Song et al., 2008 г.). Примечательно, что контроль PML над ответом на АФК и клеточным окислительно-восстановительным статусом может быть особенно важен для стареющих или стволовых клеток, которые экспрессируют высокие уровни PML и чрезвычайно чувствительны к ROS и PML.
, 2006; Song et al., 2008 г.). Примечательно, что контроль PML над ответом на АФК и клеточным окислительно-восстановительным статусом может быть особенно важен для стареющих или стволовых клеток, которые экспрессируют высокие уровни PML и чрезвычайно чувствительны к ROS и PML.
Роль убиквитинирования PML в злокачественных новообразованиях человека
Abstract
Супрессоры опухолей часто подавляются при раке человека, и понимание механизмов, посредством которых опухолевые клетки ограничивают экспрессию супрессоров опухолей, важно для прогноза и вмешательства в заболевания. Белок промиелоцитарного лейкоза (PML) играет решающую роль во множестве функций подавления опухолей, таких как ингибирование роста, апоптоз, репликативное старение, подавление онкогенной трансформации и ингибирование миграции и ангиогенеза.Эти функции подавления опухоли повторены в нескольких моделях мышей. Экспрессия белка PML часто подавляется в различных типах опухолей человека, и это подавление часто коррелирует с прогрессированием опухоли.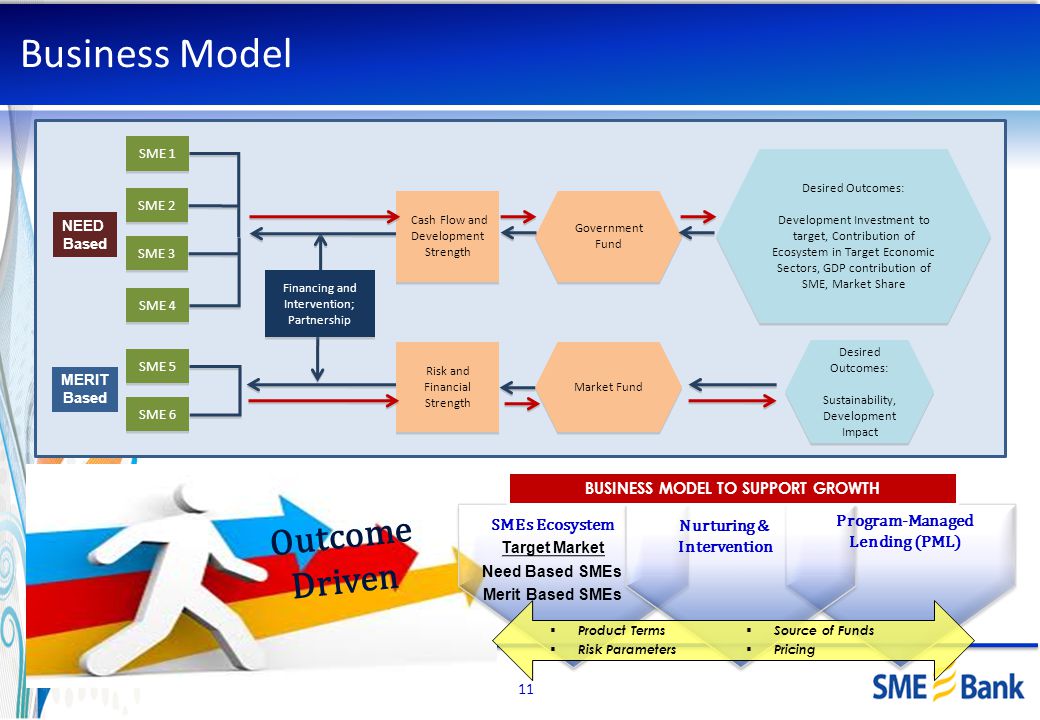 Недавно появились доказательства того, что ПМЛ аберрантно деградирует в различных типах опухолей за счет механизмов, зависящих от убиквитинирования. Здесь мы суммируем наше текущее понимание путей убиквитинирования / деградации PML при раке человека. Мы отмечаем, что множественные пути приводят к убиквитинизации и деградации PML.Более того, процессы убиквитинирования PML часто зависят от других типов посттрансляционных модификаций, таких как фосфорилирование, пролилизомеризация и сумоилирование. Такая особенность указывает на строго регулируемую природу убиквитинирования PML в различных клеточных условиях и клеточных контекстах, тем самым обеспечивая множество возможностей для вмешательства в пути убиквитинирования PML. Мы обсуждаем потенциал нацеливания на пути убиквитинирования ПМЛ для противораковых терапевтических стратегий.
Недавно появились доказательства того, что ПМЛ аберрантно деградирует в различных типах опухолей за счет механизмов, зависящих от убиквитинирования. Здесь мы суммируем наше текущее понимание путей убиквитинирования / деградации PML при раке человека. Мы отмечаем, что множественные пути приводят к убиквитинизации и деградации PML.Более того, процессы убиквитинирования PML часто зависят от других типов посттрансляционных модификаций, таких как фосфорилирование, пролилизомеризация и сумоилирование. Такая особенность указывает на строго регулируемую природу убиквитинирования PML в различных клеточных условиях и клеточных контекстах, тем самым обеспечивая множество возможностей для вмешательства в пути убиквитинирования PML. Мы обсуждаем потенциал нацеливания на пути убиквитинирования ПМЛ для противораковых терапевтических стратегий.
Ключевые слова: PML, убиквитинирование, подавление опухоли
Обзор
Введение
Ген PML был первоначально идентифицирован в точке разрыва хромосомной транслокации t (15; 17), которая встречается в большинстве случаев острый промиелоцитарный лейкоз (ОПЛ) [1]. Эта транслокация генерирует слитый белок PML-RARα, который играет ведущую роль в патогенезе APL. С момента своего открытия ген PML стал предметом интенсивных исследований. Ген человека PML может давать по крайней мере 12 транскриптов за счет альтернативного сплайсинга [2,3]. Эти изоформы имеют идентичную N-концевую область, содержащую мотив RBCC (кольцо, B-бокс и спиральная спираль), но различаются по своим C-концам. PML является важным компонентом PML-ядерных тел (PML-NBs), которые представляют собой сферические субъядерные органеллы с диаметром 0.От 1 до 1 мкм [4,5]. PML функционирует как организующий центр этой структуры, позволяя рекрутировать многочисленные белки посредством механизмов, включающих SUMO-модификации и взаимодействия [6]. Известно, что PML-NB тонко настраивают ряд клеточных процессов, и большинство из них связано с подавлением опухоли [4]. Поскольку PML имеет решающее значение для сборки PML-NB, биологические функции PML-NB довольно трудно отличить от функций PML.

Функции подавления опухоли PML
Функция подавления опухоли PML была впервые предложена путем идентификации слитого белка PML-RARα в APL.Дополнительные генетические данные получены от мышей без ПМЛ. Эти мыши склонны к развитию папилломы, карциномы и T / B-лимфомы в нескольких химических и физических режимах канцерогенеза [7]. При скрещивании с другими опухолевыми моделями мышей потеря PML ускоряет развитие опухоли [8]. Кроме того, исследования систем in vitro и / или in vivo выявили ряд вызываемых PML клеточных функций, которые связаны с подавлением опухоли. Эти функции описаны ниже:
1. Регулирование апоптоза: Многие доказательства указывают на роль PML в модуляции апоптоза.Например, лимфоциты, тимоциты и эмбриональные фибробласты, полученные от мышей PML — / — , более устойчивы к апоптозу, вызванному стимулами, которые активируют внутренний или внешний путь апоптоза, по сравнению с их аналогами дикого типа [9,10] . Проапоптотические функции PML могут быть опосредованы как p53-зависимыми, так и p53-независимыми механизмами. PML активирует p53 с помощью множества механизмов, таких как стимулирование его фосфорилирования и ацетилирования, рекрутируя его в PML-NB, а также связывая и ингибируя p53-негативный регулятор MDM2 [11,12].Помимо p53, в проапоптотическую функцию PML вовлечены несколько других факторов. Одной из таких молекул является Daxx, который рекрутируется в PML-NBs посредством взаимодействия с сумоилированным PML [13]. Сообщается, что Daxx подавляет экспрессию нескольких антиапоптотических генов при локализации в PML-NB, тем самым вызывая проапоптотические функции [14]. Недавно сообщалось, что внеядерный PML образует комплекс с инозитол-1,4,5-трифосфатным рецептором (IP3R), Akt и PP2a в ER и митохондриально-ассоциированной мембране, где PML участвует в Akt- и PP2a-зависимой модуляции IP3R. фосфорилирование, способствующее IP3R-опосредованному высвобождению кальция из ER, тем самым вызывая апоптоз [15].
Проапоптотические функции PML могут быть опосредованы как p53-зависимыми, так и p53-независимыми механизмами. PML активирует p53 с помощью множества механизмов, таких как стимулирование его фосфорилирования и ацетилирования, рекрутируя его в PML-NB, а также связывая и ингибируя p53-негативный регулятор MDM2 [11,12].Помимо p53, в проапоптотическую функцию PML вовлечены несколько других факторов. Одной из таких молекул является Daxx, который рекрутируется в PML-NBs посредством взаимодействия с сумоилированным PML [13]. Сообщается, что Daxx подавляет экспрессию нескольких антиапоптотических генов при локализации в PML-NB, тем самым вызывая проапоптотические функции [14]. Недавно сообщалось, что внеядерный PML образует комплекс с инозитол-1,4,5-трифосфатным рецептором (IP3R), Akt и PP2a в ER и митохондриально-ассоциированной мембране, где PML участвует в Akt- и PP2a-зависимой модуляции IP3R. фосфорилирование, способствующее IP3R-опосредованному высвобождению кальция из ER, тем самым вызывая апоптоз [15].
2. Регуляция клеточного старения: PML впервые был вовлечен в клеточное старение из-за его потребности в V-H-Ras-индуцированном старении посредством модуляции ацетилирования и активации p53 [16]. Впоследствии было обнаружено, что избыточная экспрессия конкретной изоформы PML, PML-IV, вызывает старение посредством Rb-зависимого механизма [17,18]. Интересно, что во время индукции старения PML-NB совместно локализуются с ассоциированными со старением гетерохроматиновыми фокусами (SAHF), Rb и E2F, которые, как считается, опосредуют индуцированную PML репрессию генов-мишеней E2F, что приводит к остановке пролиферации, повреждению ДНК и старение [19].Недавнее исследование идентифицировало TBX2, фактор транскрипции T-box, как мишень E2F, критическую для индуцированного PML старения [20].
3. Регуляция неоангиогенеза: Дефицит PML приводит к усилению неоангиогенеза и повышенной экспрессии проангиогенных факторов, таких как HIF-1α и VEGF, в опухолях человека и мышей. ПМЛ подавляет ангиогенез, отрицательно регулируя путь Akt-mTOR, который контролирует синтез белка HIF-1α. PML может рекрутировать PP2a в PML-NB, тем самым дефосфорилируя и инактивируя Akt [21].Кроме того, PML рекрутирует активатор mTOR Rheb в ядро, тем самым ингибируя mTOR [22]. Способность PML регулировать путь mTOR / HIF-1α также влияет на его функцию в ответах на гипоксию.
ПМЛ подавляет ангиогенез, отрицательно регулируя путь Akt-mTOR, который контролирует синтез белка HIF-1α. PML может рекрутировать PP2a в PML-NB, тем самым дефосфорилируя и инактивируя Akt [21].Кроме того, PML рекрутирует активатор mTOR Rheb в ядро, тем самым ингибируя mTOR [22]. Способность PML регулировать путь mTOR / HIF-1α также влияет на его функцию в ответах на гипоксию.
4. Регуляция миграции клеток: недавно было обнаружено, что PML ингибирует миграцию клеточных линий рака молочной железы MDA-MB231 путем подавления экспрессии интегрина β1. Это открытие также указывает на роль ПМЛ в подавлении метастазов опухоли [23].
5. Регуляция ответов на повреждение ДНК: PML участвует в регуляции ответов на повреждение ДНК путем нацеливания ряда эффекторов этих путей на PML-NB [24].В ответ на повреждение ДНК количество и размер PML-NB увеличиваются в зависимости от ATM и ATR [25]. Однако функциональные последствия этого явления в настоящее время неизвестны.
Регуляция экспрессии PML при раке человека
Плейотропные функции PML в подавлении опухоли предполагают, что инактивация или подавление PML может обеспечить преимущество для развития и прогрессирования опухоли. Действительно, в дополнение к нарушению функции PML слитым белком PML-RARα в APL, полная или частичная потеря экспрессии белка PML наблюдалась при раковых заболеваниях человека различного происхождения, таких как аденокарцинома простаты, аденокарцинома толстой кишки, карцинома молочной железы, карцинома легких. , лимфома, опухоли ЦНС и опухоли половых клеток.При некоторых типах опухолей, таких как рак простаты, потеря ПМЛ коррелирует с инвазивным и метастатическим прогрессированием. Интересно, что, несмотря на частое подавление белка PML в опухолях, мРНК PML экспрессируется во всех тестируемых образцах опухолей и клеточных линиях. Это исследование также показало, что обработка нескольких PML-отрицательных линий опухолевых клеток ингибитором протеасом приводит к повторной экспрессии белка PML и восстановлению PML-NB [26]. Таким образом, предполагается, что протеасомозависимая деградация является механизмом, с помощью которого опухолевые клетки ограничивают экспрессию PML.Поскольку убиквитинирование является основной посттрансляционной модификацией, которая контролирует деградацию белка через протеасомы, идентификация убиквитинлигаз PML может дать представление о механизме регуляции PML при раке человека.
Таким образом, предполагается, что протеасомозависимая деградация является механизмом, с помощью которого опухолевые клетки ограничивают экспрессию PML.Поскольку убиквитинирование является основной посттрансляционной модификацией, которая контролирует деградацию белка через протеасомы, идентификация убиквитинлигаз PML может дать представление о механизме регуляции PML при раке человека.
RNF4-опосредованное убиквитинирование ПМЛ
Триоксид мышьяка (ATO) является ведущим препаратом для выбора терапевтического средства против APL [27]. Механически ATO запускает деградацию PML-RARα через его часть PML, и сумоилирование по остатку K160 необходимо для нацеливания PML-RARα и PML на протеасому [28].Интересно, что ATO напрямую связывается с несколькими соседними локализованными остатками цистеина в домене PML RING, чтобы облегчить олигомеризацию PML [29]. Кроме того, продукция АФК, индуцированная АТО, также способствует межмолекулярному сшиванию ПМЛ дисульфидными связями [30]. Олигомеризация PML облегчает его нацеливание на PML-NBs и усиливает его взаимодействие с SUMO-конъюгированным ферментом Ubc9, облегчая тем самым гиперсумоилирование PML [29]. Недавнее исследование указывает на участие SUMO E3 ligase PIAS1 в запускаемом ATO сумоилировании PML [31].Выяснен молекулярный механизм убиквитинирования ПМЛ, вызванного сумоилированием. Семейство убиквитинлигаз, нацеленных на SUMO (STUbLs), было обнаружено благодаря наличию в них домена RING и множества взаимодействующих с SUMO мотивов (SIMs). Эта структурная особенность позволяет STUbL специфически распознавать сумоилированные субстраты [32]. RNF4 является лигазой E3 семейства STUbL и быстро рекрутируется в PML-NB после лечения ATO посредством SUMO-зависимого механизма [33]. Благодаря своим множественным SIMs, RNF4 сильно взаимодействует с полисумоилированным PML, тем самым облегчая полиубиквитинирование PML K48 и протеасомную деградацию [34,35].Истощение RNF4 приводит к накоплению полисумоилированного PML и нарушению разрушения PML, вызванного ATO.
Олигомеризация PML облегчает его нацеливание на PML-NBs и усиливает его взаимодействие с SUMO-конъюгированным ферментом Ubc9, облегчая тем самым гиперсумоилирование PML [29]. Недавнее исследование указывает на участие SUMO E3 ligase PIAS1 в запускаемом ATO сумоилировании PML [31].Выяснен молекулярный механизм убиквитинирования ПМЛ, вызванного сумоилированием. Семейство убиквитинлигаз, нацеленных на SUMO (STUbLs), было обнаружено благодаря наличию в них домена RING и множества взаимодействующих с SUMO мотивов (SIMs). Эта структурная особенность позволяет STUbL специфически распознавать сумоилированные субстраты [32]. RNF4 является лигазой E3 семейства STUbL и быстро рекрутируется в PML-NB после лечения ATO посредством SUMO-зависимого механизма [33]. Благодаря своим множественным SIMs, RNF4 сильно взаимодействует с полисумоилированным PML, тем самым облегчая полиубиквитинирование PML K48 и протеасомную деградацию [34,35].Истощение RNF4 приводит к накоплению полисумоилированного PML и нарушению разрушения PML, вызванного ATO. Среди трех остатков сумоилирования PML, K160 является наиболее критическим для рекрутирования RNF4 и ATO-индуцированного протеолиза [35]. Этот SUMO-связанный механизм убиквитинирования также применим к PML-RARα. Соответственно, первичные гемопоэтические клетки, трансформированные мутантом K160 PML-RARα, устойчивы к терминальной дифференцировке, индуцированной ATO. Доминантно-отрицательный RNF4 аналогичным образом блокирует эту индуцированную ATO дифференцировку.Таким образом, RNF4-опосредованное убиквитинирование и деградация PML-RARα играет жизненно важную роль в терапевтическом ответе APL на ATO.
Среди трех остатков сумоилирования PML, K160 является наиболее критическим для рекрутирования RNF4 и ATO-индуцированного протеолиза [35]. Этот SUMO-связанный механизм убиквитинирования также применим к PML-RARα. Соответственно, первичные гемопоэтические клетки, трансформированные мутантом K160 PML-RARα, устойчивы к терминальной дифференцировке, индуцированной ATO. Доминантно-отрицательный RNF4 аналогичным образом блокирует эту индуцированную ATO дифференцировку.Таким образом, RNF4-опосредованное убиквитинирование и деградация PML-RARα играет жизненно важную роль в терапевтическом ответе APL на ATO.
KLHL20-опосредованное убиквитинирование PML
KLHL20 является членом семейства белков BTB-kelch. Подобно многим членам этого семейства, KLHL20 образует комплекс лигазы убиквитина E3 с Cullin3 и Roc1 и функционирует как компонент связывания субстрата этой лигазы. Первой связью между KLHL20 и PML является наблюдение, что небольшая фракция KLHL20 распределяется среди PML-NB в нормальных условиях роста.Это распределение дополнительно увеличивается с увеличением транскрипции PML интерфероном [36]. Экспрессия KLHL20 индуцируется в условиях гипоксии HIF-1-зависимым образом, и эта индукция KLHL20 коррелирует с подавлением экспрессии белка PML. Последующее исследование показывает, что комплекс E3-лигазы на основе KLHL20 опосредует индуцированные гипоксией убиквитинирование и протеолиз ПМЛ. Однако нацеливание PML на KLHL20 требует двух посттрансляционных модификаций. Первый включает фосфорилирование PML по S518 с помощью CDK1 и CDK2.S518-фосфорилированный PML затем распознается пептидилпролил цис / транс--изомеразой Pin1, и катализируемая Pin1 изомеризация дополнительно усиливает взаимодействие PML с KLHL20. Важно отметить, что этот индуцированный гипоксией, KLHL20-опосредованный путь убиквитинирования PML не только ослабляет функции подавления опухоли PML, но также участвует в механизме обратной связи, чтобы максимизировать продукцию HIF-1α во время гипоксического стресса. Следовательно, путь KLHL20-PML усиливает множественные реакции опухолевой гипоксии, такие как метаболическое перепрограммирование, эпителиально-мезенхимальный переход, миграция, рост опухоли, ангиогенез и химиорезистентность, и эти функции в совокупности приводят к агрессивным фенотипам опухоли.Клинически сверхэкспрессия HIF-1α, KLHL20, Pin1 и подавление PML обнаруживаются при раке простаты. В то время как экспрессия HIF-1α положительно коррелирует с экспрессией KLHL20, экспрессия PML обратно коррелирует с экспрессией HIF-1α, KLHL20 и Pin1. Что еще более важно, профиль экспрессии HIF-1α высокий, KLHL20 высокий, Pin1 высокий и низкий профиль PML коррелирует с опухолями высокой степени злокачественности. Эти клинические данные убедительно свидетельствуют о существовании этого пути разрушения ПМЛ при раке простаты и о связи его гиперактивации с прогрессированием заболевания [37].Таким образом, комплекс Roc1-Cullin3-KLHL20 представляет собой первую убиквитинлигазу PML, которая не регулируется при раке человека, а KLHL20-опосредованная деструкция PML и регуляция обратной связи HIF-1α вносят значительный вклад в прогрессирование опухоли.
E6AP-опосредованное убиквитинирование PML
E6AP является членом-основателем убиквитинлигаз семейства HECT [38], в которых убиквитин ковалентно связывается с доменом HECT перед переносом на субстраты [39]. E6AP частично локализован в PML-NB и физически связан с PML.В соответствии с этими особенностями, E6AP способствует убиквитинированию и протеасомной деградации PML. Физиологическая роль E6AP в деградации PML подчеркивается обнаружением того факта, что несколько органов E6AP нулевых мышей обнаруживают повышенный уровень белка PML. Повышенный уровень белка PML и PML-NB также очевиден в эмбриональных фибробластах мыши с дефицитом E6AP. Более того, лимфоидные клетки, полученные от таких мышей, накапливают белок PML в ответ на повреждение ДНК и более восприимчивы к гибели, вызванной повреждением ДНК, что подразумевает роль этой деградации PML в ответе клеток на генотоксический стресс [40].Более прямые доказательства функции E6AP-опосредованной деградации PML в онкогенезе получены из исследования Myc-индуцированного B-клеточного лимфомагенеза. Трансгенные мыши E μ -myc представляют собой хорошо зарекомендовавшую себя модель развития пре-B / B лимфомы [41,42]. Важно отметить, что потеря одного аллеля E6AP задерживает начало Myc-индуцированной пре-B / B-клеточной лимфомы и снижает опухолевую нагрузку. Механически подавление лимфомагенеза за счет гетерозиготности E6AP объясняется повышенным старением клеток пре-B / B лимфомы, о чем свидетельствует повышенная экспрессия маркеров старения SA-β-Gal, p16, p21 и маркера SAHF h4K9me3.В соответствии с ролью E6AP в деградации PML, клетки лимфомы и предраковые B-лимфоидные клетки, происходящие от мышей E μ -myc / E6AP +/- , демонстрируют повышенные уровни PML и PML-NB по сравнению с мышами. клетки, полученные от мышей E μ -myc . Важно отметить, что потеря одного или обоих аллелей PML значительно ускоряет развитие лимфомы в модели мышей E μ -myc , подтверждая вклад повышения уровня PML в подавление лимфомагенеза, наблюдаемого в E μ -myc / E6AP +/- мышей.Клинически повышенная экспрессия E6AP наблюдается в образцах лимфомы Беркитта человека и в ряде клеточных линий B-лимфомы, и эта повышенная экспрессия E6AP связана с подавлением PML [43]. Таким образом, E6AP-опосредованное убиквитинирование и деградация PML усиливают лимфомагенез за счет ингибирования клеточного старения, а повышенная экспрессия E6AP, вероятно, частично способствует подавлению PML в B-клеточных лимфомах.
Казеинкиназа 2 (СК2) -зависимое убиквитинирование ПМЛ
Помимо CDK1 / 2, другие киназы также могут влиять на убиквитинирование ПМЛ и протеасомную деградацию.Одной из таких киназ является CK2, серин / треониновая киназа с онкогенным потенциалом [44]. CK2 фосфорилирует PML по множеству сайтов. Среди них S517 (S565 в PML-I) является первичным остатком фосфорилирования и находится внутри дегрона PML. Известно, что CK2 активируется p38MAPK во время клеточного стресса. В соответствии с ролью CK2 в деградации PML, несколько стрессовых состояний, которые активируют CK2, такие как осмотический шок и УФ-облучение, потенцируют протеасомную деградацию PML. Ингибирование p38MAPK или CK2 отменяет вызванную стрессом деградацию PML.Более того, убиквитинирование PML стимулируется сигналом активации CK2 (т.е. осмотическим шоком) или введением мутанта PML, который имитирует событие фосфорилирования CK2 [8]. Эти наблюдения приводят к гипотезе, что фосфорилирование CK2 запускает убиквитинирование PML посредством неидентифицированной убиквитинлигазы. Интересно, что остатки фосфорилирования CK2 находятся в пределах расширенного SIM и фосфорилирование этих остатков влияет на связывание PML с сумоилированными белками [45,46]. Значение CK2-зависимой деградации PML в биологии рака подчеркивается открытием, что фосфомиметический мутант PML действует как супрессор опухоли из-за его длительного периода полужизни.Этот мутант вызывает более сильное старение и апоптотические эффекты в клеточных анализах и более сильную функцию подавления опухоли в модели ксенотрансплантата по сравнению с ПМЛ дикого типа. При раке человека аберрантная активация CK2 обнаруживается в подмножестве клеточных линий немелкоклеточного рака легкого (NSCLC) и в образцах пациентов, что коррелирует со снижением уровня белка PML [8,47]. Таким образом, CK2-зависимый путь деградации PML, вероятно, не регулируется при NSCLC, чтобы влиять на развитие и прогрессирование опухоли.
ERK2-зависимая протеасомная деградация PML
ERK2 — еще одна киназа PML, которая стимулирует протеасомную деградацию PML. ERK2 частично локализуется в PML-NBs и фосфорилирует PML по S403 и S505 [48]. Подобно CDK1 / 2-индуцированному фосфорилированию PML, фосфорилирование PML с помощью ERK2 облегчает рекрутирование Pin1, который способствует протеасомной деградации PML [49]. Поскольку деградация белка через протеасомы в основном опосредована убиквитинированием, PML, модифицированный ERK2 и Pin1, вероятно, привлекает неидентифицированную лигазу E3 для своего убиквитинирования.Активность ERK2 стимулируется множеством факторов роста, включая EGF. Соответственно, EGF увеличивает деградацию PML посредством ERK2- и Pin1-зависимым образом [48]. Учитывая частую активацию ERK2 при различных типах рака человека, ось ERK2 / PML может вносить вклад в деградацию PML при некоторых видах рака.
Нацеливание на путь убиквитинирования ПМЛ в качестве противораковых стратегий
При рассмотрении плейотропных функций ПМЛ в подавлении опухоли и его частой деградации при различных типах рака, нацеливание на путь убиквитинирования / деградации ПМЛ становится привлекательным подходом для противораковой терапии .Теоретически можно использовать несколько подходов для скрининга низкомолекулярных ингибиторов, которые блокируют пути убиквитинирования PML. Первый направлен на лигазу убиквитина E3. Следует отметить, что для выявления ингибиторов лигаз E3 был разработан ряд высокопроизводительных методов скрининга [50]. Для мульти-субъединичных лигаз E3 стратегия скрининга может быть разработана для нарушения взаимодействия между субъединицами. Второй подход заключается в скрининге низкомолекулярных ингибиторов, которые нарушают взаимодействие PML с его лигазами E3.Наконец, поскольку посттрансляционные модификации PML, такие как фосфорилирование и сумоилирование, часто требуются для последующих событий убиквитинирования, нацеливание на такие процессы посттрансляционной модификации (например, путем введения ингибитора киназы) также может предотвратить убиквитинирование PML. В соответствии с этим представлением, ингибитор CK2 эмодин подавляет рост опухоли в модели ксенотрансплантата, и этот эффект зависит от присутствия остатка фосфорилирования CK2 на PML [8]. Ингибитор E3-лигазы семейства Cullin MLN4924, который ингибирует недилирование Cullin путем нацеливания на активирующий фермент NEDD8, оказывает сильное противоопухолевое действие [51].Было бы интересно проверить, снижает ли MLN4924 прогрессирование рака простаты, вызванное KLHL20-опосредованной деградацией PML. Важно отметить, что в последнее время появились доказательства того, что деградация ПМЛ в опухолях регулируется множеством путей, а различные типы рака, вероятно, используют разные механизмы для регулирования стабильности ПМЛ. Таким образом, полное понимание механизмов убиквитинирования ПМЛ при различных типах рака и клеточных состояниях может помочь в разработке и выборе специфических противораковых стратегий для лечения онкологических пациентов, демонстрирующих аберрантную деградацию ПМЛ.
Сокращения
APL, острый промиелоцитарный лейкоз; ATO, триоксид мышьяка; СК2, казеинкиназа 2; IP3R, инозитол-1,4,5-трифосфатный рецептор; ПМЛ, промиелоцитарный лейкоз; PML-NBs,: PML-ядерные тела; RBCC, Ring, B-box и спиральная катушка; SAHF — ассоциированные со старением гетерохроматиновые фокусы; SIM, мотивы, взаимодействующие с SUMO; STUbLs, SUMO нацелены на убиквитинлигазы.
Двойной функциональный комплекс рутения-арена вызывает дифференцировку и апоптоз клеток острого промиелоцитарного лейкоза
Острый промиелоцитарный лейкоз человека (ОППЛ) является наиболее злокачественной формой острого лейкоза.Слияние генов PML и RARα является причиной более 98% случаев APL. В этой работе мы обнаружили, что ареновый комплекс Ru ( II ), [(η 6 — p -bip) Ru (en) Cl] [PF 6 ] ( Ru- 1 ), может избирательно реагировать с PML, что приводит к высвобождению цинка и разворачиванию белка. Следовательно, происходит деградация слитого белка PML – RARα, который вызывает дифференцировку клеток APL. Кроме того, Ru-1 также может связываться с ДНК и запускать апоптоз клеток APL.Следовательно, Ru-1 действует как двойной функциональный агент, который подавляет рост клеток APL и индуцирует дифференцировку клеток. Напротив, другое неселективное соединение Ru ( II ), хотя также имеет высокую реактивность по отношению к PML, не проявляет активности против APL. Селективность Ru-1 к PML предполагает новую стратегию разработки препаратов против APL с использованием рутениевых агентов.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?Amazon.co.jp: puramo-ru (Кабель VVF для торгового центра) PML — 2 K, черный (# # # # 1 м Упаковка из 10 шт .: Industrial & Scientific
| Цена: | 1 605 иен (160 ¥ / Шт.) |
- Соответствовать
- 5 x кабель LAN (utp0.4П — 2 ядра)
- VVF (1 ядро / 2,6 x 2,0 x C — C — 1 ядро)
- цвет черный
- Кол-во 10 шт.
Характеристики этого продукта
| Фирменное наименование | 未来 工業 (МИРАЙ) |
|---|---|
| Вес изделия | 500 грамм |
| Количество позиций | 10 |
| Номер детали | pml-2k |
Время и частота от А до Я, Re до Ru
Воспроизводимость
Способность устройства или измерения многократно и без корректировок выдавать одно и то же значение или результат при одинаковых входных условиях и работе в одинаковых условиях.
Разрешение
Степень, с которой можно определить измерение. Например, если счетчик временных интервалов имеет разрешение 10 нс, он может выдавать показание 3340 или 3350 нс, но не 3345 нс. Это связано с тем, что 10 нс — это наименьшая значимая разница, которую может измерить прибор. Любое более точное измерение потребует большего разрешения. В спецификации инструмента обычно указывается разрешение одного измерения, иногда называемое разрешением одного снимка.Часто можно улучшить разрешение одиночного снимка путем усреднения, но разрешение может ограничить неопределенность измерения.
Частота резонанса
Собственная частота генератора. Резонансная частота обычно либо делится, либо умножается для получения выходной частоты генератора. В таблице ниже показаны резонансные частоты для нескольких типов генераторов. Высокая резонансная частота приводит к более высокой добротности и в целом улучшает стабильность.
