Где применяют электролиз
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т.
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
- Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента.
 Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды h3O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются — выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Примеси анода не растворяются — выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора — сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).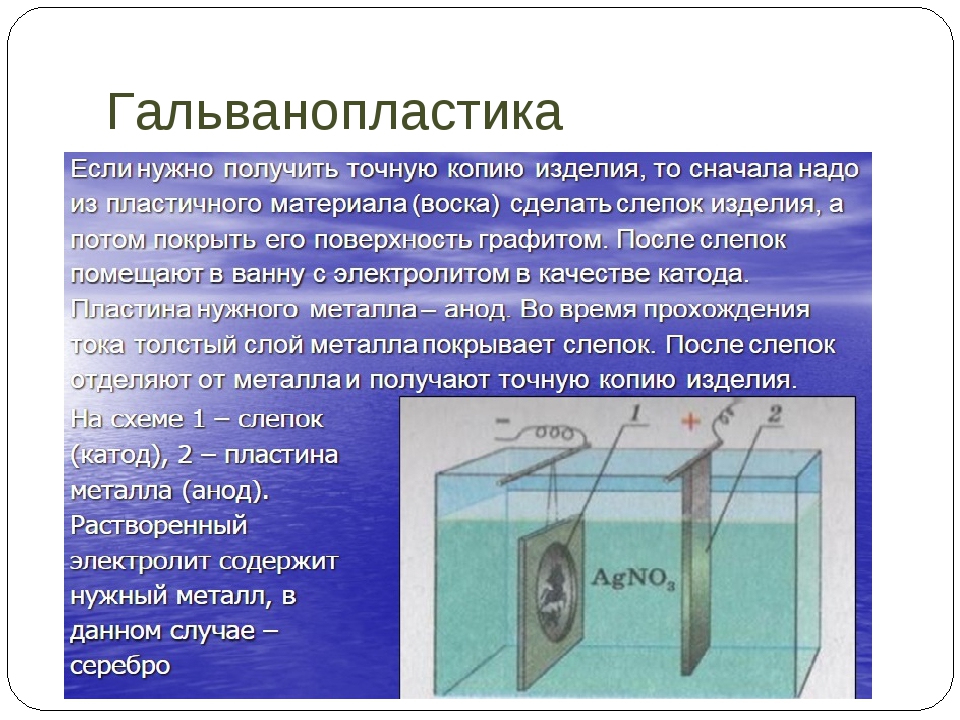
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика — осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.
Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.Лимонная батарейка (для увеличения нажмите нажмите на картинку)
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Ранее ЭлектроВести писали, что в недавнем докладе Cleantech Group авторы рассказали о трех самых важных для энергетики ближайших лет технологиях. Журналисты Business Insider обсудили их с Луисом Брасингтоном, одним из аналитиков компании.
По материалам: electrik.info.
Электролиз | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Раздел: Электрохимия
Открытие электролиза стало возможным после изобретения Вольтом батареи гальванических элементов (1799). Уже в 1800 г. английские исследователи Никольсон и Карлейль открыли электролиз: они установили, что при прохождении постоянного тока в воде или водных растворах вода распадается на водород и кислород. Более поздние исследования были завершены в 1833 г. Майклом Фарадеем в виде законов. Ионы, образующие ток в электролитах (рис. 7.16), имеют названия:
Майклом Фарадеем в виде законов. Ионы, образующие ток в электролитах (рис. 7.16), имеют названия:
Анионы (гр. — восходящий) — отрицательно заряженные ионы, движущиеся к аноду;
Катионы (идущие книзу) — положительно заряженные ионы, движущиеся к катоду.
При прохождении тока через электролит ионы подходят к электродам, где могут; выделяться на электродах, нейтрализоваться на них, вступать во вторичные реакции с электродами или же с растворителем. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
В упрощенном понимании:
выделение на электродах составных электролита при прохождении тока в нем называется электролизом.
| Рис. 7.16. Ток в электролитах |
Рассмотрим примеры:
а)
- Электролит — водный раствор HCl.

- Диссоциация: HCl ⇆ H+ + Cl—.
- Анод: 2Cl— — 2e— → Cl2.
- Катод: 2H+ + 2e— → H2.
Здесь расходуется растворенное вещество, а на электродах выделяются газообразные водород и хлор. Вторичных реакций нет.
б)
- Водный раствор H2SO4.
- Диссоциация: H2SO4 ⇆ 2H+ + SO2-4; H2O ⇆ H+ + OH—.
- Анод: 4OH— — 4e— → 2H2O + O2.
- Катод: 2H+ + 2e— → H2.
- В растворе остается: SO2-4 + 2H+ → H2SO4. Материал с сайта http://worldofschool.ru
Эта реакция происходит, если электроды изготовлены из платины или никеля. Кислород выделяется на аноде.
Кислород выделяется на аноде.
в)
- Электроды медные. Водный раствор CuSO4.
- Диссоциация: CuSO4 ⇆ Cu2+ + SO2-4; H2O ⇆ H+ + OH—.
- Катод: Cu2+ + 2e— → Cu0 — выделяется на катоде.
- Анод: 4OH— — 4e— → 2H2O + O2 — кислород выделяется на аноде.
Анод растворяется, а медь выделяется на катоде.
На этой странице материал по темам:Электролиз физика формулы
Знак и величину заряда иона обозначают правым верхним индексом.
Электролиз физика
Как применяется электролиз кратко
Что называется электролизом?
Законы электролиза Фарадея • Джеймс Трефил, энциклопедия «Двести законов мироздания»
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку.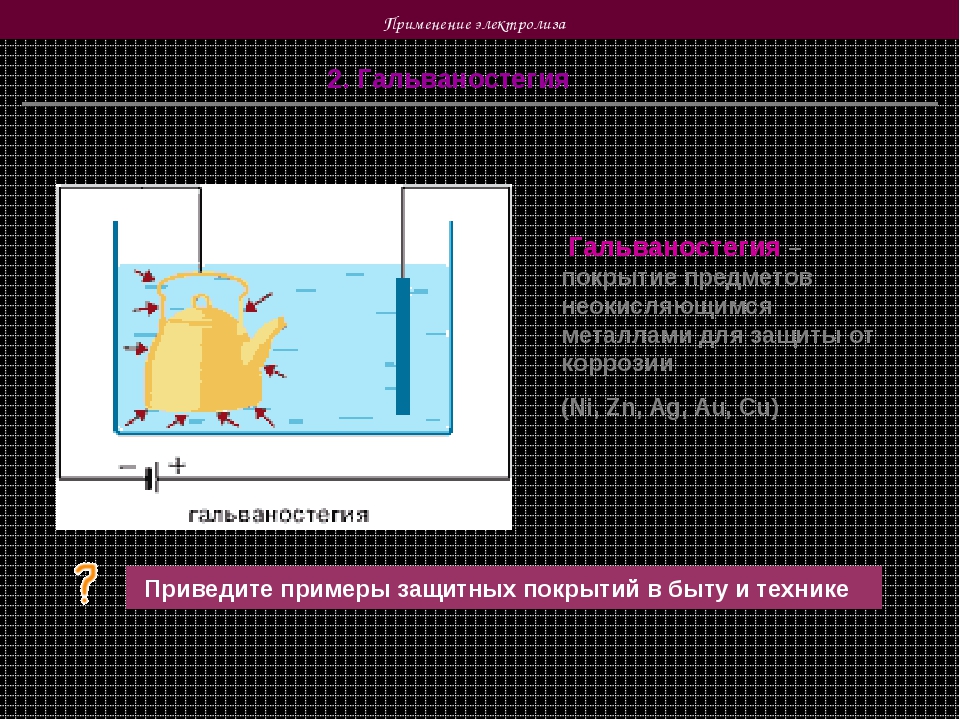
При прохождении через электролит одного и того же количества электричества масса превращенного вещества зависит от массы и заряда ионов вещества.
Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит — плавленое ионное вещество (например, плавленая соль) или раствор, в котором присутствуют ионы. Электрический ток проходит через электролит от одного электрода к другому. Положительно заряженные ионы при этом движутся к отрицательному электроду, катоду, а отрицательно заряженные — к положительному электроду, аноду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений.
Электролиз — это важный промышленный процесс, используемый как при получении определенных металлов, так и при конечной обработке поверхностей методом нанесения гальванического покрытия. Примером электролиза в действии может быть электролитическое рафинирование меди после ее выделения из руды. Выступающие в качестве катода тонкие листы чистой меди опускают в электролит, содержащий раствор сульфата меди и серную кислоту, а слитки неочищенной меди подвешивают в этом же растворе, и они действуют как анод. При пропускании электрического тока анод начинает растворяться, и ионы меди, вместе с некоторым количеством ионов железа и цинка, поступают в электролит. Остальные спутники меди, содержавшиеся в слитках (включая значительное количество серебра, золота и платины), выпадают в осадок и накапливаются на дне электролитической ванны. Ионы меди через электролит направляются к катоду и осаждаются на нем. Цинк и железо остаются в растворе.
В промышленных масштабах в подобных ваннах за месяц можно очистить всего несколько тонн меди, но при этом получается продукт 99,96-процентной чистоты. Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
В описанном выше процессе рафинирования меди атом меди переходит в электролит в виде иона, теряя два электрона. Следовательно, на аноде он принимает два электрона, и ион снова превращается в нейтральный атом меди (можно представить себе, что эти два электрона бегут по проводу, как электрический ток). Согласно первому закону Фарадея, для того чтобы очистить в два раза больше меди, необходимо в два раза больше электронов.
Что такое электролиз в физике (если возможно, пожалуйста, кратко)чтобы запомнилось
Тело было выпущено вертикально вверх со скоростью 30 м / с. К моменту съемки, что Будет ли его скорость на высоте 15 м / с? Равно 0
Какую максимальную скорость может дать сжатая пружина с потенциальной энергией 40 Дж? 500 грамм на массу тела?
Каково центростремительное ускорение тела, движущегося по окружности, радиусом 50 дм со скоростью 10 м/сек?
со скольки километров надо сбросить 1000 кг чтобы разогнать его до скорости звука?
Камень какого веса и массы способен поднять мальчик на Луне , если на Земле он может поднять камень весом 160 Н ? gз=10 м/с^2 , gл=1,6 м/с^2?
распишите пожалуйста решение, очень нужно
Сколько электронов действует на заряд , помещённых в однородное поле напряжённостью 20000 Н/Кл по действием силы 0. 32 нН (Ответ выразите в степени 5)*
…
А)1
В)8
С)32
В)16
32 нН (Ответ выразите в степени 5)*
…
А)1
В)8
С)32
В)16
Даю 50 балов!!!! Срочно!!!!2. Пористе тіло тваринного походження, яке між волокнами містить повітря, а тому мас погану теплопровідність. 4. Тверда реч … овина, що має питому теплоту плавлення 0,59-10 Дж/кг 5. Тверда речовина, що мае температуру плавлення 1200° С 11. Наочний спосіб показу залежності між двома фізичними велининами 12 Загальна назва машин, що перетворюють певний вид енергії в механічну енергію 13. Спосіб змiни внутрішньої енергії тiла без виконання роботи над тілом або самим 16. Прилад, що використовують у багатьох дослідах при вивченні теплових явищ, тiлом основна частина якого-дві посудини різних розмірів 17. Паливо, що мае питому теплоту згорання 4,6-10 Дж/кг 18. Явище перетворення рідини в твердий стан 19. Кристалічне тверде тіло, що має температуру кристалізації 0°С 20. Маленька частинка твердого тіла, що має правильну геометричну форму 21. Метал, що має питому теплоємність 140 Дж/кг К і температуру плавлення 327°С
Источник напряжения в виде аккумулятора имеет напряжение без нагрузки 4,2 В. Какое внутреннее сопротивление напряжение имеет этот аккумулятор, если пр
… и подключении нагрузки, потребляющей ток 0,5 А, напряжение на аккумуляторе составляет 4 В?
Какое внутреннее сопротивление напряжение имеет этот аккумулятор, если пр
… и подключении нагрузки, потребляющей ток 0,5 А, напряжение на аккумуляторе составляет 4 В?
З дна озера піднімають бетонну балку розмірами : довжина 40см, висота 50 см, ширина 75 см. Яку мінімальну роботу потрібно при цьому виконати, якщо гли … бина озера дорівнює 12 м? Опором води знехтуйте. Пожалуйста!!! Срочно!!!
Конспект урока «Электрический ток в электролитах. Законы электролиза Фарадея»
Урок физики в 10 классе на тему: «Электрический ток в электролитах. Законы электролиза Фарадея»
Цель: способствовать формированию у учащихся знаний о природе электрического тока в растворах электролитов, понимать суть законов Фарадея, знать области практического применения электролиза. Развивать логическое мышление, самостоятельность, творческие способности и познавательный интерес учащихся, формировать умения излагать мысли. Воспитывать внимательность, на примере биографии Фарадея воспитывать трудолюбие, усердие в учебе, настойчивость.
Воспитывать внимательность, на примере биографии Фарадея воспитывать трудолюбие, усердие в учебе, настойчивость.
Оборудование: электролитическая ванна, стаканы с растворами сахара, поваренной соли и чистой водой, амперметр, источник тока, лампочка, соединительные провода, мультимедийный проектор, экран, видеоролики «Биография Фарадея» и «Электролиз хлорида меди», презентация «Применение электролиза».
Методы обучения: частично-поисковый, проблемный, экспериментальный.
Методы контроля: устный, письменный, тесты.
Формы работы: индивидуальная, групповая, фронтальная, Т.С.О., компьютерная поддержка.
Ход урока.
- Организационный момент. Вступление.
Учитель: сегодня у нас необычный урок. Мы проведем его в виде подготовки исследовательской работы в творческой мастерской. В конце урока мы увидим результаты нашего сотрудничества и сотворчества.
Мы проведем его в виде подготовки исследовательской работы в творческой мастерской. В конце урока мы увидим результаты нашего сотрудничества и сотворчества.
На этом уроке для объяснения законов природы мы объединим две науки – физику и химию.
У вас имеются опорные конспекты. Прочитайте тему урока.
«Электрический ток в электролитах. Законы электролиза Фарадея»
Давайте поставим цели нашего исследования: в ходе урока мы совершим экскурс в историю, рассмотрим сущность процесса электролиза с точки зрения химии, изучим законы электролиза Фарадея и выполним физический эксперимент (фронтально), познакомимся с практическим использованием электролиза, в тестовой форме проверим уровень усвоения вами полученной информации.
В начале выполнения исследования необходимо показать его актуальность.
Сегодня я принесла вам физическое тело – ложку. Что можете о ней сказать? (она позолоченная: изготовлена из некоего металла и покрыта слоем другого металла). Выяснить, как осуществляется этот процесс, нам и предстоит сегодня.
- Актуализация знаний.
Согласно теме нашей работы, мы узнает что-то новое о токе, познакомимся с характеристиками тока в электролитах. Но вначале вспомним, что мы знаем об электрическом токе.
Задание 1. Продолжи предложения:
- Электрический ток – это…
- Что необходимо для существования тока?
- Какие частицы являются носителями заряда в металлах?
- Как изменяется сопротивление металлов с увеличением температуры?
- Сопровождается ли прохождение электрического тока в металлах переносом вещества?
Сверим ответы.
- Изучение нового материала.
Для того чтобы наша работа была эффективной разделимся на группы: «Историки»,
«Экспериментаторы», «Исследователи», «Теоретики» и «Практики».
«Историки» представляют свой видеоролик «Биография Фарадея».
«Экспериментаторы» демонстрируют явление электролиза.
«Исследователи» сообщают теоретические сведения о процессе электролиза.
«Теоретики» выводят теоретически первый закон электролиза Фарадея: m = k I t и знакомят со вторым законом электролиза.
«Практики» представляют сообщение о применении электролиза.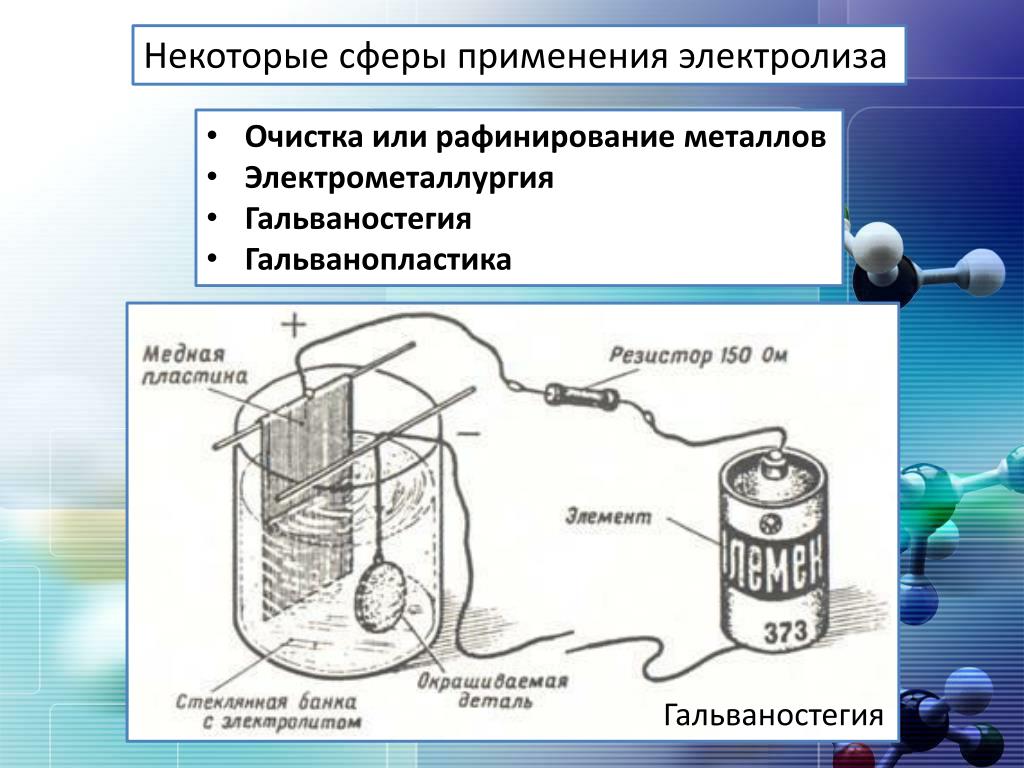
(работа в группах 5 минут, задания группам выдаются учителем).
Учитель: работа в группах закончена, слушаем сообщения каждой группы.
Первый закон электролиза был экспериментально установлен, а второй закон был сформулирован английским ученым Майклом Фарадеем. Его имя нам с вами известно как открывателя изученного недавно явления….. (электромагнитной индукции).
«Историки» подобрали информацию о Фарадее и приготовили видеоролик. Давайте его посмотрим.
«Экспериментаторы» предлагают вашему вниманию следующий опыт.
Оборудование: стакан с чистой водой.
В эту воду помещаем два проводника, которые подключим к источнику тока. Положительно заряженный электрод называется анодом, отрицательно заряженный – катодом. В цепь включим лампочку и ключ. При замыкании ключа лампочка не загорится. Вывод: электрического тока в цепи нет. Следовательно, химически чистая (дистиллированная) вода является диэлектриком.
В цепь включим лампочку и ключ. При замыкании ключа лампочка не загорится. Вывод: электрического тока в цепи нет. Следовательно, химически чистая (дистиллированная) вода является диэлектриком.
Если мы в эту же ванну поместим сахар, лампочка снова не загорается – тока в цепи нет!
При добавлении поваренной соли (NaCl) лампочка загорится. Вывод: в растворе протекает электрический ток.
Этот опыт демонстрирует явление электролиза.
«Исследователи». Теоретические сведения, знакомые вам из химии, представят учащиеся этой группы.
Электролиз был открыт в 1800 году англичанами Николсоном и Карлайлом, они разложили воду на водород и кислород, а исследовал электролиз английский физик Майкл Фарадей в 1834 году, он также ввел термины: электроды, анод, катод, электролиз, электролиты.
Когда в воду попадает молекула поваренной соли NaCl, она распадается на составные части и образуются два иона: положительный ион натрия и отрицательный ион хлора. Под действием электрического поля эти ионы продолжают свое движение в жидкости. Когда положительно заряженный ион натрия подходит к отрицательно заряженному электроду, то он получает свои недостающие электроны, поэтому катод является «восстановителем».
А ион хлора, когда подходит к положительному электроду, отдает электроны, поэтому анод является «окислителем».
“Атомы вещества каким-то образом одарены электрическими силами или связаны с ними, и им они обязаны своими наиболее замечательными качествами” (М. Фарадей)
Задание 2. Природа электрического тока в электролитах.
Электролитами называют…(вещества, растворы или расплавы которых проводят электрический ток)
Химически чистая (дистиллированная) вода является………………. . (диэлектриком)
. (диэлектриком)
Электролитическая диссоциация – это ______________(распад молекул растворяемого вещества на положительные и отрицательные ионы в результате взаимодействия с растворителем (водой).
Степень диссоциации зависит от (температуры, концентрации раствора и электрических свойств вещества).
Ионами называются (атомы или молекулы, потерявшие или присоединившие к себе один или несколько электронов).
Положительные ионы называются (катионами), отрицательные ионы – (анионами).
Электрический ток в электролитах представляет собой (упорядоченное движение положительных и отрицательных ионов).
Электролиз – это………(прохождение электрического тока через жидкости, сопровождающееся выделением на электродах веществ, входящих в состав электролита).
Демонстрация видеоролика «Электролиз хлорида меди».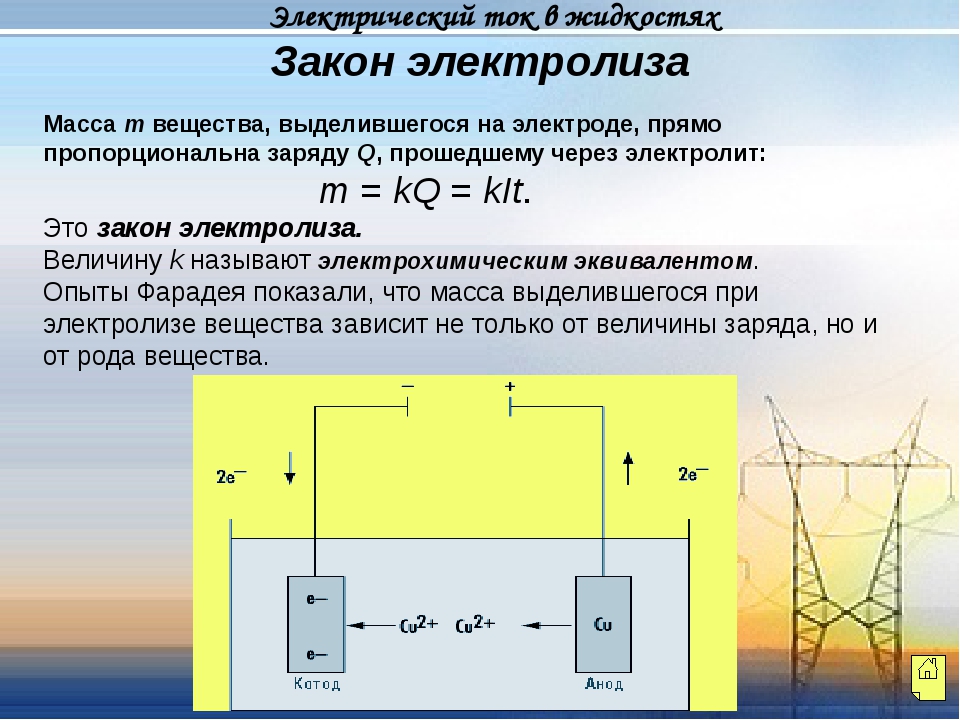
«Теоретики».
Первый закон Фарадея: масса вещества , выделяющегося на электроде, прямо пропорциональна электрическому заряду , прошедшему через электролит: .
Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, которая выделяется при переносе ионами через электролит единичного заряда.
Второй закон Фарадея: электрохимические эквиваленты веществ прямо пропорциональны их химическим эквивалентам: k1/k2=x1/x2.
Здесь – молярная масса вещества, n– валентность. Величина называется постоянной Фарадея, а отношение M/n – химическим эквивалентом.
Законы Фарадея можно объединить выражением: , или .
Из объединенного закона Фарадея следует, что постоянная Фарадея численно равна электрическому заряду, который нужно пропустить через электролит для выделения на электроде массы любого вещества, равной в килограммах отношению (химическому эквиваленту). Значение постоянной Фарадея в СИ: .
Масса иона равна отношению молярной массы к числу Авогадро: . Тогда полная выделившаяся масса вещества равна произведению массы одного иона на число прошедших ионов: .
Учитель: используя данную формулу , в 1874 году было впервые получено значение элементарного электрического заряда, которое было равно e = 1,6 · 10–19Кл.
Но данный закон используется не только для этого, поэтому, давайте заслушаем сообщения о практическом использовании электролиза.
«Практики». Применение электролиза (презентация).
Электролиз широко применяется в технике для различных целей. Электролитическим путем покрывают поверхность одного металла тонким слоем другого – хромирование, никелирование, омеднение. Такие покрытия защищают поверхность от коррозии.
Процесс декоративного или антикоррозийного покрытия металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение, серебрение) называется гальваностегия.
Если электролитическое покрытие будет хорошо отслаиваться от поверхности, на которую осаждается металл, то можем получить копию с рельефной поверхности. В полиграфической промышленности такие копии получают с матриц, на поверхности которых осажден толстый слой железа или другого вещества. Это позволяет получить большое количество копий печатной продукции.
Это позволяет получить большое количество копий печатной продукции.
Гальванопластика – это электролитическое изготовление металлических копий, рельефных предметов. Этот процесс был разработан ученым Б. С. Якоби в 1836 году.
Электрометаллургия – это получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд.
Рафинирование металлов – это очистка металлов от примесей с помощью электролиза, когда неочищенный металл является анодом, а на катоде оседает очищенный.
- Закрепление новых знаний.
«Жизненные» задачи.
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками? (Влага на руках всегда содержит раствор различных солей и является электролитом, поэтому создает хороший контакт между проводами и кожей).
2) Почему для гальванического покрытия изделия чаще используют никель и хром? (большая химическая стойкость, механическая прочность и после полировки дают красивый блеск).
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи? (так как влага на проводах представляет электролит и является проводником, а это может привести к короткому замыканию и пожару).
Решение задач:
- При электролизе раствора сульфата железа (II) за 20 минут выделилось 20 г чистого железа. Сколько выделится этого же вещества за то же время, если силу тока увеличить в 2 раза?
-
Хромирование тонкой прямоугольной пластинки длиной 3 см и шириной 5 см в большой гальванической ванне осуществляется в течение промежутка времени 2 ч при силе тока 1,5 А.
 Определите толщину образовавшегося на пластинке слоя хрома. Плотность хрома 7180 кг/м3.
Определите толщину образовавшегося на пластинке слоя хрома. Плотность хрома 7180 кг/м3.
Электрохимический эквивалент хрома 18*10-8 кг/Кл.
- Через электролитическую ванну, содержащую раствор серной кислоты, в течение промежутка времени 60 мин проходил ток силой 1,2 А. Выделившийся на катоде газообразный водород собран в сосуде вместимостью 350 см3. Определите температуру водорода, если его давление 150 кПа. Электрохимический эквивалент водорода 1,04*10-8 кг/Кл.
- Проверка усвоения знаний (рефлексия). Проверочный тест.
- Какими носителями электрического заряда создается электрический ток в растворах или расплавах электролитов?
A. Только электронами; Б. Электронами и дырками;
B. Только ионами; Г. Электронами и ионами.
Только ионами; Г. Электронами и ионами.
- Как изменится масса вещества, выделившегося на катоде, при прохождении электрического тока через раствор электролита при увеличении силы тока в раза?
A. Не изменится; Б. Увеличится в раза; B. Увеличится в раза.
- В процессе электролиза положительные ионы перенесли на катод за положительный заряд , отрицательные ионы перенесли на анод такой же по модулю отрицательный заряд. Чему равна сила тока в цепи?
А. ; Б. ; В. .
- Какой минимальный заряд может быть перенесен электрическим полем через раствор или расплав электролита?
A. ; Б. ; B. Сколь угодно малый.
-
При измерении электрохимического эквивалента некоторого вещества получили график зависимости массы этого вещества, выделяющегося на электроде, от времени .
 Определите, чему он равен, если при этом сила тока в цепи электролитической ванны была равна .
Определите, чему он равен, если при этом сила тока в цепи электролитической ванны была равна .
А. ; Б. ; В. ; Г. .
ОТВЕТЫ: 1/В; 2/Б; 3/В; 4/А; 5/Б
Учитель: можете выбрать себе домашнее задание той группы, в которой бы вы хотели поработать.
«Историки»: приготовить видеоролик об ученом – физике Борисе Семёновиче Якоби.
«Исследователи»: изучить процесс электролиза меди.
«Теоретики»: проанализировать полученную вами формулу, подумать, для каких еще исследований можно использовать первый закон Фарадея.
«Экспериментаторы»: в клубень картофеля воткните два металлических гвоздя, соедините между собой проволокой. Проволоку подключите к гальванометру. Почему стрелка прибора отклоняется?
Почему стрелка прибора отклоняется?
«Практики»: приготовить видеоролик «Применение электролиза».
Учитель: сегодня мы не только познакомились с электрическим током в жидкостях и электролизом, но и узнали, как широко он применяется. Вы проявили самостоятельность, продемонстрировали свои творческие способности.
А поводом для нашего разговора послужила эта ложка.
ПРИЛОЖЕНИЕ 1.
ОПОРНЫЙ КОНСПЕКТ для учащихся.
«Электрический ток в электролитах. Законы электролиза Фарадея»
Задание 1. Продолжи предложения:
- Электрический ток – это__________________________________________________
- Что необходимо для существования тока? ___________________________________
- Какие частицы являются носителями заряда в металлах? ______________________
- Как изменяется сопротивление металлов с увеличением температуры? __________
- Сопровождается ли прохождение электрического тока в металлах переносом вещества?
Задание 2. Природа электрического тока в электролитах.
Природа электрического тока в электролитах.
Электролитами называют____________________________________________________
__________________________________________________________________________
Химически чистая (дистиллированная) вода является_____________________________
Электролитическая диссоциация – это _________________________________________
Степень диссоциации зависит от ______________________________________________
Ионами называются ________________________________________________________ Положительные ионы называются _____________, отрицательные ионы ____________
Электрический ток в электролитах представляет собой _______________________
__________________________________________________________________________
Электролиз – это ___________________________________________________________
__________________________________________________________________________
Задание 3. Вывод законов электролиза Фарадея.
Вывод законов электролиза Фарадея.
Задание 4. «Жизненные задачи».
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками?
2) Почему для гальванического покрытия изделия чаще используют никель и хром?
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи?
Решение задач.
-
При электролизе раствора сульфата железа (II) за 20 минут выделилось 20 г чистого железа.
 Сколько выделится этого же вещества за то же время, если силу тока увеличить в 2 раза?
Сколько выделится этого же вещества за то же время, если силу тока увеличить в 2 раза?
- Хромирование тонкой прямоугольной пластинки длиной 3 см и шириной 5 см в большой гальванической ванне осуществляется в течение промежутка времени 2 ч при силе тока 1,5 А. Определите толщину образовавшегося на пластинке слоя хрома. Плотность хрома 7180 кг/м3.
Электрохимический эквивалент хрома 18*10-8 кг/Кл.
- Через электролитическую ванну, содержащую раствор серной кислоты, в течение промежутка времени 60 мин проходил ток силой 1,2 А. Выделившийся на катоде газообразный водород собран в сосуде вместимостью 350 см3. Определите температуру водорода, если его давление 150 кПа. Электрохимический эквивалент водорода 1,04*10-8 кг/Кл.
Задание 5. Проверочный тест.
- Какими носителями электрического заряда создается электрический ток в растворах или расплавах электролитов?
A. Только электронами; Б. Электронами и дырками;
Только электронами; Б. Электронами и дырками;
B. Только ионами; Г. Электронами и ионами.
- Как изменится масса вещества, выделившегося на катоде, при прохождении электрического тока через раствор электролита при увеличении силы тока в раза?
A. Не изменится; Б. Увеличится в раза; B. Увеличится в раза.
- В процессе электролиза положительные ионы перенесли на катод за положительный заряд , отрицательные ионы перенесли на анод такой же по модулю отрицательный заряд. Чему равна сила тока в цепи?
А. ; Б. ; В. .
- Какой минимальный заряд может быть перенесен электрическим полем через раствор или расплав электролита?
A. ; Б. ; B. Сколь угодно малый.
; B. Сколь угодно малый.
- При измерении электрохимического эквивалента некоторого вещества получили график зависимости массы этого вещества, выделяющегося на электроде, от времени . Определите, чему он равен, если при этом сила тока в цепи электролитической ванны была равна .
А. ; Б. ; В. ; Г. .
Богданов К.Ю. — учебник по физике для 10 класса
§ 46. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ. ЗАКОН ЭЛЕКТРОЛИЗА ФАРАДЕЯ.
Прохождение тока через электролит сопровождается химическими реакциями на электродах, в результате которых выделяются элементы, входящие в состав электролита.
Жидкости, как и твёрдые тела, могут проводить электрический ток. Если переносчиками тока в жидкости служат ионы, то её проводимость называют ионной, а такую жидкость – электролитом.
Ионы при
растворении вещества появляются из-за того, что ещё до растворения у многих молекул
одна часть обладает избыточным числом электронов, а в другой части их не
хватает.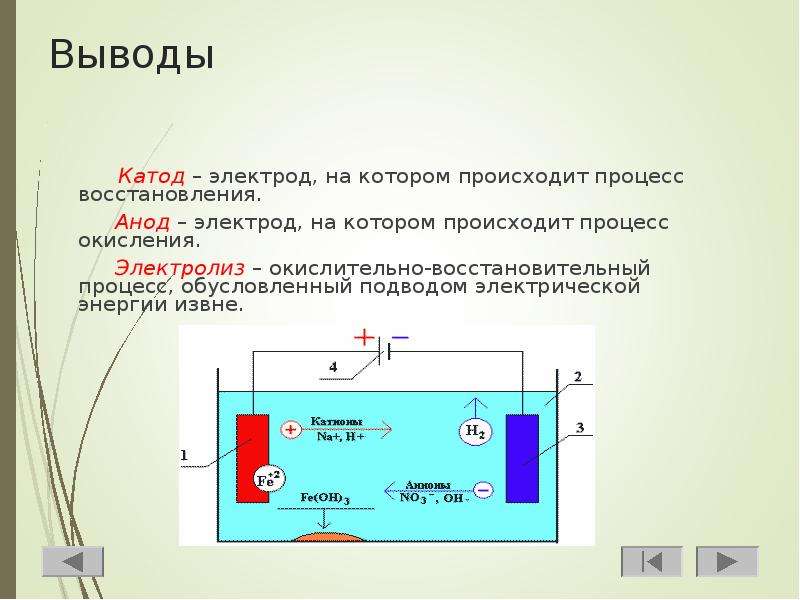 Такая молекула, бывшая до растворения электрически нейтральной, при
растворении распадается (диссоциирует) на два иона, заряженные равными по
модулю, но противоположными по знаку зарядами. Способствуют этому процессу,
названному электролитической диссоциацией, полярные молекулы
растворителя (например, воды), разрывающие на части (ионы) молекулы
растворённого вещества.
Такая молекула, бывшая до растворения электрически нейтральной, при
растворении распадается (диссоциирует) на два иона, заряженные равными по
модулю, но противоположными по знаку зарядами. Способствуют этому процессу,
названному электролитической диссоциацией, полярные молекулы
растворителя (например, воды), разрывающие на части (ионы) молекулы
растворённого вещества.
Одновременно
с электролитической диссоциацией идёт процесс рекомбинации – образование
из ионов нейтральных молекул растворённого вещества. Если условия, в которых
находится электролит, остаются неизменны, то скоро
наступает момент, когда число молекул, распадающихся на ионы в единицу времени,
становится равным числу молекул, образовавшихся из ионов в процессе
рекомбинации. Таким образом, наступает динамическое равновесие между диссоциацией
и рекомбинацией, при котором концентрация ионов остаётся
постоянной. При росте температуры динамическое равновесие смещается в сторону
электролитической диссоциации и концентрация ионов в
электролите растёт.
Положительные и отрицательные ионы в электролите способны перемещаться независимо друг от друга, участвуя, например, в тепловом движении (рис. 46а). Однако при таком беспорядочном движении ионов ток через электролит остаётся равным нулю. Для пропускания тока через электролит в него погружают проводники (рис. 46б), которые называют электродами, создавая с их помощью в электролите электрическое поле. При этом положительный электрод называют анодом, а отрицательный – катодом. Когда между электродами возникает разность потенциалов, движение ионов становится упорядоченным: отрицательные ионы движутся к аноду, а положительные – к катоду.
В отличие от электронной, ионная проводимость
сопровождается, переносом вещества (ионов).
Соприкасаясь с катодом, положительные ионы получают от
него недостающие электроны и становятся электрически нейтральными. При соприкосновении
отрицательных ионов с анодом они теряют лишние электроны и тоже становятся
нейтральными атомами или молекулами. Таким образом, ток, проходя через
электролит, приводит к выделению на электродах веществ, входящих в состав
электролита. Это явление и
сопровождающий его процесс разложения электролита при пропускании
электрического тока называют электролизом.
Таким образом, ток, проходя через
электролит, приводит к выделению на электродах веществ, входящих в состав
электролита. Это явление и
сопровождающий его процесс разложения электролита при пропускании
электрического тока называют электролизом.
Впервые электролиз исследовал М. Фарадей, который экспериментально доказал, что масса, выделяющегося на электроде вещества, пропорциональна величине заряда, протекающего через электролит. Это заключение называют законом электролиза Фарадея, который сейчас можно легко вывести теоретически. Пусть в электролите присутствуют положительные и отрицательные ионы с валентностью n. Тогда заряд каждого положительного иона будет равен ne (e – элементарный заряд). Если при электролизе через электролит прошёл заряд q, то очевидно, что число N положительных ионов, достигших катода равно:
N=q/ne. (46.1)
Каждый из положительных ионов, соприкоснувшись с
катодом, превращается в нейтральную молекулу (или атом). Если молярная масса
вещества, выделяющегося на катоде равна M, то масса mi одной молекулы, ставшей
нейтральной на катоде, равна:
Если молярная масса
вещества, выделяющегося на катоде равна M, то масса mi одной молекулы, ставшей
нейтральной на катоде, равна:
mi =M/NA , (46.2)
где NA — постоянная Авогадро. Из (46.1) и (46.2) следует, что масса m вещества, выделившегося на катоде, равна:
Очевидно, что (46.3) является математической формой записи закона электролиза Фарадея (K – электрохимический эквивалент вещества).
Электролиз широко применяется для очистки металлов от примесей. Таким образом очищают медь и получают алюминий. Кроме того, используя электролиз, можно покрыть металлические предметы тонким слоем другого металла (никелирование, хромирование и т.п.).
Вопросы для повторения:
· Что такое электролитическая диссоциация и электролиз?
·
Сформулируйте закон электролиза Фарадея.
Рис. 46. Хаотичное (а) и упорядоченное движение ионов электролита в электрическом поле (б).
Презентация по физике на тему «ЭЛЕКТРОЛИЗ»
Электролиз — физико-химические процессы, которые происходят на электродах, когда электрический ток проходит через раствор или раствор электролита. Механизм процессов, происходящих на положительном и отрицательном электродах, различен. В ионах реакция электрохимического окисления происходит потому, что ионы, атомы или молекулы отдают электроны. Напротив, электроны добавляются к различным частицам на катоде, и реакции, которые здесь имеют место, представляют собой все реакции восстановления.Электролиз регулируется законами, открытыми английским ученым М. Фарадеем в 1833-1834 гг. Первый закон Фарадея определяется следующим образом: количество вещества, высвобождаемого на электроде М, прямо пропорционально электрическому заряду q, прошедшему через электролит.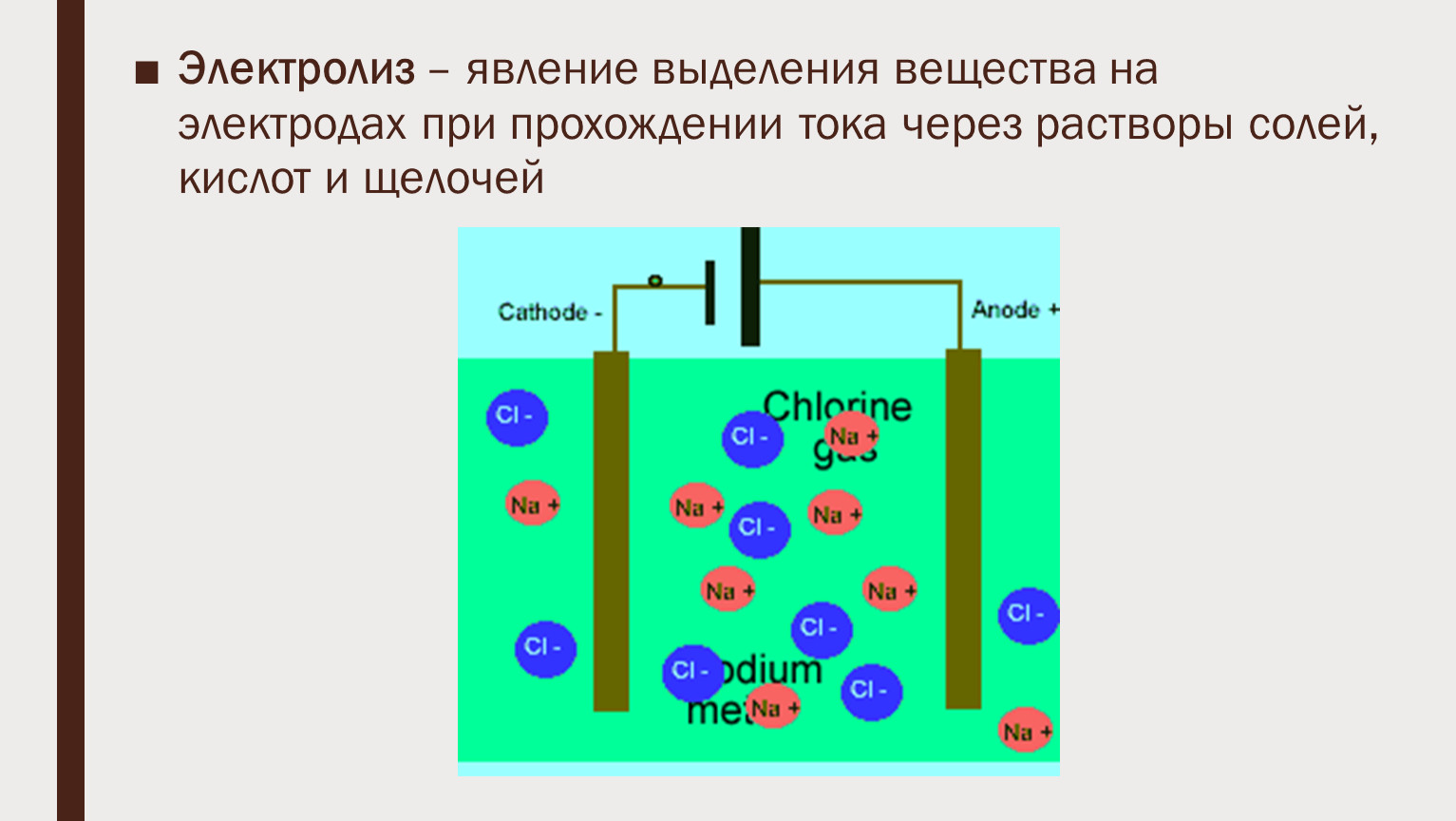
Коэффициент пропорциональности численно равен массе вещества, выделяющегося, когда единица электрического заряда проходит от электролита и называется электрохимическим эквивалентом вещества. Когда постоянный ток I проходит через электролит в момент времени t и происходит.
Согласно второму закону Фарадея, электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам: где отношение атомного веса элемента A к его валентности Z называется химическим эквивалентом. Масса вещества, выраженная в граммах, равна его химическому эквиваленту и называется грамм-эквивалент.
Величина F = 1 / с называется числом Фарадея. Число Фарадея равно электрическому заряду, который должен пройти через электролит, чтобы высвободить 1 грамм эквивалентного вещества на электроде:Величина F равна произведению заряда электрона и числа Авогадро (см. Закон и число Авогадро).
Электролиз — это физико-химический процесс, который отражает сильную связь между физическими и химическими явлениями.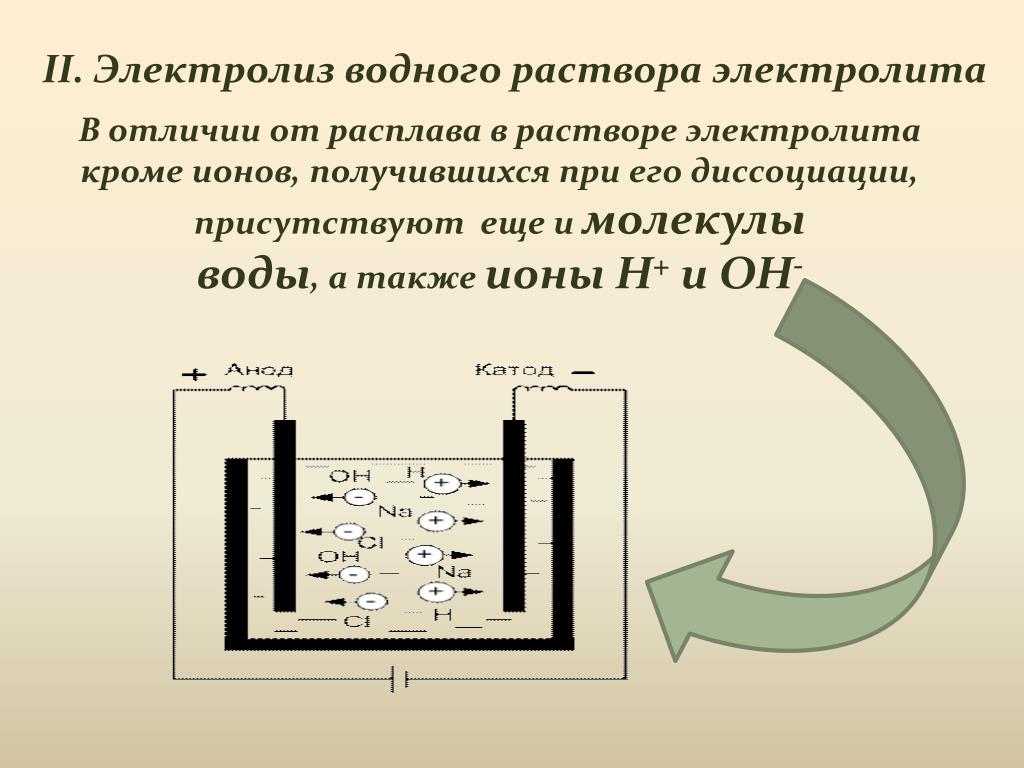 Широко используется на практике. Он используется для получения многих химических соединений, которые трудно получить другими способами — чистых металлов в виде порошков и т. д. Процесс электролиза используется для защиты различных металлов от коррозии. На практике электролиз проводится в специальных устройствах — электролизерах. Они сделаны из стали, керамики, стекла и пластика. Электроды изготавливаются из различных металлов и сплавов. Иногда во время электролиза на аноде и катоде образуются вещества, которых следует избегать, насколько это возможно. Носителями зарядов в водных растворах и расплавах электролитов будут являться ионы. Если сосуд с раствором или расплавом включить в цепь, то положительно заряженные ионы начнут двигаться к катоду К(-), а отрицательные – к аноду А(+). В результате этого движения возникнет электрический ток. Данный вид проводимости называют ионной проводимостью. Помимо ионной проводимости в жидкостях может обладать и электронной проводимостью.
Широко используется на практике. Он используется для получения многих химических соединений, которые трудно получить другими способами — чистых металлов в виде порошков и т. д. Процесс электролиза используется для защиты различных металлов от коррозии. На практике электролиз проводится в специальных устройствах — электролизерах. Они сделаны из стали, керамики, стекла и пластика. Электроды изготавливаются из различных металлов и сплавов. Иногда во время электролиза на аноде и катоде образуются вещества, которых следует избегать, насколько это возможно. Носителями зарядов в водных растворах и расплавах электролитов будут являться ионы. Если сосуд с раствором или расплавом включить в цепь, то положительно заряженные ионы начнут двигаться к катоду К(-), а отрицательные – к аноду А(+). В результате этого движения возникнет электрический ток. Данный вид проводимости называют ионной проводимостью. Помимо ионной проводимости в жидкостях может обладать и электронной проводимостью.
Такой тип проводимости свойственен, например, жидким металлам. Как отмечалось выше, при ионной проводимости прохождение тока связано с переносом вещества.
Степень диссоциации будет зависеть от различных факторов: температура, концентрация раствора, свойства растворителя. При увеличении температуры, степень диссоциации тоже будет увеличиваться.После того как молекулы разделились на ионы, они движутся хаотично. При этом два иона разных знаков могут рекомбинироваться, то есть снова объединиться в нейтральные молекулы.
При отсутствии внешних изменений в растворе должно установиться динамическое равновесие. При нем число молекул которое распалось на ионы за единицу времени, будет равняться числу молекул, которые снова объединятся.
Электролиз: определение, типы и применение — видео и стенограмма урока
Электролитические ячейки
Специально разработанные устройства, называемые электролитическими ячейками , используются для проведения электролиза. Электролитическая ячейка содержит два электрода и раствор с растворенными ионами, называемый электролитами . Также вам понадобится источник электрической энергии, например, аккумулятор.
Электролиз не происходит спонтанно и всегда требует электричества. Когда электроды подключаются к батарее (или другому источнику электроэнергии), один становится положительно заряженным, а другой — отрицательно заряженным.Эти заряженные электроды могут затем вступать в реакцию с ионами электролита.
Тип химической реакции, происходящей в электролитической ячейке, называется окислительно-восстановительной реакцией. Отрицательно заряженный электрод, известный как катод , уменьшает положительные ионы, добавляя к ним электроны, создавая нейтральные атомы.В то же время положительно заряженный электрод, известный как анод , окисляет отрицательные ионы, производя больше свободных электронов. Эти две полуреакции генерируют новые химические вещества, а также замыкают цепь с аккумулятором, чтобы ток продолжал течь через элемент.
- Окисление, половина реакции: X- → X + e-
- Восстановление половины реакции: Y + + e- → Y
Электролиз воды
Чтобы понять процесс электролиза, давайте сначала рассмотрим один из наиболее распространенных и простых электролитических процессов — электролиз воды.В этом процессе молекулы воды (h3 O) расщепляются с образованием как водорода (h3), так и кислорода (O2).
Для проведения электролиза воды вам понадобится электролитическая ячейка с двумя электродами внутри раствора воды с электролитами в ней. Хотя молекулы воды будут диссоциировать на ионы водорода (H +) и гидроксида (OH-), чистая вода не очень хорошо проводит электричество, поэтому вам нужно будет добавить несколько дополнительных ионов, чтобы электролиз стал возможным.
После подключения электродов к батарее ионы H + будут восстанавливаться на катоде с образованием газообразного водорода, а молекулы воды будут окисляться на аноде.Результатом этой окислительно-восстановительной реакции является производство как кислорода, так и водорода.
- Реакция восстановления: 2H + + 2e- → h3
- Реакция окисления: 2 h3 O → O2 + 4 H + + 4 e-
- Общий результат реакции: 2 ч3 O → 2 ч3 + O2
Зачем вам проводить электролиз воды? Водород используется во многих промышленных приложениях, включая производство водородных топливных элементов, и это относительно простой способ его производства.Это также хороший способ получения кислорода, особенно в ситуациях, когда транспортировка большого количества газообразного кислорода не так уж и возможна, как на Международной космической станции. Кислород, которым дышат космонавты на космической станции, создается путем электролиза воды!
Электролиз также обычно используется для извлечения чистых металлов из металлических соединений. Например, металлический натрий можно получить из хлорида натрия (более известного как поваренная соль) с помощью электролиза. Чтобы извлечь металлический натрий, вы должны сначала расплавить хлорид натрия, а затем поместить два электрода в расплавленную соль.Его нужно расплавить, чтобы ионы могли свободно перемещаться. Ионы натрия (Na +) притягиваются к отрицательно заряженному катоду, где они объединяются с электронами с образованием металлического натрия, который осаждается на электроде. На аноде ионы хлора (Cl-) окисляются с образованием свободных электронов и газообразного хлора (Cl2).
Итак, мы имеем следующее:
2NaCl → 2Na + Cl2
Аналогичный процесс можно использовать для извлечения многих различных типов металлов из природных соединений.
Гальваника
Электролиз также можно использовать для покрытия металлических предметов тонким слоем другого металла. Этот процесс называется гальваника . Чтобы гальванизировать один металл с другим, вам понадобятся два металлических электрода. Металл анода будет окисляться, что приведет к его растворению в растворе на ионы металла. Затем эти ионы осаждаются на катодном металле тонким однородным слоем.
Гальваника используется при производстве пенни, которые в основном состоят из цинка с нанесенным сверху тонким слоем меди.Он также обычно используется для покрытия частей автомобилей и приборов хромом для повышения их коррозионной стойкости, а также для покрытия недорогих ювелирных изделий золотом или серебром.
Резюме урока
Хорошо, теперь, когда мы завершаем этот урок, давайте уделим пару минут, чтобы просмотреть важную информацию, которую мы узнали.
Как мы видели здесь, электролиз — это процесс использования электричества для разделения химических соединений, вызывающий протекание химической реакции окисления-восстановления.Для проведения электролиза вам понадобится электролитическая ячейка с двумя электродами, известная как катод , или отрицательно заряженный электрод и анод , или положительно заряженный электрод, электролитический раствор растворенных ионов (называемый электролитами ). проводить электричество между ними и источником электрической энергии, например, батареей. Вам также необходимо расплавить хлорид натрия перед проведением электролиза, чтобы ионы натрия и хлора могли перемещаться и проводить электричество между электродами.
Электролиз можно использовать для производства водорода и кислорода из воды (именно так они производят кислород на Международной космической станции!), Для извлечения чистых металлов из металлических соединений и для гальваники одного металла с другим, что является процесс, при котором электролиз также может использоваться для покрытия металлических предметов тонким слоем другого металла. Мы узнали, что гальваника используется во многих различных областях, от покрытия деталей автомобилей хромом до покрытия грошей медью.
Изобилие электролиза в нашей жизни невозможно переоценить.
Серия классных заданий и упражнения {Physics- SS3}: Electrolysis
Определение электролиза
Электролиз — это процесс, при котором движение электрического тока через раствор освобождает электроны. Химические вещества в контейнере разлагаются для образования тока.
Майкл Фарадей всесторонне изучил этот процесс и заложил основы теории электролиза.Некоторые жидкости являются хорошими проводниками, а другие — плохими проводниками электричества. Хорошие проводники известны как электролиты, плохие проводники не являются электролитами.
Жидкости, такие как растворы кислот, оснований и солей, обычно являются хорошими проводниками. Жидкости, такие как бензол, парафин или керосин, являются плохими проводниками. Органические соединения обычно являются плохими проводниками. Хотя чистая вода также является плохим проводником, вода, содержащая растворенные соли, имеет умеренную проводимость.
Вольтаметр — это устройство для измерения количества электричества, проходящего через проводник, по величине электролитического разложения, которое он производит, или для измерения силы тока по величине такого разложения за заданное время.
- Электролиты — это жидкое или расплавленное вещество, которое проводит ток и разлагается им. т.е. он содержит подвижные ионы и подвергается разложению и называется электролитом, например кислоты, основания, соли и т. д.
- Неэлектролит это вещество, которое в расплавленном состоянии или в растворе не пропускает электрический ток. Таким образом, это вещество, которое не проводит ток и не разлагается, напримерорганические растворители, такие как бензол, парафин, сахар, соль и т. д.
- Электроды — это материалы в форме стержня или пластины, через которые ток входит в электролит или выходит из него. Есть два электрода: (а) положительный электрод, через который ток поступает в электролит, называется анодом. (б) Отрицательный электрод, через который жидкость покидает электролит, называется катодом.
- Анод — это положительный (+ ve) электрод, на который электрон входит, а ток покидает электролит.
- Катод — отрицательный (-ve) электрод, на который электрон входит, а ток выходит из электролита
- Вольтаметр : Все устройство, состоящее из емкости, электролита и электродов, называется вольтаметром.
- Ионы : это заряженные частицы, которые существуют в электролитах и участвуют в электролизе. Это непосредственные продукты разложения электролита. Ионы, которые попадают на анод, называются анионами, те ионы, которые идут на катод, называются катионами .
Текущее электричество
Текущее электричество состоит из быстро движущихся отрицательно заряженных электронов.Токи перемещаются в материале, что позволяет потоку электронов, называемых проводниками. Ток вырабатывается в простой цепи, состоящей из батареи (которая является источником), лампочки (которая является освещением) и нажимного ключа (который используется для управления простой системой).
Ток в батарее из-за приложенной к ней силы. Сила не видна, но создается некоторыми химическими веществами в батарее. Электрическое давление называется напряжением.
Динамика заряженных частиц (ионов) в электролитах
Ионная теория
В электролите есть положительно и отрицательно заряженные частицы, называемые ионами.Молекулы, составляющие электролит, расщепляются в растворе на эти ионы в процессе, известном как электролитическое растворение. Растворение электролита происходит независимо от того, приложено ли к электролиту электрическое поле или нет. Ионы в электролите совершают случайные движения, пока батарея не подключится к электродам вольтметра. Как только п.д. На электродах положительные ионы дрейфуют к катоду с отрицательным потенциалом, а отрицательные ионы дрейфуют к аноду с положительным потенциалом.
Это направленное движение ионов представляет собой электрический ток, протекающий через электролит. Такое движение прекращается, как только аккумулятор отсоединяется, и ионы снова беспорядочно перемещаются.
Таким образом, растворы электролитов могут проводить электричество, потому что электролиты в растворе могут диссоциировать на ионы. Неэлектролиты в растворе не легко диссоциируют на ионы.
Примеры электролиза
Чистая вода — плохой электролит.Поэтому несколько капель серной кислоты помогут увеличить ее проводимость, добавив больше подвижных электронов
Таким образом, теперь в электролите присутствует
ионов. Из серной кислоты: H + и SO 4 2-
Из воды: H + и OH —
Используются инертные электроды, такие как угольные или платиновые электроды, поэтому кислотные растворы не вызывают быстрой коррозии электродов.
На катоде:
H + мигрирует к катоду и принимает электрон, чтобы стать атомом водорода.После этого атомы водорода образуют ковалентную связь с другими атомами водорода, становясь молекулами газообразного водорода
2H + + e — -> H 2
Наблюдение:
Вспышка бесцветного газа без запаха на катоде
На аноде:
SO 4 2- и OH — мигрируют к аноду, где OH — предпочтительно разряжается, так как он занимает более низкое положение в электрохимическом ряду по сравнению с SO 4 2-
4OH — -> 2H 2 O + O 2 + 4e —
Следовательно, общее уравнение:
2H 2 O (л) -> 2H 2 (г) + O 2 (г)
Майкл Законы электролиза Фарадея
Первый закон: Он показывает, что масса (m) вещества, осажденного на катоде во время электролиза, прямо пропорциональна количеству электричества (общий заряд q), проходящему через электролит.
то есть M = ZQ, где Q = It, M = ZIt, Z = M / It, где Z — коэффициент пропорциональности, известный как электрохимический эквивалент (E.C.E.) вещества.
Таким образом, электрохимический эквивалент (ECE) может быть определен как «масса иона, осажденного при пропускании тока в один ампер в течение одной секунды (т.е. при пропускании кулоновского электричества)». Единица измерения — грамм на кулон.
Кулон — единица электрического заряда.
96500 Кулонов электронов = 1 моль электронов.
1 кулон = 6,023 × 1 023 /96500 = 6,85 × 10 18 электронов, или 1 заряд электрона 1,6 × 10 –19 кулон.
Второй закон: Он гласит: «Когда одно и то же количество электричества проходит через разные электролиты, массы различных ионов, высвобождаемых на электродах, прямо пропорциональны их химическим эквивалентам (эквивалентным весам)». т.е.
M 1 / W 2 = E 1 / E 2 или Z 1 I t / Z 2 I t или Z 1 / Z 2 = E 1 / E 2 (∴ W = ZI t )
Таким образом, электрохимический эквивалент (Z) элемента прямо пропорционален его эквивалентному весу (E), т.е.е., E ∝ Z или E = FZ или E = 96500 × Z
где, F = постоянная Фарадея = 96500 Кл моль –1
Итак, 1 Фарадей = 1F = Электрический заряд, переносимый одним мольом электронов.
1F = заряд электрона × число Авогадро.
1F = e — × N = (1,602 × 10 –19 c) × (6,023 × 10 23 моль –1 )
Число Фарадея = число прошедших электронов / 6,023 × 10 23
Закон Фарадея для газообразного электролитического продукта Для газов мы используем V = It Ve / 96500
, где V = объем газа, выделившегося при S.Т. у электрода
Ve = Эквивалентный объем = Объем газа, выделившегося на электроде в S.T.P. на 1 заряд Фарадея
Количественные аспекты электролиза: Мы знаем, что один заряд Фарадея (1F) электричества равен заряду, переносимому одним мольом (6.023 × 10 23 ) электронов. Итак, в любой реакции, если участвует один моль электронов, эта реакция потребляет или производит 1F электричества. Поскольку 1F равен 96 500 кулонам, следовательно, 96 500 кулонов электричества вызовут реакцию с участием одного моля электронов.
Если в какой-либо реакции участвует n моль электронов, то полное электричество (Q), участвующее в реакции, определяется выражением Q = nF = n × 96500 C
Таким образом, количество электричества, участвующего в любой реакции, связано с,
(i) Число молей электронов, участвующих в реакции,
(ii) Количество любого вещества, участвующего в реакции.
Следовательно, 1 Фарадея, или 96 500 C, или 1 моль электронов уменьшится,
(а) 1 моль одновалентного катиона, (б) 1/2 моль двухвалентного катиона,
(c) 1/3 моля трехвалентного катиона, (d) 1 / n моль n-валентного катиона.
Применение электролиза
- Извлечение или выделение металлов: Электролиз — это процесс, используемый для извлечения металлов. Такие элементы обычно очень реактивны, например натрий, калий, хлор, кислород, алюминий и т. д. Такие элементы находятся в верхнем ряду реакционной способности. Они слишком легко реагируют и не могут быть получены электролизом в водном растворе одной из солей. Их получают электролизом их плавленых солей.
- Очистка металлов: многие не находятся в свободном или несвязанном состоянии.Они существуют в сочетании с другими элементами. Чтобы извлечь такие металлы из руд, их необходимо очистить. Общий результат эксперимента состоит в том, что металл переходит из своего нечистого состояния в чистое.
- Гальваника металлов: Гальваника — это процесс покрытия одного вещества слоем другого вещества. Это делается посредством электролиза. Покрываемый объект тщательно очищают, чтобы убедиться, что анодные отложения прочно прилипают. Если это не проводник, его сначала покрывают графитом, чтобы то, что нужно покрыть, прочно приклеилось.Анод — это чистый металл, подлежащий осаждению, а катод — это электролитическая ячейка. Электролит представляет собой раствор растворимой соли и чистого металла, используемого в качестве анода.
Примеры
- Рассчитайте время в минутах, необходимое для того, чтобы покрыть вещество толщиной 300 см 2 , слой меди толщиной 0,6 мм, если поддерживается постоянный ток 2А. Предполагая, что плотность меди составляет 8,8 г / см 3 и один кулон выделяет 0,00033 г меди.
Раствор
Учитывая, что Площадь = 300 см 2 , толщина = 0,6 мм = 0,06 см
Масса = 0,00033 г, плотность = 8,8 г / см 3
Плотность = масса / объем, масса = плотность x объем
Масса = 8,8 x 300 x 0,06 = 158,4 г
Использование M = Zit
T = m / ZI = 158,4 / 2 x 0,00033 = 24000 секунд = 4000 минут
УПРАЖНЕНИЯ
Давайте посмотрим, сколько вы узнали, прикрепите следующие ответы к комментарию ниже
- Найдите массу меди, осажденную на катоде медного вольтаметра, если ток равен 0.53A пропускают через него на 30 минут (e.c.e. меди = 3,3 x 10 -4 gC -1 ) A. 0,465 г B. 0,425 г C. 0,325 г D. 0,315 г
- Рассчитайте время в минутах, необходимое для гальваники изделия площадью 300 см 2 слоем меди толщиной 0,06 см, если поддерживается постоянный ток 2 А. Предполагается, что плотность меди составляет 8,8 г · см -3 и что один кулон выделяет 0,00033 г меди. A. 400 минут B. 4000 минут C. 4500 минут D.5000 минут
- Медный и серебряный вольтаметр соединены последовательно, и в конце периода времени было нанесено 5,0 г меди, рассчитайте массу одновременно нанесенного серебра. Химический эквивалент меди = 31,5. Химический эквивалент серебра = 108. A. 47 г B. 17,14 г C. 20,17 г D. 23 г
- Электрохимический эквивалент металла 0,126 x 10 -6 кгC -1 . Масса металла, которую ток силой 5 А нанесет из подходящей ванны за 1 час, составляет А.0,0378 x 10 -3 кг B. 0,227 x 10 -3 кг C. 0,378 x 10 -3 кг D. 0,595 x 10 -3 кг
- Ионы ……………………………. частицы, которые существуют в электролитах и участвуют в электролизе A. Незаряженный B. Заряженный C. Нейтральный D. Положительный
Подробнее
Фото:
Определение и использование (объяснение на диаграмме)
Электролиз: определение и применение (поясняется схемой)!
При пропускании электричества через электролиты вы могли заметить в них некоторые изменения.Вы также могли заметить пузырьки газа на электродах, а также изменения в металлических электродах.
Все это указывает на то, что при пропускании электрического тока через электролит происходит химическое изменение. Это химическое изменение называется электролизом. Электролит и электроды, используемые при электролизе, образуют электролитическую ячейку.
Когда электричество проходит через электролит, положительные ионы электролита движутся к катоду (отрицательному электроду), где они приобретают электроны, превращаясь в нейтральное вещество.Отрицательные ионы движутся к аноду (положительному электроду) и отдают электроны, чтобы стать нейтральными.
Если нейтральное вещество в своем естественном состоянии представляет собой газ, он выделяется на электроде. Если это металл, он осаждается на катоде. С образованием нейтральных веществ электролит разлагается. Таким образом, мы можем сказать, что разложение электролита при пропускании через него электричества называется электролизом.
Налейте немного воды в пластиковый или стеклянный сосуд.Добавьте в воду щепотку соли или несколько капель кислоты, например уксуса. Это заставит раствор проводить электричество. Взломайте две ячейки и используйте их угольные стержни в качестве электродов.
Поскольку углерод не вступает в реакцию легко, электроды не претерпевают изменений во время электролиза. Поместите электроды в раствор и подключите их к батарее на 6 вольт. Вскоре вы увидите пузырьки газа на электродах. Газ, выделяющийся на катоде, представляет собой водород, а на аноде — кислород.Обратите внимание, что на катоде больше пузырьков.
Химическое изменение, происходящее в этой деятельности, называется электролизом воды, при котором вода разлагается на водород и кислород. Сначала вода расщепляется на ионы водорода (H + ) и гидроксид (OH — ). Они теряют заряд, образуя на электродах водород и кислород.
Полная реакция может быть представлена
Ясно, что выделяемый водород вдвое больше кислорода.Вот почему вы видите больше пузырей на катоде. Вы можете использовать электролиз, чтобы сделать электрическую ручку. Растворите немного йодида калия (KI) в растворе крахмала.
Смочите в этом растворе кусок жесткой бумаги и поместите его на оголенный конец проволоки. Подключите этот провод к отрицательной клемме аккумулятора. Используйте провод, подключенный к положительной клемме аккумулятора, чтобы написать на листе бумаги.
В растворе йодид калия состоит из ионов калия и йодида.
КИ → К + + И —
Когда через раствор пропускается электричество, иодид-ионы теряют свой заряд, образуя йод.
2l — — 2e — → I 2 (на аноде)
Выделяемый йод образует с крахмалом вещество сине-черного цвета, которое действует как «чернила» электрической ручки.
Гальваника :Гальваника — важное применение электролиза.Электрический процесс покрытия недорогого проводника металлом называется гальваникой. Гальваника делается для защиты или украшения.
Например, бамперы автомобилей хромируются для защиты от коррозии. По этой же причине водопроводные краны покрываются никелем или хромом. Утюг, покрытый оловом для предотвращения ржавчины, используется для изготовления «жестяных» банок. «Серебряная» ложка — образец гальваники для украшения.
Для гальваники стальной ложки серебром в качестве электролита используется раствор соли серебра.Ложку и серебряный стержень погружают в электролит и подключают к отрицательной и положительной клеммам батареи соответственно. Положительно заряженные ионы серебра перемещаются к отрицательному электроду (ложке) и образуют на нем серебряный осадок.
Вы можете покрыть гальваническим покрытием пятирупийную монету или угольный стержень медью, используя сульфат меди в качестве электролита. Закрепите металлический зажим на монете в пять рупий и подсоедините его к отрицательной клемме аккумулятора. Подключите положительный полюс аккумулятора к толстому медному проводу.Поместите монету и медную проволоку в раствор сульфата меди. Скоро монета покроется медью.
Раствор сульфата меди состоит из ионов меди и сульфата.
CuSO 4 → Cu 2+ + SO 4 2-
Когда через раствор пропускается электричество, положительно заряженные ионы меди движутся к катоду (монета, подключенная к отрицательной клемме батареи). Там ионы меди приобретают электроны и осаждаются в виде металлической меди.
Cu 2+ + 2e — → Cu
Ионы сульфата остаются в растворе. На медном аноде медь переходит в раствор, отдавая два электрона. Таким образом, прочность раствора остается неизменной.
Cu → Cu 2+ + 2e —
Использование электролиза :1. Электролиз используется для извлечения металлов из руд. Например, когда ток пропускается через расплавленный хлорид натрия, натрий осаждается на катоде, а газообразный хлор выделяется на аноде.Алюминий и калий также извлекаются электролизом.
2. Используется для рафинирования некоторых металлов, таких как медь и цинк.
3. Электролиз используется для производства хлора. На подводных лодках кислород, образующийся при электролизе воды, используется для дыхания.
4. Электролиз используется для гальваники многих вещей, которыми мы пользуемся каждый день.
Эксперимент по электролизу воды — разделение воды
Электролиз — это процесс, при котором электрический ток пропускается через вещество, чтобы повлиять на химические изменения.Химическое изменение происходит, когда вещество теряет электроны (окисление) или приобретает их (восстановление). В двух экспериментах, перечисленных ниже, первое реактивное вещество — вода, а второе — раствор сульфата меди.
Электролиз используется для удаления волос, секущихся соединений, а также в процессе производства для украшения, укрепления и повышения устойчивости металлических поверхностей к ржавчине.
>> Посмотрите это видео, чтобы увидеть гальваническое покрытие медного ключа >>
Эксперимент по электролизу воды и эксперимент по нанесению гальванических покрытий
Электролиз: разделение водыДля этого эксперимента вы можете собрать свои собственные принадлежности или купить полный комплект для электролиза воды.
Требуется наблюдение взрослых.
Что вам понадобится:
Чем вы занимаетесь:
- Наполните химический стакан или стакан теплой водой.
- Осторожно удалите ластики и металлические втулки, чтобы можно было заточить оба конца каждого карандаша. Эти карандаши — ваши электроды . Графит в них проводит электричество, но не растворяется в воде.
- Вырежьте кусок картона, чтобы он поместился над стаканом, затем проделайте два отверстия в центре картона на расстоянии примерно дюйма друг от друга.Просуньте карандаши в отверстия и вставьте их в стакан. Они должны заходить в воду, но не касаться дна стакана. Картон удержит их на месте.
- Подсоедините каждый карандаш к батарее с помощью зажима типа «крокодил», прикрепленного к оголенному графиту (грифель карандаша). Если у вас нет проводов с зажимом типа «крокодил», используйте два куска провода и снимите по 2,5 сантиметра изоляции с каждого конца. Оберните провод вокруг графита каждого карандаша и подключите провода к батарее. Возможно, вам понадобится скотч, чтобы удерживать провода на месте.
Что случилось:
Как только вы подключите провода к батарее, вы увидите пузырьки, появляющиеся вокруг каждого кончика карандаша в воде и плавающие вверх. Эти пузырьки являются компонентами воды — газообразным водородом и кислородом — которые были разделены электричеством, когда оно перемещалось через воду от одного карандаша к другому. Карандаш, прикрепленный к отрицательной клемме батареи, собирает газообразный водород, а карандаш, подключенный к положительной клемме, собирает кислород.Один карандаш набирает больше пузырей, чем другой? Который из? Как вы думаете, почему это так?
(Подсказка: химическое название воды H 2 O, потому что на каждый атом кислорода приходится два атома водорода.)
Дальнейшие эксперименты:
- Попробуйте добавить электролит в воду в стакане. Вода сама по себе не так хорошо проводит электричество, но любой эксперимент с электролизом воды можно ускорить, добавив в воду поваренную соль. Когда это будет сделано, вы должны увидеть изменение скорости образования пузырьков.
Примечание по безопасности : при использовании соли может образовываться небольшое количество газообразного хлора, подобное количеству, присутствующему при использовании отбеливателя.
- Попробуйте разные типы батарей. Можно ли добиться электролиза с 1,5-вольтовой батареей? А если добавить электролит?
- С помощью настоящего электролизного оборудования вы можете собрать два газа в пробирки, чтобы измерить их количество и проверить их различные реакции на пламя.
- Чтобы электролиз работал как возобновляемая энергия, вам необходимо использовать чистый источник энергии для запуска реакции.Проведите этот эксперимент с электролизом снова, используя солнечные элементы вместо батареи.
Гальваника использует форму электролиза, при которой электроды (проводники, обычно металлические) погружаются в раствор электролита и держатся отдельно друг от друга. Затем, используя постоянный ток в качестве источника питания, один из электродов покрывается металлом другого. Гальваникой пользуются ювелиры и производители посуды. Профессиональное гальваническое покрытие требует специальных химикатов и оборудования для создания высококачественного покрытия, но в этом эксперименте с электролизом вы можете попробовать свои силы в простой процедуре, при которой медь будет перенесена на латунный ключ.
Требуется присмотр взрослых и оборудование для химической безопасности.
>> Посмотрите видео о нашем проекте, чтобы увидеть этот проект в действии!
Что вам понадобится:
Чем вы занимаетесь:
- Подготовьте ключ к покрытию медью, очистив его зубной пастой или водой с мылом. Вытрите бумажным полотенцем.
- Размешайте сульфат меди в стакане с горячей водой до тех пор, пока он не перестанет растворяться. Ваш раствор должен быть темно-синим. Дать остыть.
- Используйте один зажим «крокодил», чтобы прикрепить медный электрод к положительной клемме батареи (теперь это анод , ), а другой, чтобы прикрепить ключ к отрицательной клемме (теперь она называется катодом , ).
- Частично подвесьте ключ в растворе, свободно намотав проволочный стержень на карандаш и приложив карандаш к горловине стакана. Зажим «крокодил» не должен касаться раствора.
- Поместите медную полоску в раствор, убедившись, что она не касается клавиши, а уровень раствора ниже зажима из крокодиловой кожи. Теперь электрическая цепь сформирована и течет ток.
- Оставьте схему включенной на 20–30 минут или до тех пор, пока количество меди на ключе вас не удовлетворит.
Что случилось:
Раствор сульфата меди — это электролит, проводящий электричество от одного электрода к другому. При протекании тока на медном аноде происходит окисление , (потеря электронов), в результате чего в раствор добавляются ионы меди. Эти ионы перемещаются по электрическому току к катоду, где происходит уменьшение , (усиление электронов), ионы меди наносятся на ключ. Ионы меди уже присутствовали в растворе сульфата меди до того, как вы начали, но реакция окисления на аноде продолжала заменять их в растворе, поскольку они были нанесены на ключ, поддерживая реакцию.
Этот проект имеет множество переменных, включая чистоту и гладкость ключа, прочность раствора сульфата меди и силу тока. Если на ключе начинает образовываться черная сажистая субстанция, значит, вашего раствора недостаточно для протекания тока. Выньте электроды и добавьте еще медного купороса. Когда вы вставляете их обратно, убедитесь, что анод и катод находятся как можно дальше друг от друга.
Есть много проектов, которые вы можете сделать с гальваникой! Одна интересная идея — использовать плоский кусок латуни в качестве катода и нарисовать на нем рисунок маркером на масляной основе.Медь не склеится там, где находится маркер. После нанесения покрытия вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, проступающий сквозь медь. Если хотите, можете использовать немного полироли для металла, чтобы сделать медь блестящей.
Вы можете попробовать этот простой эксперимент с меднением, в котором не используется электролиз и требуются только бытовые материалы.
Проекты в области возобновляемых источников энергии:Описание процесса электролиза при производстве металлов
Электролиз — это процесс использования электрического тока для индукции химической реакции.Рассматриваемая химическая реакция обычно является реакцией восстановления-окисления, в которой атомы обмениваются электронами и меняют степень окисления. Этот процесс можно использовать для производства металлических твердых частиц, которые используются для гальваники и очистки различных металлов.
Базовая установка электролиза
Электролиз требует двух противоположно заряженных полюсов, называемых катодом и анодом. Катод заряжен отрицательно; это место восстановления положительных ионов. Анод заряжен положительно; это место окисления отрицательных ионов.В электролитической ячейке эти два полюса подключены к внешнему источнику питания. Цепь обычно замыкается солевым раствором, называемым электролитом. При производстве металла электролизом на катоде образуется слой металла.
Природа реакции
В окислительно-восстановительной — или окислительно-восстановительной — реакции два разных элемента обмениваются электронами. В процессе электролиза твердый или расплавленный металл появляется, когда положительно заряженный ион металла приобретает электроны, так что он имеет нейтральный заряд.Положительные ионы металлов присутствуют в растворе электролита. При подаче электрического тока на катод они могут образовывать твердый или расплавленный металл на катоде. Например, при электролитической очистке алюминия ионы алюминия из электролита будут восстанавливаться на катоде, образуя очень чистый алюминий.
Применение электричества
Для производства металла должен быть приложен электрический потенциал. В процессе электролиза этот поток электронов обычно исходит от внешнего постоянного тока.После подачи электрического тока электроны будут перемещаться по внешней цепи, а положительные ионы будут перемещаться в электролите. Затем катод может подвергнуться восстановлению этими электронами и ионами с образованием металла.
Конечная точка гальваники
Процесс гальваники ограничен количеством положительных ионов металла в растворе электролита. Как только все эти ионы будут израсходованы, реакция не сможет продолжаться. Следовательно, металл больше не образуется.Чтобы продолжить образование большего количества металла, вы должны добавить больше положительных ионов металла в раствор электролита.
Электролиз — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Электролитическая ячейка против гальванической ячейки
- Участники и атрибуты
Использование электрического тока для стимуляции неспонтанной реакции.Электролиз можно использовать для разделения вещества на его исходные компоненты / элементы, и именно с помощью этого процесса был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе — электрический ток, направляемый через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания в противном случае несамопроизвольной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорно-щелочной процесс .
Электролитическая ячейка против гальванической ячейки
Пример: когда мы электролизуем воду, пропуская через нее электрический ток, мы можем разделить ее на водород и кислород.
\ [2 H_2O (l) \ rightarrow 2H_2 (g) + O_2 (g) \]
Дополнительная информация: Электролиз воды
Электролитическая ячейка — это, по сути, гальваническая ячейка несамопроизвольной реакции (на самом деле, если мы изменили поток электричества в гальванической ячейке, превысив необходимое напряжение, мы бы создали электролитическую ячейку).Электролитические ячейки состоят из двух электродов (один действует как катод, а второй — как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических элементов должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
| Гальванический | Электролитический |
| Окисление: X → X + + e — (отрицательный анод) | Y → Y + + e — (положительный анод ) |
| Редукция: Y + + e — → Y (положительный катод) | X + + e — → X (отрицательный катод) |
| Всего: X + Y + → X + + Y (G <0) | X + + Y → X + Y + (G> 0) |
| Эта реакция является спонтанной и высвободит энергию | Это реакция несамопроизвольная и будет поглощать энергию |
Участники и авторства
Каковы применения электролиза
Каковы применения электролиза Применение электролизаПроцесс электролиза имеет много важных промышленных применений.Вот некоторые из них:
- Электролиз используется в промышленности для производства многих металлов и неметаллов (например, алюминия, магния, хлора и фтора).
- Электролиз обычно используется для покрытия одного металла другим. Метод покрытия одного металла другим с помощью электрического тока называется гальваникой. Общая установка, используемая для нанесения гальванического покрытия на объект, показана на рисунке.
Метод нанесения гальванических покрытий следующий:- Покрываемый объект выполнен в виде катода.
- Металл, который должен быть нанесен на объект, взят в виде электрода и выполнен в виде анода.
- Электролит содержит растворенные соли металла, на который наносится покрытие.
- Ионы металла (которые заряжены положительно) притягиваются катодом и, следовательно, движутся к объекту и осаждаются на нем.
Гальваника используется для многих целей. Вот несколько примеров.
- Металлы, которые легко подвержены коррозии, защищены покрытием из металла, который не подвержен коррозии.Никель и хром широко используются в автомобильной промышленности для нанесения покрытий.
- Для отделки использовано гальваническое покрытие. Например, столовые приборы, статуи и украшения из более дешевых металлов покрываются дорогими металлами, такими как золото и серебро, чтобы улучшить их внешний вид.
- Гальваника используется при производстве печатных плат (небольшие схемы с компонентами, обычно напечатанными на пластиковой плате), которые используются в телевизорах, компьютерах и т. Д.
Деятельность
Цель: Наблюдать гальваническое покрытие меди на нержавеющей стали.
Необходимые материалы: 20 г сульфата меди, растворенного в 100 мл воды, медная полоска или медный стержень, два провода, батарея (3-5 вольт), химический стакан и предмет для гальваники (ложка из нержавеющей стали или монета) .
Метод:
1. Возьмите раствор медного купороса в стакан.
2. Подключите медную полоску (действует как анод) к положительной клемме аккумулятора с помощью соединительного провода.
3. Аналогичным образом подключите объект, на который будет нанесено гальваническое покрытие (действует как катод), к отрицательной клемме аккумулятора с помощью соединительного провода.
4. Окуните медную полоску и объект, на который нужно наносить гальваническое покрытие, в раствор сульфата меди.
5. Выполняйте гальванизацию в течение 20-25 минут или до образования однородного коричневого налета металлической меди на объекте.
Электролиз используется при рафинировании нечистых металлов. Этот метод, называемый электрорафинированием, можно использовать для очистки металлов, таких как медь, золото и серебро. Вот как проводится очистка меди.
Деятельность
Цель: Наблюдать за осаждением меди с помощью медных электродов и раствора сульфата меди
Необходимые материалы: Аккумулятор, электрические провода, толстая медная полоса, тонкая медная проволока (со снятой оболочкой), медь сульфатный раствор и стеклянный стакан.
