что это такое, применение, сущность, правила, примеры
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.


Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q – заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.


Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:


k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.


При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.


Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов – Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.


При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.


Электроочистка – рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.


Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.


Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
odinelectric.ru
Электролиз обыкновенной воды
В данной статье поговорим про электролиз обыкновенной воды.
Тот, кто не задумываясь, тешит себя роликами с Ютюба, а после этого пытается повторить преподнесённое им на блюдечке, обречён на неудачу. Интернет «кишит» роликами-обманками, и это шоу является частью жизни людей. Кто-то на этом зарабатывает деньги, а кто-то помогает ему зарабатывать деньги, просматривая это шоу. К видеороликам необходимо подходить осторожно. Я, например, знаю, что можно повысить КПД электролизной установки, но я не уверен, действительно ли Мэйер ездил на своем автомобиле на воде? Первое, я себе доказал и теоретически и практически, а второе пока нет.
 Для достаточного количества газа необходимого автомобилю, площадь электродов в ячейке Мэйера слишком мала! Один из загадочных элементов в конструкции автомобиля Мэйера – красный бак, находящийся за креслом водителя. Про него ничего нигде не пишут. В бак вставлены ячейка — «Resonant Cavity», индикатор уровня воды – «water level indicator», и лазерный стимулятор. Всё кроме этого бака, так или иначе, описано, а про бак вообще ничего. Неужели это и есть топливный бак (для воды). Но на видеороликах Мэйер наливает воду непосредственно в ячейку. Это было небольшое отступление от темы статьи, а для Вас — тема для раздумий.
Для достаточного количества газа необходимого автомобилю, площадь электродов в ячейке Мэйера слишком мала! Один из загадочных элементов в конструкции автомобиля Мэйера – красный бак, находящийся за креслом водителя. Про него ничего нигде не пишут. В бак вставлены ячейка — «Resonant Cavity», индикатор уровня воды – «water level indicator», и лазерный стимулятор. Всё кроме этого бака, так или иначе, описано, а про бак вообще ничего. Неужели это и есть топливный бак (для воды). Но на видеороликах Мэйер наливает воду непосредственно в ячейку. Это было небольшое отступление от темы статьи, а для Вас — тема для раздумий.
Мои исследования, прежде всего, направлены не на скорейшее «подключение» электролизной ячейки к автомобилю, а на максимальное повышение её производительности. Цель – уменьшить электролизный ток, или другими словами – затраты энергии, но при этом увеличить объём выхода кислородно-водородной смеси. В ходе моих экспериментальных исследований выявились определённые физические свойства воды, изучив которые и в последующем используя, удалось увеличить производительность обыкновенной электролизной установки в несколько раз. Сначала я начинал эксперименты с установки, собранной из пластин, но в ходе экспериментов пришлось от них отказаться, перейдя на трубки. Пластины, представляли собой несогласованную нагрузку на сверхвысоких частотах. Тяжело было сделать синфазный СВЧ-разветвитель без потери мощности. Самая банальная, но главная проблема – все активные элементы должны были быть равноудалены от специального СВЧ-резонатора на расстояние кратное длине волны, иначе происходило неравномерное выделение газа. Поэтому я вынужден был перейти на трубки.
Для того, чтобы было с чем сравнивать в дальнейшем, последовательность экспериментов началась с обыкновенного электролиза постоянным током. Опыты я проводил на установке изображённой ниже. Электролизную ячейку я наполнял обыкновенной, пропущенной через угольный фильтр водопроводной водой, не используя при этом кислоты и щелочи. Во время эксперимента, из электролизной ячейки, водородно-кислородная смесь поступала в «перевёрнутую» наполненную водой ёмкость 1 объёмом 100 миллилитров. В начале опыта, при включении установки запускался секундомер. Когда ёмкость наполнялась газом и появлялись выходящие из неё во внешнюю ёмкость 2 пузырьки, секундомер останавливался. Для сокращения времени на опыты, были взяты три пары трубок описанных в патентах Мейера длиной 4 дюйма. Общая площадь электролизного активного пространства (площади электродов) составила около 180 см2.

Указанную ёмкость я «наполнял» газом несколько раз при различных токах электролиза. Мной были выбраны токи: 0,25А; 0,5А; 1А; 1,5А; 2А.
При обыкновенном электролизе постоянным током обнаружилось, что с повышением напряжения U на пластинах электролизной установки, происходит нелинейный рост тока I. По предварительному предположению, пузырьки газа должны препятствовать прохождению тока в межэлектродном пространстве, поэтому увеличение напряжения на пластинах должно приводить к увеличению сопротивления водно-газовой смеси по параболическому закону. На самом деле происходило обратное явление.
Сопротивление R , с повышением напряжения резко падало по нелинейному графику – «гиперболе». Ожидалось, что появляющиеся на поверхности электродов пузырьки газов должны препятствовать прохождению электрического тока между электродами. Но на практике, оказалось, что при повышении тока еще на малых его значениях, происходило резкое падение сопротивления, а при токах выше 7-ми ампер, свойства проводимости воды не изменяются – выполняется Закон Ома. Описанное явление поясняется графиками.

Опыты показали, что пузырьки газов не препятствуют току, а наоборот – проводят его. Произведя несложные вычисления расхода электрической мощности P, и сопоставив её с выходом газа V, получился интересный результат. Оказалось, что чем меньше мощность, а конкретнее – ток, тем производительнее установка. Другими словами, затраты электроэнергии на единицу объёма вырабатываемой кислородно-водородной смеси меньше при малых токах, а при повышении тока, растут его паразитные потери. Это показано на следующих графиках.

Безусловно, при большом токе вырабатывается больше газа, ведь мы стремимся к большему количеству газа, но соотношение выхода газа к затраченной мощности резко падает, что снижает КПД установки.
Проводя эксперименты, я заметил, что в начальный момент подачи фиксированного напряжения, ток электролизной установки увеличивается не сразу, а постепенно. Что это за явление? Какой бы ток не прикладывался, вода свой химический состав не изменит. Это же не философский камень: «Из гумна делать золото». Можно было предположить, что вода обладает индуктивными свойствами, но откуда этим свойствам взяться? Другой вариант является наиболее приемлемым – вода, под действием электрического тока изменяет свои электрохимические свойства. Но что изменяется? Неужели молекулы медленно выстраиваются в ряды? Можно долго рассуждать об ориентации и вытягивании молекул, как это объясняет Мэйер, о поверхностной ионизации электродов, как это делает Канарев, но мы не будем этого делать сейчас. В ходе экспериментов я обратил внимание, что пузырьки образуются не только на внутренних поверхностях электродов, но и снаружи (более медленно). Я решил сбить пузырьки ударами по пластиковому корпусу моей электролизной установки. И тут я заметил, что когда я стучал рукояткой отвёртки по корпусу электролизёра, то стрелка амперметра незначительно, но резко отклонялась в меньшую сторону, а через секунду возвращалась на прежнее деление шкалы. Это и стало очередным открытием. Я подключил вместо стрелочного амперметра параллельно соединенные осциллограф и 25-ти ваттный резистор сопротивлением 1 Ом. При ударах по корпусу электролизной установки, на экране осциллографа наблюдалось более резкое падение тока. Оказалось, что в результате тряски, поверхность электродов быстрее освобождалась от пузырьков газа, что приводило к уменьшению паразитного тока снижающего КПД установки. Этот факт и явился решающим в моих дальнейших экспериментах.
Необходимо было создать такое устройство, которое бы «трясло» электролизную установку. На роль трясущего можно рассмотреть кандидатуру пенсионера — нигде не работает, сидит и трясёт, но он занимает определённый объём пространства, его надо кормить, лечить его старые косточки! Выйдет дороже! Поэтому необходимы технические средства.
 На некоторых сайтах встречаются статьи о том, что трубки Мэйера имеют специальные пропилы для настройки в резонанс на звуковых частотах. Пропилы вы видите на рисунке.
На некоторых сайтах встречаются статьи о том, что трубки Мэйера имеют специальные пропилы для настройки в резонанс на звуковых частотах. Пропилы вы видите на рисунке.
Конечно, такой вариант использования звуковых колебаний возможен, но крепление трубок сделано так, что не позволяет трубкам вибрировать. Зная о том, что вода хорошо передает звуковые колебания, проще установить в ёмкости один, например – ультразвуковой резонатор и эффект достигнут. Мной использовался обыкновенный генератор прямоугольных импульсов на ТТЛ-микросхеме и ультразвуковой «пятак». Эксперимент с ультразвуковым резонатором показал незначительное увеличение количества выхода газа, при неизменной затрачиваемой мощности. Характеристика этого процесса показана на графике.

Здесь первый график – отношение объёма выходящего газа V, к электрической мощности P, от самой мощности, затрачиваемой на получение кислородно-водородной смеси без ультразвукового воздействия, а второй график — с ультразвуковым воздействием. Положительный эффект имеется, но не выразительный. На малой мощности (малом токе), ультразвуковое воздействие вообще не влияет на процесс электролиза, а на большой мощности производительность установки в некоторой степени повышается. В идеале, можно предположить, чем сильнее вибрация, тем выше будет график производительности, но для удаления пузырьков газа из межэлектродного пространства всё равно необходимо время.
Один из вариантов, позволяющих удалять пузырьки газа из межэлектродного пространства – обеспечить быструю циркуляцию воды, вымывающую пузырьки кислорода и водорода. Этот способ использует в своих реакторах товарищ Канарёв. А Мэйер, помимо других способов, конструкцию трубок своей мобильной установки сделал так, чтобы обеспечить наилучшую естественную циркуляцию воды и газов.
Обратившись к патентам Мэйера, я обратил внимание на то, что в патентах он значительное место отводит лазерной стимуляции. Мерцание светодиодов происходит на частоте, приблизительно равной 30 кГц. В качестве стимуляторов, используются мощные красные светодиоды, подобные тем, которые стоят в лазерных указках. Колупать лазерные указки – не дешёвое удовольствие, поэтому я этого делать не стал. Можно конечно повозиться со сверхъяркими светодиодами, но я до этого не дошёл. Если у Вас есть желание и возможности, попробуйте.
До красного светового диапазона я не дошёл, остановившись на СВЧ-частотах. Как я писал ранее, используется резонансная частота молекул воды. Это позволяет коротким маломощным импульсом с СВЧ-заполнением «встряхнуть» практически любой объём воды. Но поскольку непрерывное колебание на сверхвысоких частотах способно только нагревать молекулы воды (подобно квазинепрерывному колебанию микроволновой СВЧ-печи), а нам этого не надо, я применил короткий импульс. Старая конструкция показала неравномерный выход газа из разных пар трубок, поэтому пришлось переделывать конструкцию ячейки с выполнением премудростей техники СВЧ. Благодаря использованию короткого сверхвысокочастотного импульса, произошло значительное увеличение количества выхода газа, при неизменной затрачиваемой мощности.

Здесь первый график – зависимость отношения объёма выходящего газа V, к мощности P, от самой электрической мощности, затрачиваемой на получение кислородно-водородной смеси без дополнительного воздействия. Второй график – с ультразвуковым воздействием, а третий — с воздействием СВЧ-импульсом. Положительный эффект от стимуляции СВЧ-импульсами выразительнее, чем стимуляция ультразвуком. В ходе экспериментов при СВЧ-стимуляции, наблюдалось незначительное падение производительности на подводимой мощности около 16-ти Ватт, а потом снова наблюдался подъём производительности. Что это за падение, объяснить пока не могу, думал – ошибка измерения, но при повторных экспериментах и проводимых с использованием других приборов «падение» повторялось. Для точности, повторные измерения проводились с шагом тока в 0,2А, в диапазоне от 0,2А, до 2,4А. На конечном участке графика происходило резкое падение производительности. Правильнее сказать – ток повышался, а количество газа не увеличивалось. Предполагаю, что на больших токах, большое количество выделяемого газа препятствовало работе установки, поэтому при более больших токах, я экспериментировать не стал, нет смысла.
Если Вы посмотрите на последний график, то сможете сделать вывод: эта экспериментальная установка с полезной площадью электродов равной 180 см2 (три пары трубок), способна при затрате 27 Ватт электрической мощности вырабатывать около 2,2 литров кислородно-водородной смеси в час. При указанной мощности и напряжении 12 вольт, ток потребления приблизительно будет равен 2,25 ампера. Отсюда следует, что для выработки 22 литров кислородно-водородной смеси в час, требуется 270 Вт электрической энергии, что при бортовом напряжении в 12 вольт соответствует току 22,5 ампер. При этом необходимо 30 пар трубок высотой около 10 сантиметров. Как видите, ток не малый, но он вполне «вписывается» в затраты энергии штатным генератором автомобиля. Можно и по другому: на 1 киловатт затраченной электрической мощности вырабатывается 81 литр газа, или с пересчётом на метры кубические – необходимо приблизительно 12,3 киловат*час. для выработки одного кубического метра кислородно-водородной смеси.
Если сравнивать с известными электролизными установками, например ИФТИ, затрачивающими 4…5 киловат*час на кубический нормированный метр водорода, то описанная в этой статье установка проигрывает в производительности, поскольку она затрачивает на кубический нормированный метр водорода 18,5 киловат*час. Поэтому из приведённых мной цифр делайте выводы сами.
Обратите внимание, что в описываемой мной установке используется обыкновенная вода, не «сдобренная» каустической содой, или другой щелочью. Щелочь необходима в обыкновенных электролизных установках, без неё установки не производительны. Кроме того, подача напряжения на электроды производится в непрерывном режиме. Но по патентам Мэйера следует, что он использовал импульсный режим. Мэйер пишет, что во время пауз, происходит восстановление воды. Думаю, что паузы в подаче напряжения используются для очистки электродов от пузырьков газа, которые вызывают появление в межэлектродном пространстве дополнительных паразитных токов.
Какой объем газа необходим для работы двигателя внутреннего сгорания, я пока не разбирался. Но то, что показывают на Ютюбе, мало соответствует действительности.
meanders.ru
Электролиз воды — Electrolysis of water
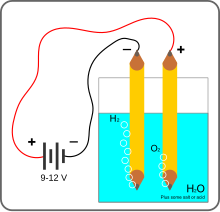 Простая установка для демонстрации электролиза воды в домашних условиях
Простая установка для демонстрации электролиза воды в домашних условиях 
Электролиз воды является разложение воды в кислород и водород газа из — за прохождения электрического тока . Реакция имеет стандартный потенциал -1.23 V, то есть его в идеале требует разность потенциалов 1,23 вольт для расщепления воды.
Этот метод может быть использован для газообразного водорода и кислорода для дыхания. Поскольку водород является важным промышленным товаром, на сегодняшний день большинства промышленных способов получения водорода из природного газа , вместо того, чтобы , в паровом риформинге процесса.
история
Ян Рудольф Deiman и Адриан ван Paets Troostwijk используются, в 1789 году, электростатический машин для производства электричества , который был выписан на золотые электродов в лейденских банках с водой. В 1800 году Алессандро Вольта изобрел гальваническую груду , и через несколько недель Уильям Николсон и Энтони Carlisle использовали его для электролиза воды. Когда Зеноб Теофил Грамм изобрел машину Грамма в 1869 г. электролиза воды стал дешевым способом для производства водорода. Способ промышленного синтеза водорода и кислорода посредством электролиза был разработан Дмитрием Лачинами в 1888 году.
Принцип
Источник электропитания постоянного тока подключен к двум электродам или два пластин ( как правило , изготовленных из металла , какого — либо инертного , такие как платина , нержавеющая сталь или иридий ) , которые помещены в воде. Водород будет появляться на катоде (где электроны входят в воду), и кислород будет появляться на аноде . Предполагая , что идеальную фарадеевскую эффективность , то количество водорода генерируется в два раза превышаю количество кислорода, и оба они пропорциональны к общему электрическому заряду , проведенному раствором. Тем не менее, во многих клетках конкурирующих побочные реакции происходят, что приводит к различным продуктам и меньше , чем идеальная фарадеевская эффективность.
Электролиз из чистой воды требует избыточной энергии в форме перенапряжения , чтобы преодолеть различные барьеры активации. Без лишней энергии электролиз чистой воды происходит очень медленно или вовсе нет. Это отчасти из — за ограниченную самостоятельную ионизацию воды . Чистая вода имеет электропроводность около одной миллионной в морской воде. Многие электролизеры могут также отсутствие необходимых электрокатализаторов . Эффективность электролиза увеличивается за счет добавления электролита (например, соли , с кислотой или основанием ) и использование электрокатализаторах .
В настоящее время электролитический процесс редко используется в промышленных применениях , так как водород , в настоящее время может быть получен более приемлемым из ископаемого топлива .
уравнения

В чистой воде при отрицательно заряженный катод, уменьшение реакция происходит, с электронами (е — ) с катода отдается катионы водорода с образованием газообразного водорода. Полуреакции , сбалансирован с кислотой, является:
- Снижение на катоде: 2 Н + ( водн ) + 2е — → H 2 ( г )
В положительно заряженного анода, окисление происходит реакция, генерации газообразного кислорода и давая электроны к аноду , чтобы замкнуть цепь:
- Окисление на аноде: 2 Н 2 О ( л ) → O 2 ( г ) + 4 Н + ( водно ) + ом —
Та же полуреакция также может быть сбалансирована с основанием, как указано ниже. Не все полуреакции должны быть сбалансированы с кислотой или основанием. Многие из них, как окисление или восстановление воды, перечисленных здесь. Чтобы добавить половину реакции они оба должны быть сбалансированы с любой кислотой или основанием. Кислотно-сбалансирован реакции преобладают в кислых растворах (низкий рН), в то время как базовые балансировкой реакции преобладают в основных растворах (с высоким рН).
| Катод (сокращение): | 2 Н 2 О ( л ) + 2е — | → | Н 2 ( г ) + 2 ОН — ( водн ) |
| Анод (окисление): | 2 ОН — ( водно ) | → | 1/2 O 2 ( г ) + Н 2 О ( л ) + 2 е — |
Сочетание либо полуреакция дает то же общее разложение воды на кислород и водород:
- Общая реакция: 2 Н 2 О ( л ) → 2 Н 2 ( г ) + O 2 ( г )
Число молекул водорода, полученного таким образом, в два раза превышает число молекул кислорода. Предполагая, равную температуру и давление для обоих газов, полученный газ водород имеет, следовательно, в два раза объем производимого газообразного кислорода. Число электронов проталкивается через воду в два раза превышает число генерируемых молекул водорода и в четыре раза числа генерируемых молекул кислорода.
Термодинамика
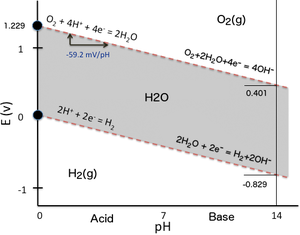 Диаграмма Пурб для воды, в том числе равновесных областей для воды, кислорода и водорода при STP. Вертикальная шкала является электродный потенциал водорода или невзаимодействующих электрода по отношению к SHE электрода, горизонтальный масштаб является рН электролита ( в противном случае невзаимодействующих). Игнорирование перенапряжения , выше верхней линии равновесие условия является газообразным кислородом, и кислорода пузыря от электрода до тех пор , пока не достигается равновесие. Кроме того, ниже нижней линии, равновесное состояние газообразный водород, и водород будет пузыриться от электрода до тех пор , пока не достигается равновесие. Разложение чистой воды на водород и кислород при нормальной температуре и давлении не является благоприятным в термодинамических условиях.
Диаграмма Пурб для воды, в том числе равновесных областей для воды, кислорода и водорода при STP. Вертикальная шкала является электродный потенциал водорода или невзаимодействующих электрода по отношению к SHE электрода, горизонтальный масштаб является рН электролита ( в противном случае невзаимодействующих). Игнорирование перенапряжения , выше верхней линии равновесие условия является газообразным кислородом, и кислорода пузыря от электрода до тех пор , пока не достигается равновесие. Кроме того, ниже нижней линии, равновесное состояние газообразный водород, и водород будет пузыриться от электрода до тех пор , пока не достигается равновесие. Разложение чистой воды на водород и кислород при нормальной температуре и давлении не является благоприятным в термодинамических условиях.| Анод (окисление): | 2 Н 2 О ( л ) | → | O 2 ( г ) + 4 Н + ( водн ) + 4e — | Е о = 1,23 В (для восстановления полуоси уравнения) | |
| Катод (сокращение): | 2 Н + ( водно ) + 2е — | → | Н 2 ( г ) | Е о = 0,00 В |
Таким образом, стандартный потенциал воды электролизера (E
выбор Электролит

Если описанные выше процессы происходят в чистой воде, H + катионы будут потребляться / уменьшены на катоде и ОН — анионы будут потребляться / окисляются на аноде. Это может быть проверено путем добавления индикатора рН в воде: вода вблизи катода является основным , а вода вблизи анода является кислой. Эти отрицательные ионы гидроксида , которые приближаются к аноду в основном , в сочетании с положительными ионами гидроксония (H 3 O + ) с образованием воды. Положительные ионы гидроксония , которые приближаются к катоду в основном в сочетании с отрицательными ионами гидроксида с образованием воды. Относительно небольшое количество ионов гидроксония / гидроксид достигают катода / анода. Это может привести к концентрации перенапряжения на обоих электродах.
Чистая вода является достаточно хорошим диэлектриком , так как он имеет низкую автоионизацию , К ш = 1,0 × 10 -14 при комнатной температуре и , таким образом , чистая вода проводит ток плохо, 0,055 мкСм · см -1 . Если очень большой потенциал не применяется , чтобы вызвать увеличение автоионизацией воды электролиз чистой воды протекает очень медленно ограничена общей проводимости.
Если растворимый в воде электролит добавляют, проводимость воды значительно повышается. Электролит диссоциирует на катионы и анионы; анионы устремитесь к аноду и нейтрализовать накопление положительно заряженного Н + там; аналогичным образом , катионы устремляются к катоду и нейтрализовать накопление отрицательно заряженный ОН — там. Это позволяет непрерывный поток электричества.
Электролит для электролиза воды
Необходимо соблюдать осторожность при выборе электролита, так как анион , из электролита находится в конкуренции с ионами гидроксидом , чтобы дать вверх по электрону . Электролита анион с менее стандартным электродным потенциалом , чем гидроксид будет окисляться вместо гидроксида, и ни один газообразный кислорода не будет производиться. Катион с большим стандартным электродным потенциалом , чем ион водорода будет уменьшен вместо этого, и ни один газообразного водорода не будет производиться.
Следующие катионы имеют более низкий электродный потенциал , чем Н + и, следовательно , пригодны для использования в качестве катионов электролита: Li + , Rb + , К + , Cs + , Ва 2+ , Sr 2+ , Са 2+ , Na + и Mg 2 + . Натрия и лития часто используются, так как они образуют недорогие, растворимые соли.
Если кислота используется в качестве электролита, катион Н + , и нет ни одного конкурента для H + , созданного отмежевывается воды. Наиболее часто используемый анион является сульфат ( SO 2-
4 ), так как это очень трудно окислить, со стандартным потенциалом для окисления этого иона к пероксидисульфату иону +2.010 вольта.
Сильные кислоты , такие как серная кислота (H 2 SO 4 ) и сильные основания , такие как гидроксид калия (KOH) и гидроксид натрия (NaOH) часто используют в качестве электролитов из — за их сильные проводящие способности.
Твердый полимерный электролит также может быть использован , такой как Nafion и при нанесении с помощью специального катализатора на каждой стороне мембраны может эффективно разделить молекулу воды с всего лишь 1,5 вольт. Есть также ряд других твердых электролитных систем , которые были опробованы и разработанной с рядом систем электролизных теперь доступен коммерчески , которые используют твердые электролиты.
Чистый электролиз воды
Электролит свободной электролиз чистой воды была достигнута с помощью глубокой суб-Дебай длины нанометрических зазоров электрохимических ячеек . Когда расстояние зазор между катодом и анодом , даже меньше , чем дебаевской длины (1 микрон в чистой воде, около 220 нм в дистиллированной воде), в двухслойных регионы из двух электродов могут перекрываться друг с другом, что приводит к равномерно высокое электрическое поле распределяется внутри весь зазор. Такое высокое электрическое поле может значительно повысить перенос ионов внутри воды ( в основном за счет миграции), дальнейшее повышение уверенности в ионизацию воды и сохранение всей реакции продолжается, и показывает малое сопротивление между двумя электродами. В этом случае две полуреакции соединены друг с другом и ограничиваются шагами переноса электронов (ток электролиза насыщенным при дальнейшем уменьшении расстояния электрода).
методы
Фундаментальная демонстрация
Два провода , идущие от клемм батареи, помещают в чашку воды с количеством электролита , чтобы установить проводимость в растворе. Используя NaCl (поваренную соль) на результатах раствора электролита в хлора газа , а не кислород из — за конкурирующую полуреакцию . С правильными электродами и правильным электролитом, такими как пищевая сода ( бикарбонат натрия ), газа водорода и кислородом будет течь из противоположно заряженных электродов . Кислород будет собирать на положительно заряженного электрода ( анода ) и водорода будут собирать на отрицательно заряженный электрод ( катода ). Следует отметить , что водород положительно заряженный в H 2 молекулы О, так что в конце концов на отрицательном электроде. (И наоборот , для кислорода) .
Следует отметить , что водный раствор воды с ионами хлорида, когда электролизу, приведет либо ОН — если концентрация Cl — низкий, или в газообразный хлор будучи преимущественно разряжается , если концентрация Cl — больше , чем 25% по массе в решение.
 Тест Match используется для обнаружения присутствия газообразного водорода
Тест Match используется для обнаружения присутствия газообразного водородаHofmann вольтаметр
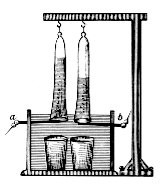
Аппарат Гофман часто используются в качестве малого электролизере. Она состоит из трех соединенных вертикальных цилиндров. Внутренний цилиндр является открытым в верхней части , чтобы позволить добавление воды и электролита. Платины электрод помещаются в нижней части каждого из двух боковых цилиндров, соединенного с положительными и отрицательными выводами источника электроэнергии . Когда ток проходит через Вольтметр Hofmann, газообразные формы кислорода на аноде (положительный) и газообразного водорода на катоде (отрицательный). Каждый газ вытесняет воду и собирает в верхней части два наружных труб, где оно может быть отсасывают с запорным краном.
промышленные
Многие промышленные электролизеры очень похожи на Hofmann voltameters , со сложными платиновыми пластинами или сотнями в качестве электродов. Как правило , единственный раз , когда водород преднамеренно производится из электролиза для конкретной точки использования приложений , таких как в случае с гремучими факелами или при чрезвычайно высокая чистотой водород или кислород желательно. Подавляющее большинство водорода получают из углеводородов и в результате содержит следовые количества окиси углерода среди других примесей. Примеси окиси углерода могут быть вредными для различных систем , включая многие топливные элементы .
Высокое давление
Электролиз высокого давления является электролиз воды с помощью сжатого водорода выход около 12-20 МПа (120-200 бар , 1740-2900 фунтов на квадратный дюйм ). Путем повышения давления водорода в электролизере, необходимость внешнего компрессора водорода исключается; среднее потребление энергии для внутреннего сжатия составляет около 3%.
Высокая температура
Высокотемпературный электролиз (также HTE или пар электролиз) представляет собой метод в настоящее время исследуется для электролиза воды с тепловым двигателем . Высокая температура электролиза может быть предпочтительнее традиционной комнатной температуре электролиза , так как часть энергии поступает в виде тепла, что дешевле , чем электричество, а потому что реакция электролиза является более эффективным при более высоких температурах.
Алкалиновая вода
мембранный электролит Полимер
Никель / железо
В 2014 году исследователи объявили систему электролиза , изготовленную из недорогого, обильные драгоценных металлических катализаторов, таких как платина или иридий никель и железо , а не. Структура никель-металл / никель-оксид является более активной , чем чистый металлическим никелем или только чистый оксид никеля. Катализатор значительно снижает требуемое напряжение . Также никель-железные аккумуляторы исследуются для использования в качестве комбинированных батарей и электролиза для получения водорода. Этот «battolysers» можно заряжать и разряжать , как обычные батареи, и будет производить водород при полной зарядке.
Нанометрических зазоров гальванических элементов
В 2017 году исследователи сообщили об использовании нанометрических зазоров электрохимических элементов для достижения высокой эффективности электролита , свободного от чистого электролиза воды при комнатной температуре. В нанометрических зазорах электрохимических ячеек, два электрода настолько близко друг к другу (даже меньше , чем дебаевская длина в чистой воде) , что массовая скорость транспорта может быть даже выше , чем скорость переноса электрона, что приводит к двум полуреакциям соединены друг с другом и ограничена шагом переноса электрона. Эксперименты показывают , что плотность электрического тока от чистого электролиза воды может быть даже больше , чем от 1 моль / л раствора гидроксида натрия. Механизм, «Виртуальная Разбивка механизм», полностью отличается от устоявшейся традиционной электрохимической теории, из — за такой размером нанометрических зазоров эффекта.
Приложения
Около пяти процентов водорода газа , добываемого во всем мире создается путем электролиза. Большая часть этого водорода , полученный путем электролиза представляет собой продукт стороны в производстве хлора и каустической соды . Это яркий пример конкурирующей побочной реакции .
- 2NaCl + 2H 2 O → Cl 2 + Н 2 + 2NaOH
Электролиз солевого раствора , смесь хлорида воды / натрия, только половина электролиз воды , так как хлориды ионы окисляют до хлора , а не воды окисляется до кислорода. Термодинамически, это не было бы ожидать , поскольку потенциал окисления иона хлора меньше , чем у воды, но скорость реакции хлорида намного больше , чем у воды, в результате чего она преобладает. Водород , получаемый в результате этого процесса либо сожжен (преобразование его обратно в воду), используемый для производства специальных химических веществ или различных других мелких приложений.
Электролиз воды также используются для генерации кислорода для Международной космической станции .
Водород позже может быть использован в топливном элементе в качестве способа хранения энергии и воды.
КПД
промышленная продукция
Эффективность современных генераторов водорода измеряются с помощью энергии , потребляемой в стандартном объеме водорода (МДж / м 3 ), при условии стандартной температуры и давления в H 2 . Ниже , энергию , используемую генератором, тем выше будет его эффективность; 100% -efficient электролизер будет потреблять 39,4 киловатт-часов на килограмм (142 МДж / кг) водорода , 12,749 джоулей на литр (12,75 МДж / м 3 ). Практическая электролиз ( с помощью вращающегося электролизера при давлении 15 бар) может потреблять 50 киловатт-часов на килограмм (180 МДж / кг) и еще 15 киловатт-часов (54 МДж) , если водород сжимается для использования в водородных автомобилей.
Электролизер производители обеспечивают эффективность на основе теплосодержания . Для того, чтобы оценить эффективность заявленного электролизера важно установить , как это было определено с помощью поставщика (то есть то , что значение энтальпии, чем плотность тока, и т.д.).
Есть две основные технологии , доступные на рынке, щелочная и протонной обменной мембраной (PEM) электролизера. Щелочные электролизеры дешевле с точки зрения инвестиций (они обычно используют никелевые катализаторы), но менее эффективными; PEM электролизеры, наоборот, являются более дорогими (они обычно используют дорогие металлические катализаторы платиновой группы) , но более эффективны и могут работать при более высоких плотностях тока, и , следовательно , может быть , возможно , дешевле , если производство водорода достаточно велико.
Обычный щелочной электролиз имеет КПД около 70%. Учет принятого использования более высокой теплотворной способностью (из — за неэффективности с помощью тепла может быть перенаправлен обратно в систему , чтобы создать пар , необходимый катализатором), средние рабочие эффективности для PEM электролиза составляет около 80%. Это , как ожидается , увеличится до 82-86% от до 2030 г. Теоретический КПД для PEM электролизеров прогнозируются до 94%.
H 2 производственные затраты ($ -gge облагаемых налогом) на различных цен на природный газУчитывая промышленное производство водорода, а также с использованием текущих лучшими процессов для электролиза воды (PEM или щелочно — электролиз) , которые имеют эффективную электрическую эффективность 70-80%, производство 1 кг водорода (который имеет удельную энергию 143 МДж / кг или около 40 кВт * ч / кг) требуют 50-55 кВт — ч электроэнергии. При стоимости электроэнергии в $ 0,06 / кВт · ч, как указано в Департаменте энергетики производства водорода целях на 2015, стоимость водорода составляет $ 3 / кг. С диапазоне цен на природный газ с 2016 года , как показано на графике ( производства водорода Технология команды дорожной карты, ноябрь 2017 ) положить стоимость SMR водорода при температуре между $ 1.20 и $ 1.50, себестоимость водорода с помощью электролиза еще более двойной 2015 DOE водорода целевые цены. МЭ США целевая цена водорода в 2020 году составляет $ 2,30 / кг, что требует затрат на электроэнергию в размере $ 0,037 / кВтч, что достижимые учитывая последние тендеры PPA для ветровой и солнечной энергии во многих регионах. Это ставит $ 4 / GGE Н2 разливает объективные хорошо в пределах досягаемости, и близко к слегка повышенной стоимости добычи природного газа для SMR.
В других частях мира, паровой риформинг метана составляет от $ 1-3 / кг в среднем. Это делает производство водорода с помощью электролиза стоимости конкурентоспособной во многих регионах уже, как это изложено Nel водорода и других, в том числе статьи МЭА разбирая условия, которые могут привести к конкурентному преимуществу для электролиза.
перенапряжение
Реальные электролизеры воды требуют более высоких напряжений для протекания реакции. Часть , которая превышает 1,23 V называется перенапряжением или повышенным напряжением, и представляет собой любые потери и неидеальности в электрохимическом процессе.
Для хорошо разработанной клетки самого большое перенапряжением является реакция перенапряжение на четыре-электронное окисление воды до кислорода на аноде; электрокатализаторы могут облегчить эту реакцию, и платиновые сплавы являются состоянием техники для этого окисления. Разработка дешевый, эффективный электрокатализатор для этой реакции было бы большим шагом вперед, и является предметом исследования; Есть много подходов, среди них 30-летний рецепт сульфида молибдена , графеновых квантовых точек , углеродных нанотрубок , перовскита , и никель / никель-оксид. Проще реакцию двух электронов для получения водорода на катоде может быть electrocatalyzed почти без перенапряжения платины, или в теории с гидрогеназой фермента . Если другие, менее эффективны, материалы используются для катода (например , графит ), будут появляться большие перенапряжения.
Термодинамика
Электролиз воды в стандартных условиях требует теоретического минимума 237 кДж электрической энергии вход для диссоциации каждый моль воды, которая является стандартной свободной энергии Гиббса образования воды. Он также требует энергии , чтобы преодолеть изменения энтропии реакции. Таким образом, этот процесс не может протекать ниже 286 кДж на моль , если не добавляется никакого внешнего тепла / энергии.
Поскольку каждый моль воды требует два молей электронов , и при условии , что постоянная Фарадея F представляет собой заряд моль электронов (96485 С / моль), отсюда следует , что минимальное напряжение , необходимое для электролиза составляет около 1,23 В. Если электролиз осуществляют при высокой температуре, это напряжение снижается. Это позволяет эффективно электролизера работать на более чем 100% электрической эффективности. В электрохимических системах это означает , что тепло должно подаваться в реактор для поддержания реакции. Таким образом , тепловая энергия может быть использована для части требования электролиза энергии. Аналогичным образом требуемое напряжение может быть снижено (менее 1 В) , если топливо (такие как углерод, спирт, биомасса) подвергают взаимодействию с водой (PEM на основе электролизера при низкой температуре) или ионов кислорода (твердый оксид электролита электролизера основе при высоких температурах ). Это приводит некоторые из энергии в топливе используется для «помочь» процесс электролиза и может уменьшить общую стоимость водорода , полученного.
Однако, наблюдая компонент энтропии (и другие потери), напряжения свыше 1,48 V необходимы для реакции протекать при практических плотностях тока (The термонейтрального напряжении).
В случае электролиза воды, свободная энергия Гиббса представляет собой минимальную работу , необходимую для протекания реакции, и реакция энтальпия количество энергии (работа , так и тепла) , что должно быть обеспечено таким образом продукты реакции при той же температуре в качестве реагента (т.е. стандартной температуры для значений , указанных выше). Потенциально, электролизер работает на 1,48 V была бы 100% эффективность.
Смотрите также
Рекомендации
внешняя ссылка
ru.qwertyu.wiki
Электролиз воды в промышленных генераторах водорода
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.

Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОН—.Деминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
Далее, чтобы получить чистый водород и кислород, требуется разделить газы образующиеся на электродах, и для этого применяют разделительные ионно-обменные мембраны (см. рисунок). Количество получаемого водорода в два раза больше получаемого кислорода и поэтому давление в водородной полости поднимается в два раза быстрее. Для уравнивания давления в полостях применяют уравнивающую давление мембрану на выходе из электролизера, которая предотвращает передавливание водорода в полость кислорода через каналы предназначенные для циркуляции электролита.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
general-gas.ru
ЭЛЕКТРОЛИЗ ВОДЫ — КАК ОН ЕСТЬ: hajoh — LiveJournal
 По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdf
По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdfЕще раз про Н2О
Как уже говорилось, впервые химический состав воды был определен французским химиком Лавуазье в 1784 году. Лавуазье вместе с военным инженером Мёнье, прогоняя пары воды над раскаленным листом железа, обнаружил, что вода разлагается, выделяя при этом водород и кислород. Да, конечно, для своего времени, для эпохи «упорядочения вещей», эти выводы имели большое значение. В самом деле, ведь до этого открытия вода считалась совершенно однородным веществом. Нельзя, однако, не отметить и другого: открытие это сыграло и свою вполне очевидную отрицательную роль, так как надолго отвлекло внимание других ученых от поисков в этой области и утвердило в умах многих поколений непогрешимость данного вывода, освященного к тому же авторитетом ученого.
Но, что условия, при которых он проводился, были настолько несовершенны, были «грязны».
Чего стоит одно только наличие железа, над которым пропускались пары воды. Оно способно внести такие моменты в опыт, которые даже трудно учесть наперед. Лавуазье с партнером зафиксировали в своем опыте то, что было наиболее очевидным: выделение двух газов — водорода и кислорода, а что было сверх того, на это они и вовсе не обратили внимание, скорее всего по той причине, что это «сверх того» не было столь очевидным, как выделение двух газов.
Поскольку до этого открытия общим мнением, господствовавшим в науке, было мнение, что вода является однородным веществом, факт открытия ее неоднородного состава можно назвать революционным. Чего еще можно было требовать от первооткрывателей! К тому же очевидность результатов опыта была слишком подкупающей.
Старый взгляд на воду был отброшен и заменен новым представлением о воде как соединении двух элементов — водорода и кислорода, которое быстро утвердилось в науке. Этому способствовало в значительной мере развитие электрохимии.
ЭЛЕКТРОЛИЗ по Дэви
Рядом ученых (Никольсон, Кавендиш и др.) был проведен опыт по электрохимическому разложению воды (подобное определение данного процесса совершенно ошибочно). Под словом «разложение» надо понимать электролиз воды как сложный окислительно-восстановительный процесс, но отнюдь не как простое разложение воды на составляющие элементы.
Итак, при разложении, т.е. электролизе воды выделялись водород и кислород, что, казалось бы, внешним образом подтверждало вывод Лавуазье. Однако при этом «черный ящик» стал неожиданно выдавать дополнительную информацию, которой прежде не было. В процессе электролиза обнаружилось два странных явления: во-первых, обе составные части воды выделялись не вместе, а отдельно друг от друга — кислород у одного электрода, водород — у другого; во-вторых, наблюдалось образование кислоты у кислородного полюса и щелочи у водородного. Это «странное» разложение воды озадачило ученых; притом их больше беспокоила вторая «странность», т.е. появление кислоты и щелочи.
То обстоятельство, что при пропускании через воду электрического тока выделялись водород и кислород, вполне устраивало ученых, ибо как бы подтверждало ставшее уже господствующим мнение о составе воды. Вопрос же о том, каким образом эти составные части выделялись, при каких сопутствующих обстоятельствах, хотя и занимал ученых того времени, но все же не в такой степени: их внимание было направлено главным образом на вторую «странность», ибо она наводила тень сомнения на открытую формулу воды. Неизбежно встал вопрос о том, что является причиной образования кислоты и щелочи при электролизе воды.
За решение этой загадки взялся выдающийся английский химик Гемфри Дэви (1778—1829). Дэви рядом опытов, казалось бы, подтвердил предполагаемый всеми учеными того времени факт, что образование кислоты и щелочи при электролизе воды — явление случайное, не связанное с самой водой, состоящей, как это и было определено Лавуазье, из водорода и кислорода. Но, каким образом Дэви удалось это «доказать».
Дэви проделал многочисленные опыты по «разложению» электричеством тщательно очищенной воды в различных сосудах: агатовых, стеклянных, сделанных из плавикового шпата, сернокислого барита и т.п., чтобы максимально уменьшить влияние материала сосудов на результаты опытов. Во всех без исключения опытах при электролизе воды он получал у анода сильную кислоту, у катода щелочь. Он связывал это с тем, что чистая вода отчасти все же разлагала материал сосудов, что и явилось причиной образования кислоты и щелочи. Важным, однако, следствием опытов было то, что количество образующихся у электродов кислоты и щелочи стояло в прямой зависимости от продолжительности опытов, а именно: чем продолжительнее они были, тем больше образовывалось кислоты и щелочи и тем сильнее была их концентрация.
В опытах Дэви по электролизу различных растворов солей получалась аналогичная картина: у анода шло образование кислоты с выделением кислорода, у катода — образование щелочи с выделением водорода или чистого аммиака. Сами эти процессы должны были бы подтолкнуть по аналогии к выводам относительно общих закономерностей, относящихся к процессу электролиза.
Ведь хорошо известно, что при электролизе различных веществ у электродов происходят окислительно-восстановительные процессы, но отнюдь не простое разложение веществ. Более того, только при наличии окислительно-восстановительного процесса может идти и сам электролиз.
При этом реакция окисления происходит у одного электрода, а реакция восстановления у другого. Поэтому было бы самой грубой ошибкой рассматривать электролиз как простой процесс разложения веществ на составляющие их элементы, будь то вода, соль или кислота. Окисление у одного полюса происходит при одновременном восстановлении у другого, и наоборот. Эти положения суть святая святых электрохимических процессов, полностью согласующихся со вторым началом термодинамики. Действительно, если мы возьмем примеры с электролизом солей, то легко видеть, что у анода происходила реакция восстановления с выделением кислорода (продуктом этой реакции, скапливающимся у анода, во всех случаях выступала какая-нибудь кислота). У катода происходила реакция окисления с выделением водорода или металла (продуктом этой реакции, скапливающимся у катода, всегда была какая-нибудь щелочь).
Но именно эта совершенно очевидная вещь отвергалась. Мысль о ней не допускалась или ею попроступренебрегали. Притом делали это не какие-то дилетанты, а профессионалы высокого класса. Для них, сдается, каким-то символом веры, своего рода «священной коровой» стал факт, что вода состоит из двух элементов — водорода и кислорода, и они направляли все свои недюжинные способности именно на подтверждение данного факта, но отнюдь не на проверку его истинности. То, что оба газа выделялись при электролизе, хотя и у разных электродов, как бы подтверждало эту веру, даже вопреки всем законам электролиза и термодинамики. При этом никого нисколько не смущало, что вода вот так легко может разделяться на составные части, будто два склеенных куска дерева, опущенных в воду.
Для того чтобы избежать всяких побочных влияний, Дэви провел ряд опытов в золотых сосудах с хорошо очищенной водой. На протяжении четырнадцати часов, в течение которых продолжался опыт, количество кислоты в анодном сосуде постоянно возрастало. Дэви обнаружил, что она по своим свойствам ничем не отличалась от азотной кислоты, которая точно таким же образом образовывалась в опытах, проводимых им прежде в стеклянных сосудах. В катодном же сосуде образовывалась летучая щелочь, количество которой скоро доходило до определенного предела. Она обнаруживала свойство аммиака (Nh4).
Дэви повторил свой опыт и продолжал его без перерыва трое суток. К концу этого времени, как он сам свидетельствует, вода в сосудах была разложена и выпарилась больше чем на половину своего первоначального объема. В результате, в анодном сосуде образовалась сильная азотная кислота, количество же щелочи оставалось примерно на том же уровне, как и в предыдущем опыте. Дэви посчитал, что последнее было связано с ее постоянным испарением.
Вода «под пыткой» у Дэви
А действительно ли в опытах Дэви все было так безукоризненно чисто и хорошо? Рассмотрим опыт Дэви по электролизу воды под колоколом воздушного насоса. Почему в этом опыте образовалось лишь небольшое количество кислоты в анодном сосуде и не было вовсе обнаружено щелочи в сосуде катодном? Действительно ли, как думал Дэви, это было связано с отсутствием воздуха, выкачанного из-под колокола? Отчасти да, но совершенно в другом смысле, нежели он предполагал. Начать с того, что Дэви допустил серьезную ошибку в своем первоначальном предположении, что причиной образования кислоты и щелочи являлся азот воздуха. Образование кислоты и щелочи к азоту воздуха никакого отношения иметь не могло по той простой причине, что азот в обычных условиях химически не активен, не растворяется в воде и не вступает в реакции ни с кислородом, ни с водородом. Один этот факт должен был бы натолкнуть на поиски иных источников образования кислоты и щелочи. Позже, правда, высказывалось предположение, что образование кислоты и щелочи в опытах было, возможно, вызвано присутствием в воздухе некоторого количества аммонийных солей. Этим объяснением и удовлетворились. Однако вряд ли можно всерьез принимать данное объяснение, так как, во-первых, оно было сделано постфактум и, во- вторых, даже если бы какое-то количество таких солей и впрямь присутствовало, то оно настолько должно было быть мало, что не могло оказывать постоянного и закономерного образования кислоты и щелочи в каждом опыте, количество которых стояло, как говорилось, лишь в прямой зависимости от продолжительности проводимых опытов.
Иллюстрация восстановительного действия водорода.
Если, взять два электрода, один из которых представляет полированную серебряную пластинку, а другой — обычную швейную иглу, поместить их под колокол, и в сильно разреженном воздухе пропускать электрический ток так, чтобы электрический разряд переходил с кончика иглы на полированную пластинку, то напротив кончика иглы пластинка заметно изменится — она окислится и потускнеет, и тем больше, чем дольше будет пропускаться электрический ток. Если же после этого воздух заменить разреженным водородом, то при всех прочих равных и неизменных условиях, дальнейшее пропускание тока приведет к тому, что окись на пластинке будет постепенно сходить, и полировка по большей части восстановится, что хорошо иллюстрирует восстанавливающие свойства водорода.
Второй пример из области живой природы. Клод Бернар приводит такой опыт: он смешивал один объем воздуха с двумя объемами водорода и помещал в эту атмосферу семена. При всех прочих благоприятных условиях (влага, тепло и проч.) прорастания семян не происходило, хотя напряжение кислорода при этом было вполне достаточным для жизнедеятельности. Очевидно, что негативный результат был обязан опять-таки действию водорода, оказывавшего сильное восстанавливающее действие, препятствуя течению окислительно-восстановительного процесса, а вместе с ним и образованию его необходимых продуктов — кислоты и щелочи.
Третье: из физической химии хорошо известно, что азотная кислота является легко восстанавливающимся веществом. Она, например, восстанавливается водородом до свободного азота:
2N03+ 12Н + 10е—> N2+ 6Н20
Это свойство азотной кислоты специально используется в некоторых гальванических элементах для предотвращения поляризации. В этих случаях азотную кислоту добавляют в катодное отделение, где выделяется водород.
Аналогичные процессы происходили и под колоколом в опытах Дэви. Когда он во втором опыте заменил воздух водородом, то тем самым создал там мощную восстановительную среду, действие которой не преминуло сказаться на результатах: в анодном сосуде естественно не было (и не могло быть) обнаружено кислоты, в катодном — щелочи. Все было естественно и закономерно. Но факт остается фактом: опыты Дэви убедили всех окончательно, что вода состоит из двух простых элементов — водорода и кислорода.
Однако предположим, что вода действительно состоит из водорода и кислорода. Тогда естественно было бы предполагать, что, коль скоро вода с такой легкостью разлагается на свои составные части, она должна столь же легко образовываться в результате их синтеза. Ничего подобного, однако, не происходит. Как известно, смесь двух газов в пропорции один к двум (один объем кислорода и два объема водорода) дает так называемый гремучий газ, но отнюдь не воду. Попытки образования воды из водорода и кислорода имели успех только в присутствии катализатора (кстати, в роли катализатора может при этом выступать и железо, то самое железо, над которым Лавуазье пропускал пары воды и извлекал свои исторические выводы).
Можно сказать, что большинство опытов по определению химического состава воды было направлено не столько на объективные поиски, сколько на подгонку их результатов к уже имеющемуся выводу, который стал поистине символом веры. «Черный ящик» давал в основном ту информацию, которую от него ожидали и которую часто заведомо предопределяли направленным действием на его входы.
Итак, множество фактов биологического, химического и физического свойства не дает оснований признать существующую формулу воды верной. Против нее говорят не только эмпирические факты, но и теоретические положения и, прежде всего, те, которые вытекают из таких фундаментальных положений, каковыми являются начала термодинамики. Именно с ними совершенно не согласуется взгляд на электролиз воды как на процесс простого разложения воды.
http://hajoh.livejournal.com/890.ht
http://hajoh.livejournal.com/1723.html
http://hajoh.livejournal.com/1195.html
hajoh.livejournal.com
Прямой электролиз воды. Обеззараживание воды прямым электролизом / Статьи
Обеззараживание воды прямым электролизом
Что такое прямой электролиз воды?
Прохождение электрического тока через обрабатываемую воду сопровождается серией электрохимических реакций, в результате которых в воде образуются новые вещества, и изменяется структура межмолекулярных взаимодействий. При прямом электролизе воды происходит синтез окислителей – кислорода, озона, перекиси водорода и др. Кроме этого в воде даже с очень низким содержанием хлоридов при прямом электролизе образуется остаточный хлор, что очень важно для пролонгированного эффекта обеззараживания воды.
Теория процесса электролиза воды
В упрощенном виде прямой электролиз воды состоит из нескольких процессов.
1) Электрохимический процесс.
В воде (H2O) расположены параллельно две пластины (электроды): анод и катод. Напряжение постоянного тока, подаваемое на электроды, приводит к электролизу воды.
На аноде производится кислород: 2H2O → O2 + 4H+ + 4e− (вода подкисляется).
На катоде образуется водород: 2H2O + 2e− → H2 + 2OH− (вода подщелачивается).
Количество выделяющегося водорода незначительно и не является большой проблемой.
Использование специальных электродов позволяет производить из воды озон и перекись водорода.
На аноде производится озон: 3H2O → O3 + 6e− + 6H+ (вода подкисляется).
На катоде – перекись водорода: O2 + 2H2O + 2e− → H2O2 + 2OH− (вода подщелачивается).
Естественная пресная (не дистиллированная) вода всегда содержит минеральные соли – сульфаты, карбонаты, хлориды. В целях получения хлора для пролонгированного эффекта обеззараживания воды интересны только хлориды. В воде они представлены в основном хлоридом натрия (NaCl), хлоридом кальция (CaCl) и хлоридом калия (KCl).
На примере с хлоридом натрия реакция образования хлора электролизом будет следующей.
Соль, растворенная в воде: 2NaCl + H2O → 2Na+ +2Cl– + 2H2O
Во время электролиза на аноде формируется хлор: 2Cl– → Cl2+2e– (вода подкисляется).
А у катода образуется гидроокись натрия: Na+ + OH– → NaOH (вода подщелачивается).
Эта реакция является недолгой, поскольку любой хлор, произведенный у анода, быстро потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Подобные реакции электролиза происходят и с хлоридами кальция и калия.
Таким образом, в результате электролиза пресной воды генерируется смесь сильных окислителей: кислород + озон + перекись водорода + гипохлорит натрия.

2) Электромагнитный процесс.
Молекула воды представляет собой маленький диполь, содержащий положительный (со стороны водорода) и отрицательный (со стороны кислорода) заряды на полюсах. В электромагнитном поле водородная часть молекулы воды притягивается к катоду, а кислородная часть к аноду. Это приводит к ослаблению и даже разрыву водородных связей в молекуле воды. Ослабление водородных связей способствует образованию атомарного кислорода. Наличие в воде атомарного кислорода способствует уменьшению жесткости воды. В обычной воде всегда присутствует кальций. Ионы Са+ окисляются атомарным кислородом: Са+ + О → СаО. Окись кальция, соединяясь с водой, образует гидрат окиси кальция: СаО + Н2О → Са(ОН)2. Гидрат окиси кальция – сильное основание, хорошо растворимое в воде. Аналогичные процессы происходят и с другими элементами жесткости воды.
3) Процессы кавитации.
В результате электрохимического и электромагнитного процесса происходит образование микроскопических газовых пузырьков кислорода и водорода. Вблизи поверхности электродов появляется белесое облачко, состоящее из возникших пузырьков. Увлекаемые потоком воды, пузырьки смещаются в область, где скорость потока меньше, а давление выше, и происходит их схлопывание с большой скоростью.
Мгновенное схлопывание пузырька высвобождает огромную энергию, которая разрушает водную стенку пузырька, т.е. молекулы воды. Следствием разрушения молекулы воды является образование ионов водорода и кислорода, атомарных частиц водорода и кислорода, молекул водорода и кислорода, гидроксилов и других веществ.
Перечисленные процессы способствуют образованию основного окислителя – атомарного кислорода.
В чём уникальность прямого электролиза воды?
Обеззараживание воды прямым электролизом является разновидностью окислительной обработки воды, но кардинально отличается от распространенных методов обеззараживания тем, что окислители производятся из самой воды, а не вносятся извне и, выполнив свою функцию, переходят в прежнее состояние. Эффективность обеззараживания воды прямым электролизом в несколько раз выше по сравнению с химическими методами. Прямой электролиз воды способствует удалению цветности, сероводорода, аммония исходной воды. Для прямого электролиза не требуются дозирующие насосы и использование реагентов.
Хлор, необходимый для предотвращения вторичного бактериального загрязнения воды в распределительных сетях, активируется из естественных минеральных солей в воде, проходящей через электролизёр, и моментально растворяется в ней. Прямой электролиз разрушает хлорамины, преобразуя их в азот и соль.
Источник
Поделитесь в соц сетях:Последние статьи в блоге
ecolife-systems.com
Даёшь дешёвый водород. Найден упрощённый способ электролиза воды / Habr
Схема электролиза без мембраны: два параллельных электрода располагаются на расстоянии в несколько сотен микрометров
Не секрет, что чистый водород — один из наиболее перспективных видов альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду, что может быть прекраснее?
Проблема только в стоимости добычи водорода. Электролиз воды предполагает, что электроды погружаются в воду, а между ними находится полимерная мембрана. Ток идёт от катода к аноду, а на своём пути он (при помощи катализатора) расщепляет воду на кислород и водород. Полимерная мембрана выполняет важную функцию, разделяя получившиеся газы.
На сегодняшний в качестве мембраны с ионной проводимостью практически повсеместно используется нафион или другой тип мембраны. Но все они отличаются дороговизной и ограниченным сроком службы. К тому, мембраны требуют особых условий проведения электролиза. Например, нафион работает в жидкости только с низкой кислотностью и только с определёнными катализаторами.
Изобретение химиков из EPFL под руководством Деметри Псалтиса (Demetri Psaltis) позволяет избавиться от этих ограничений и намного удешевить электролиз воды.
Они провели ряд экспериментов с микроустройством, размещая электроды на разном расстоянии друг от друга и прогоняя между ними воду на разной скорости. Оказалось, что при определённом расстоянии между электродами H2 и O2 сами разлетаются в разные стороны, без всякой мембраны!
Причина такого поведения ионов — эффект Сегре-Зильберберга, когда при движении жидкости находящиеся в ней частицы поток уносит в стороны.
Учёные надеются, что им удастся приспособить прибор для работы с любыми видами жидких электролитов и любыми катализаторами, поскольку больше нет риска повреждения хрупкой мембраны. Исчезнут обязательные требования использовать только благородные металлы вроде платины из-за ограничений на кислотность (pH) жидкости.
Если получится масштабировать микроустройство до промышленного образца, то это кардинально снизит стоимость водорода, получаемого при электролизе воды.
Научная работа “A membrane-less electrolyzer for hydrogen production across the pH scale” опубликована в журнале “Energy & Environmental Science”, DOI: 10.1039/C5EE00083A (зеркало).
habr.com
