Электролиз воды – схема процесса, реакция
4.4
Средняя оценка: 4.4
Всего получено оценок: 225.
4.4
Средняя оценка: 4.4
Всего получено оценок: 225.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
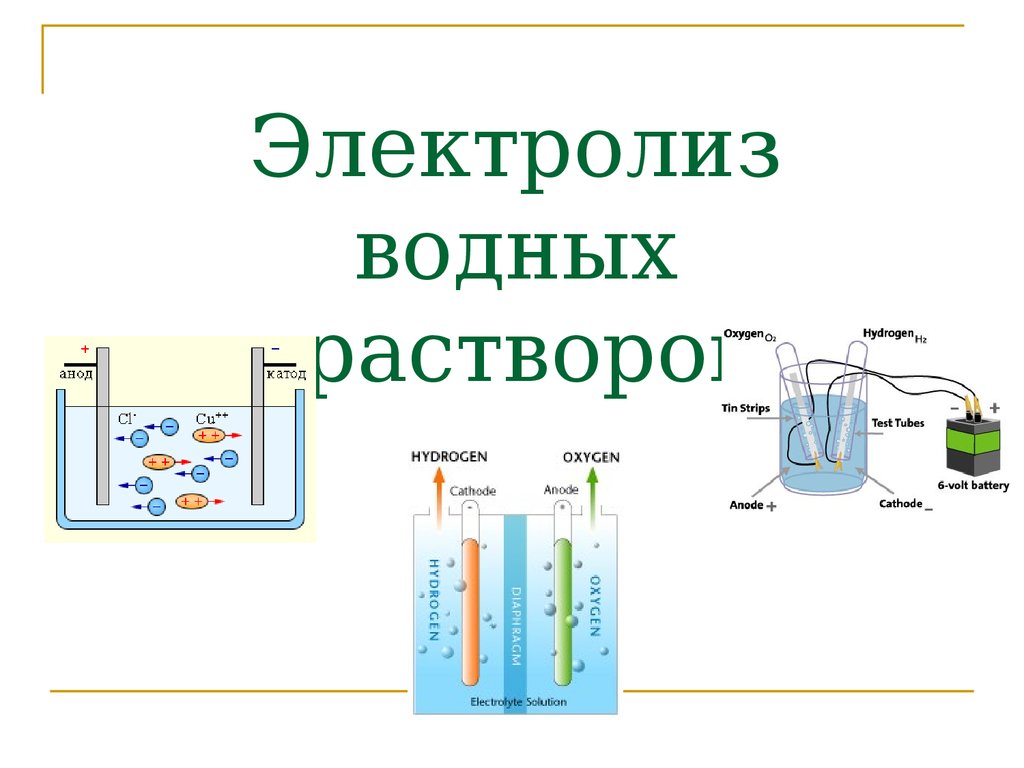
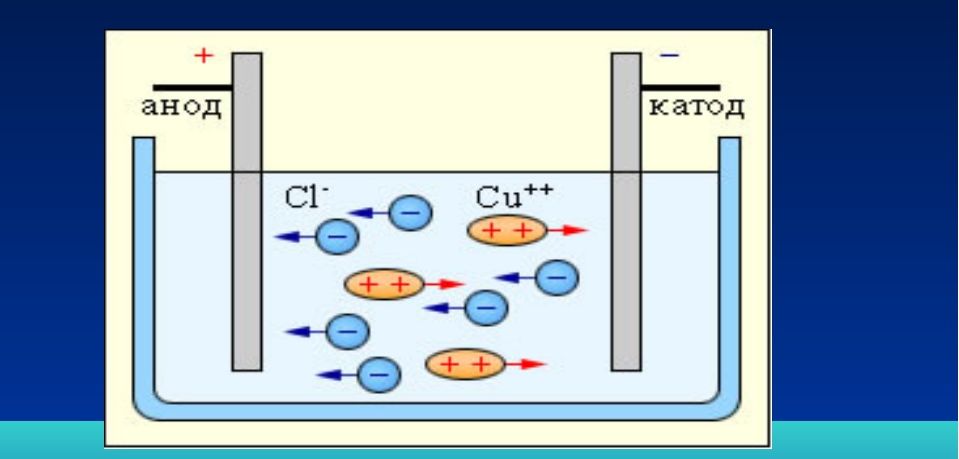
Рис. 1. Электролиты в растворе.Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
Или:
- анод:
3H2O → O3 + 6e– + 6H+;
- катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.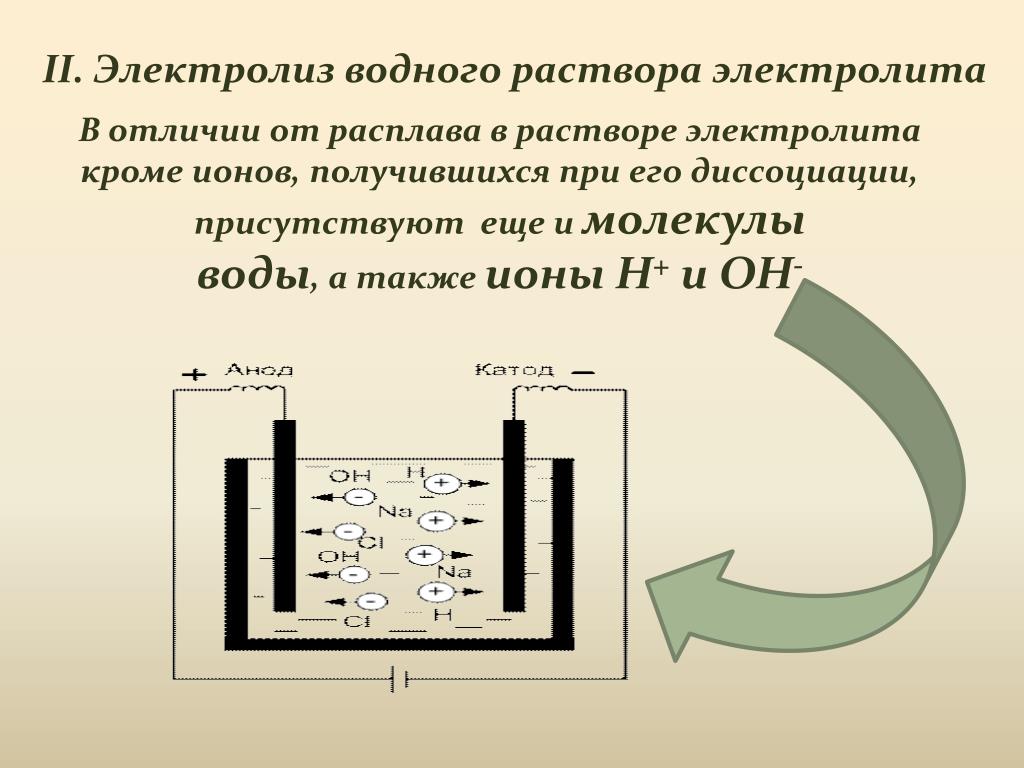
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ воды. На роль катиона электролита подходят:
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH– воды.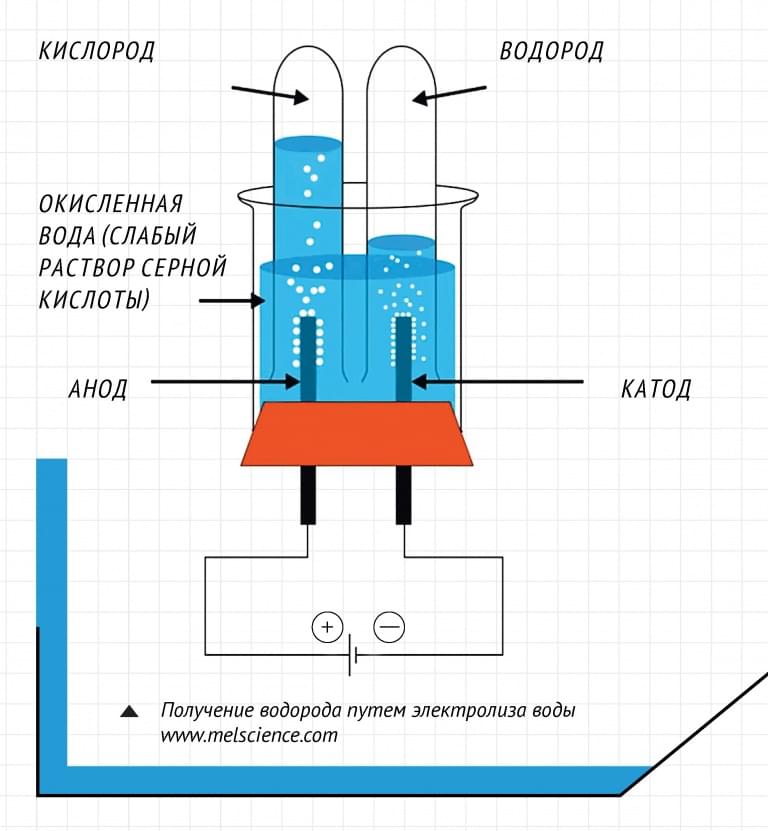 В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Ирина Лысых
5/5
Олег Гаврюшкин
5/5
Induction System
5/5
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 225.
А какая ваша оценка?
Электролиз воды — MEL Chemistry
Реагенты
- Гидроксид натрия
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.
- Снимите перчатки перед тем, как зажечь свечу (шаг 4).
- Проводите эксперимент на подносе.
- Держите поблизости емкость с водой во время работы с огнем.
- Не допускайте контакта легковоспламеняющихся предметов и волос с пламенем.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.

- Храните экспериментальный набор в месте, недоступном для детей младше 10 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым.
 Немедленно обратитесь к врачу.
Немедленно обратитесь к врачу. - В случае проглатывания реагентов промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
Рекомендации для родителей
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 10 лет и старше.

- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.
 е. после открытия упаковки.
е. после открытия упаковки.
Часто задаваемые вопросы
Раствор вытекает из пипетки. Что делать?
Прежде всего отсоедините держатель батареи от электролизёра и осторожно вылейте в колбу остатки NaOH. Затем отсоедините кабель от пипетки и протрите ее бумажным полотенцем. Возьмите из набора резиновое кольцо, наденьте его на штекер и снова вставьте штекер в пипетку. Если утечка устранена, продолжайте эксперимент. Если нет, возьмите из набора запасной электролизёр.
После подсоединения батареек ничего не происходит.
Убедитесь, что вы правильно соединили все зажимы и провода:
красный зажим-крокодил должен быть подключен ко внутреннему концу провода, а черный — ко внешнему; красный же провод должен соединяться с красным зажимом на держателе батареи, а черный провод — с черным зажимом. Если вы всё правильно собрали, но процесс не пошел, замените батарейки.
Штекер кабеля позеленел. Почему?
Почему?
В ходе электролиза протекают различные окислительно-восстановительные реакции, в результате которых медь (а она содержится в материале, из которого сделан штекер) может стать зеленой.
Смесь в пипетке пузырится. Это нормально?
Да, на эксперимент это не повлияет. Просто подождите, сколько указано в инструкции, и лишь затем переходите к следующему шагу!
Мы всё сделали по инструкции, но хлопка́ не было.
Ничего страшного! Пройдите все предыдущие шаги начиная с шага 2. На этот раз постарайтесь провести электролиз чуть дольше — так накопится больше газа. Подносите баночку к пламени быстро, близко иnbsp;неnbsp;переворачивая. Если «хлопо́к» так и не получится, поднесите баночку еще ближе к свече (горлышко может немного оплавиться) либо подержите баночку под другим углом.
Сколько раз можно наполнять баночку газом, чтобы затушить свечу?
Довольно много! Проверьте сами!
Другие эксперименты
Силикат кальция
Жиры
Медное зеркало
Разноцветное пламя
Пошаговая инструкция
Соберите установку для электрóлиза воды — электролизёр.
Наполните электролизер раствором гидроксида натрия NaOH.
Установите емкость для сбора гремучего газа и начните процесс электролиза воды.
Теперь попробуйте затушить свечу посредством реакции между водородом и кислородом.
Чтобы повторить опыт, подключите электролизер к батарейкам вновь и повторите шаги 3 и 4.
Ожидаемый результат
Под действием электричества вода распадается на кислород O2 и водород H2, причем водорода получается в два раза больше, чем кислорода. Такую смесь газов называют гремучей. И неспроста: если баночку с такой смесью поднести к горящей свече, гремучий газ тут же вспыхнет и задует свечу.
Утилизация
Твердые отходы эксперимента утилизируйте вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте ее водой.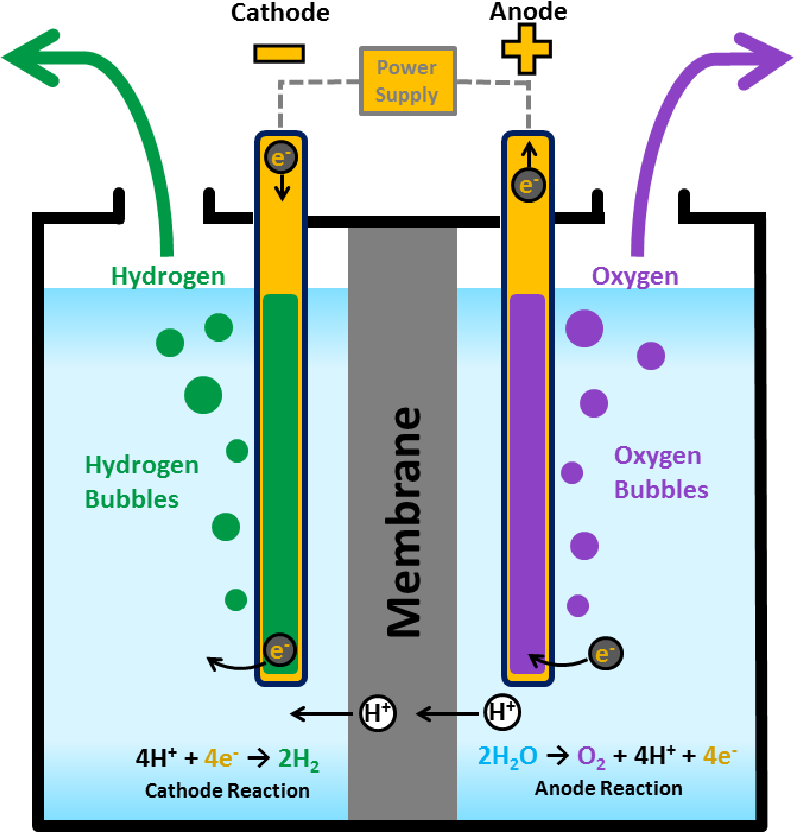
Что произошло
Молекулы воды H2O очень крепкие. Разрушить их может лишь большое количество энергии, например от батарейки . Под действием электричества прочные связи в молекулах воды разрываются, высвобождая из раствора кислородO2 и водород H2 , которые затем улетают из раствора.
Смесь газов H2 и O2 (в соотношении 2 к 1) неспроста называется гремучей: ее можно легко зажечь, например, пламенем свечи. Газы вступают в реакцию, которая сопровождается хлопко́м и выбросом энергии . Удивительно, но это та самая энергия, которая в начале потребовалась для разрушения молекул воды. Просто теперь она выделяется в иной форме. Так снова образуется вода H2O .
Как правило, этот метод применяют не ради воды, а ради энергии, например, при создании движущей силы в ракетных двигателях. Однако в больших масштабах эта реакция может быть весьма опасной.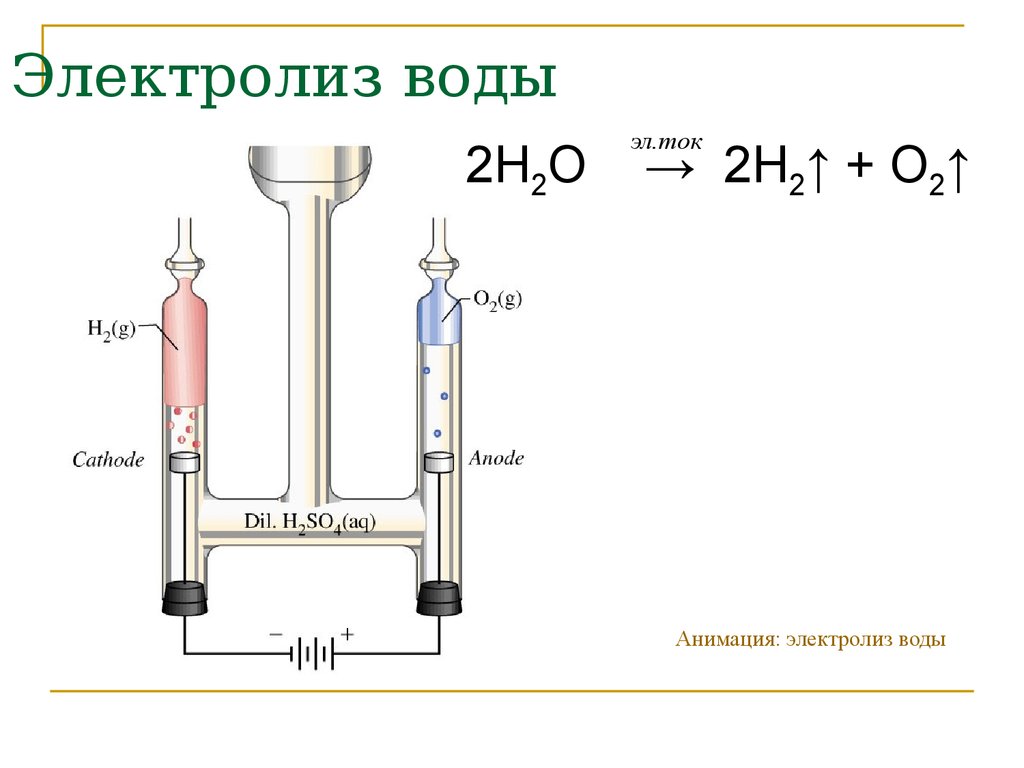 В 1937 году она сожгла дирижабль «Гинденбург» дотла. Летательный аппарат был наполнен 200 000 м3 водорода — когда тот прореагировал с кислородом воздуха, произошел мощнейший взрыв и образовалось более 150 тонн воды!
В 1937 году она сожгла дирижабль «Гинденбург» дотла. Летательный аппарат был наполнен 200 000 м3 водорода — когда тот прореагировал с кислородом воздуха, произошел мощнейший взрыв и образовалось более 150 тонн воды!
Узнать больше
С точки зрения химии, получить воду довольно просто:
2H2 + O2 → H2O
Однако всё несколько сложнее. На самом деле это окислительно-восстановительная реакция, в которой кислород является окислителем (принимает электроны у водорода), а водород — восстановителем (отдает свои электроны кислороду):
O20 + 4e → 2O2−
H20 − 2e → 2H+
Эта реакция протекает довольно бурно, особенно если кислород смешивается с водородом в соотношении 1:2, как в нашем эксперименте. Всё дело в образующемся водяном паре: он содержит один атом кислорода и два атома водорода, то есть соотношение снова 1 к 2!
Как протекает процесс электролиза?
Чтобы в этом разобраться, для начала рассмотрим, что происходит внутри исходного раствора в электролизёре.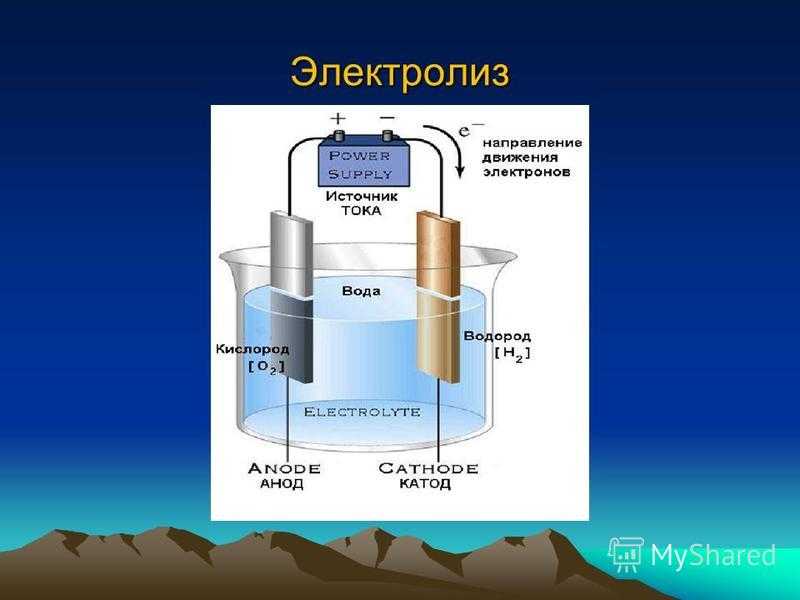 {−}. Еще в электролизёре есть отрицательно заряженный катод — он притягивает положительно заряженные ионы (в частности, H+ ).
{−}. Еще в электролизёре есть отрицательно заряженный катод — он притягивает положительно заряженные ионы (в частности, H+ ).
Ионы OH− и H+ движутся к соответствующим частям электролизёра, где ионы H+ принимают электроны у катода и превращаются в водород H2 , а гидроксид-ионы OH− отдают свои электроны аноду и превращаются в кислород O2 .
В нашем опыте электролизёр представляет собой кабель типа RCA (его еще называют «тюльпаном»). В нем металлический обод — это катод, а головка — анод. Впрочем, полюса можно и поменять, подключив провода штекера и держателя батареи в обратном порядке — на ход эксперимента это никак не повлияет.
Что такое кабель RCA?
Сейчас кабели RCA встречаются довольно редко, а вот раньше их часто использовали для подключения аудио- и видеосистем. Например, с помощью такого кабеля соединяли видеомагнитофон с телевизором. Кабель RCA состоит из разделенных пластиковым кольцом металлических частей: внешнего обода и стержня-головки.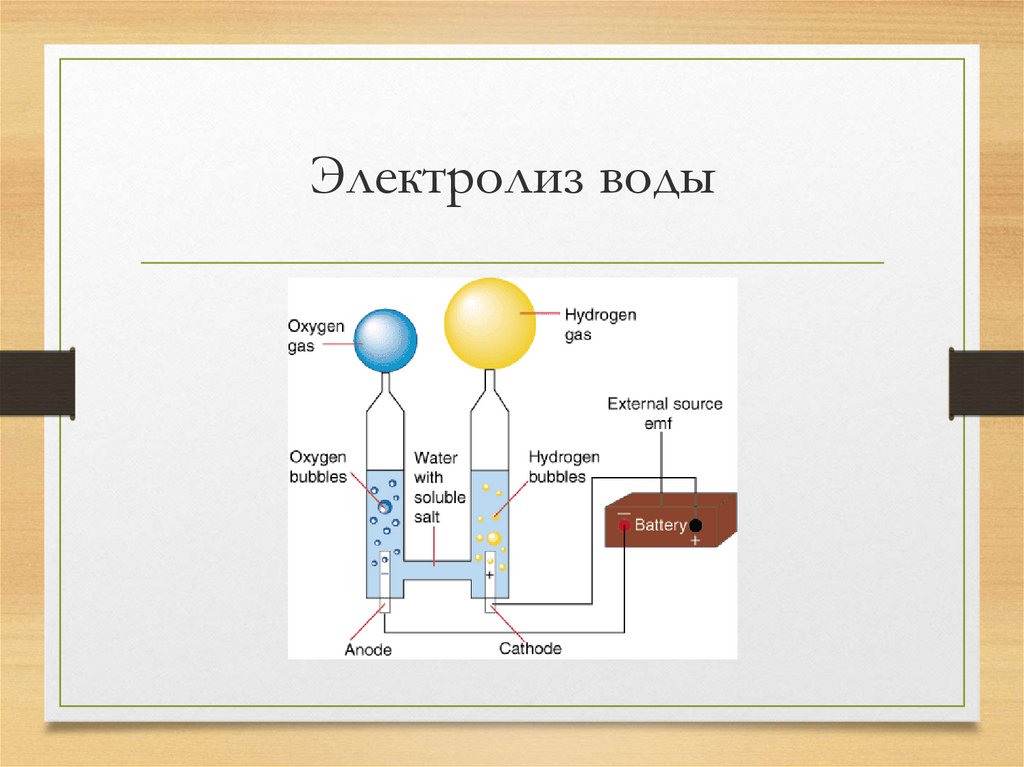 Отдельные провода подсоединены к каждой металлической части: короткие провода соединены с металлическим ободом, а более длинные — с головкой.
Отдельные провода подсоединены к каждой металлической части: короткие провода соединены с металлическим ободом, а более длинные — с головкой.
Эксперимент по электролизу воды | Научный проект
Научный проект
Энергия хранится в связях молекул. Когда эти связи распадаются, освобождающаяся энергия может быть использована для совершения работы. Разделение молекул жидкой воды на водород и газообразный кислород создает огромное количество энергии, которую можно превратить в полезную электроэнергию для питания наших домов и автомобилей.
Чтобы разорвать эти связи, требуется некоторое количество энергии, чтобы атомы в молекулах воды стали достаточно активными, чтобы отделиться друг от друга. Дома мы можем обеспечить эту энергию с помощью батареи. Все аккумуляторы имеют две клеммы или , или концы: положительную клемму и отрицательную клемму. Затем вода соединяет эти терминалы, поэтому энергия может течь между ними. Когда электричество проходит через воду, оно расщепляет воду!
Затем вода соединяет эти терминалы, поэтому энергия может течь между ними. Когда электричество проходит через воду, оно расщепляет воду!
Скачать проект
Чистая вода сама по себе не является хорошим проводником электричества, поэтому для этого эксперимента будет добавлена пищевая сода, чтобы сделать раствор электролитом. Электролит — это часть раствора, которая может быть разрушена электролизом. Электро относится к энергии и электричеству, а — лизис относится к расщеплению. Электролиты важны как в батареях, так и в нашем организме!
Какой электролит лучше всего проводит электричество при электролизе воды?
- Дистиллированная вода
- Водопроводная вода
- 2 кнопки серебристого цвета
- Батарея 9 В
- Небольшой прозрачный пластиковый контейнер (отлично подойдет пластиковый контейнер для соуса на вынос из ресторана)
- 2 пробирки
- Секундомер
- Пищевая сода
- Поваренная соль
- Лимон
- Средство для мытья посуды
- Вставьте кнопки для пальцев в дно пластикового контейнера так, чтобы их кончики упирались в контейнер.
 Разместите их так, чтобы они находились на таком же расстоянии друг от друга, как два терминала 9батарея В. Будьте осторожны, чтобы не уколоться!
Разместите их так, чтобы они находились на таком же расстоянии друг от друга, как два терминала 9батарея В. Будьте осторожны, чтобы не уколоться! - Поместите пластиковый контейнер с кнопками на клеммы аккумулятора. Если чашка слишком велика, чтобы балансировать на батарее, найдите, на что поставить ее: между двумя книгами, стопкой стикеров и т. д.
- Медленно наполните контейнер дистиллированной водой. Если кнопки двигаются, используйте эту возможность, чтобы исправить их, прежде чем продолжить. Будет ли дистиллированная вода сама по себе проводить электричество? Попытайся!
- Добавьте щепотку пищевой соды.
- Держите две пробирки над каждой канцелярской кнопкой, чтобы собрать образующийся газ. Запишите свои наблюдения. Что происходит? В одной трубке больше газа, чем в другой? Как вы думаете, какие газы образуются?
- Сбросьте раствор и повторите процедуру с другой комбинацией:
- Дистиллированная вода и лимонный сок
- Дистиллированная вода и поваренная соль
- Дистиллированная вода и средство для мытья посуды
- Дистиллированная вода (без добавок)
- Водопроводная вода (Работает ли водопроводная вода? Если да, то почему?)
Дистиллированная вода не проводит ток, в то время как водопроводная вода проводит небольшой ток. Раствор с пищевой содой облегчит хороший электролиз. Лучше всего облегчит электролиз раствор с поваренной солью.
Раствор с пищевой содой облегчит хороший электролиз. Лучше всего облегчит электролиз раствор с поваренной солью.
Пищевая сода, известная химикам как бикарбонат натрия (NaHCO3), сама по себе не является электролитом. Помните — это должно быть в растворе! При растворении в воде он пропускает ток через воду между клеммами батареи. В водном растворе пищевой соды образуется 9 газов.0009 водород (H 2 ), кислород (O 2 ) и углекислый газ (CO 2 ).
Поваренная соль, или хлорид натрия (NaCl), также является хорошей добавкой для образования электролитов. В воде соль распадается на ионы Na + и Cl — , которые очень хорошо переносят ток , или поток электрических зарядов. В водно-солевом растворе образуются газы водород, кислород и газообразный хлор (Cl 2 ) — вы не хотите вдыхать это вещество!
Лимонный сок — хороший электролит, потому что это кислота. Кислота диссоциирует в воде, и ток будет переноситься ионами. Дистиллированная вода сама по себе не будет проводить ток. Однако водопроводная вода часто способна проводить ток из-за минералов и примесей (не волнуйтесь! Эти вещи не вредны для вас!).
Кислота диссоциирует в воде, и ток будет переноситься ионами. Дистиллированная вода сама по себе не будет проводить ток. Однако водопроводная вода часто способна проводить ток из-за минералов и примесей (не волнуйтесь! Эти вещи не вредны для вас!).
В результате каждой реакции образуется различное количество газа, потому что каждая реакция несет разное количество тока. Количество произведенного газа прямо пропорционально току, который течет в системе.
Отказ от ответственности и меры предосторожности
Education.com предоставляет идеи проекта научной ярмарки для ознакомления
только цели. Education.com не дает никаких гарантий или заявлений
относительно идей проекта научной ярмарки и не несет ответственности за
любые убытки или ущерб, прямо или косвенно вызванные использованием вами таких
Информация. Получая доступ к идеям проекта научной ярмарки, вы отказываетесь и
отказаться от любых претензий к Education.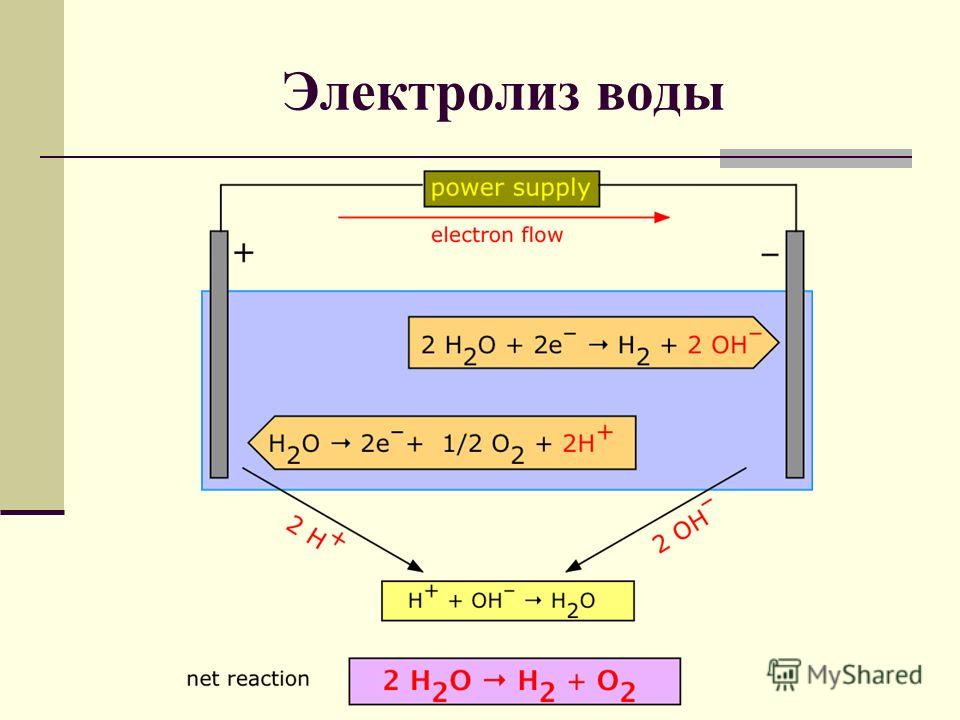 com, возникающих в связи с этим. Кроме того, ваш
доступ к веб-сайту Education.com и проектным идеям научной ярмарки покрывается
Политика конфиденциальности Education.com и Условия использования сайта, включая ограничения
об ответственности Education.com.
com, возникающих в связи с этим. Кроме того, ваш
доступ к веб-сайту Education.com и проектным идеям научной ярмарки покрывается
Политика конфиденциальности Education.com и Условия использования сайта, включая ограничения
об ответственности Education.com.
Настоящим предупреждаем, что не все проектные идеи подходят для всех отдельных лиц или во всех обстоятельствах. Реализация любой идеи научного проекта следует проводить только в соответствующих условиях и с соответствующими родителями. или другой надзор. Чтение и соблюдение мер предосторожности всех материалы, используемые в проекте, является исключительной ответственностью каждого человека. За дополнительную информацию см. в справочнике по научной безопасности вашего штата.
Крупнотоннажное производство водорода электролизом воды: технико-экономическая и экологическая оценка
Крупномасштабное производство водорода
с помощью электролиза воды : технико-экономическая и экологическая оценка†Том Терлоу, * аб христианин Бауэр, * и Рассел МакКенна компакт-диск а также Марко Маццотти б
Принадлежности автора
* Соответствующие авторы
и Группа оценки технологий, Лаборатория анализа энергетических систем, Институт Пауля Шеррера, 5232 Villigen PSI, Швейцария
Электронная почта: tom. [email protected], [email protected]
[email protected], [email protected]
б Институт энергетики и технологических процессов, ETH Zürich, Цюрих 8092, Швейцария
с Кафедра анализа энергетических систем, факультет машиностроения и технологического проектирования, ETH Zürich, Цюрих 8092, Швейцария
д Лаборатория анализа энергетических систем, 5232 Villigen PSI, Швейцария
Аннотация
rsc.org/schema/rscart38″> Низкоуглеродистый (зеленый) водород может быть получен с помощью электролиза воды с использованием фотоэлектрической энергии, энергии ветра, гидроэнергии или электроэнергии из обезуглероженной сети. В этой работе количественно оцениваются текущие и будущие затраты, а также воздействие на окружающую среду крупномасштабных систем производства водорода на географических островах, которые демонстрируют высокий потенциал возобновляемых источников энергии и могут выступать в качестве центров экспорта водорода. Рассматриваются различные конфигурации производства водорода с учетом ежедневной производительности водорода 10 тонн, затрат на производство водорода, выбросов парниковых газов в течение жизненного цикла, использования материалов и преобразования земли. Результаты показывают, что затраты на производство электролитического водорода составляют 3,7 евро за кг H 9 .0176 2 доступны уже сегодня, и что снижение до 2 евро за кг H 2 в 2040 году вероятно, что, следовательно, приближается к паритету затрат с водородом из риформинга природного газа даже при применении «исторических» цен на природный газ. Недавний скачок цен на природный газ показывает, что паритет стоимости между зеленым и серым водородом может быть достигнут уже сегодня. Производство водорода с помощью электролиза воды с низкими затратами и низким уровнем выбросов парниковых газов в настоящее время возможно только в очень определенных местах. Гибридные конфигурации с использованием различных вариантов электроснабжения демонстрируют наилучшие экономические показатели в сочетании с низкой нагрузкой на окружающую среду. Автономные системы производства водорода особенно эффективны для производства низкоуглеродного водорода, хотя производство компонентов системы большего размера может привести к значительным экологическим нагрузкам и инвестициям. Некоторые материалы (особенно иридий) и доступность земли могут быть ограничивающими факторами при расширении производства зеленого водорода с помощью электролизеров с мембраной из полимерного электролита (ПЭМ). Это означает, что лица, принимающие решения, должны учитывать аспекты, помимо затрат и выбросов парниковых газов, при проектировании крупномасштабных систем производства водорода, чтобы избежать рисков, связанных, например, с поставкой дефицитных материалов.
Недавний скачок цен на природный газ показывает, что паритет стоимости между зеленым и серым водородом может быть достигнут уже сегодня. Производство водорода с помощью электролиза воды с низкими затратами и низким уровнем выбросов парниковых газов в настоящее время возможно только в очень определенных местах. Гибридные конфигурации с использованием различных вариантов электроснабжения демонстрируют наилучшие экономические показатели в сочетании с низкой нагрузкой на окружающую среду. Автономные системы производства водорода особенно эффективны для производства низкоуглеродного водорода, хотя производство компонентов системы большего размера может привести к значительным экологическим нагрузкам и инвестициям. Некоторые материалы (особенно иридий) и доступность земли могут быть ограничивающими факторами при расширении производства зеленого водорода с помощью электролизеров с мембраной из полимерного электролита (ПЭМ). Это означает, что лица, принимающие решения, должны учитывать аспекты, помимо затрат и выбросов парниковых газов, при проектировании крупномасштабных систем производства водорода, чтобы избежать рисков, связанных, например, с поставкой дефицитных материалов.