Управление шаговым двигателем | Электроника для всех
Рано или поздно, при постройке робота, возникнет нужда в точных перемещениях, например, когда захочется сделать манипулятор. Вариантов тут два — сервопривод, с обратными связями по току, напряжению и координате, либо шаговый привод. Сервопривод экономичней, мощней, но при этом имеет весьма нетривиальную систему управления и под силу далеко не всем, а вот шаговый двигатель это уже ближе к реальности.Шаговый двигатель это, как понятно из его названия, двигатель который вращается дискретными перемещениями. Достигается это за счет хитрой формы ротора и двух (реже четырех) обмоток. В результате чего, путем чередования направления напряжения в обмотках можно добиться того, что ротор будет по очереди занимать фиксированные значения.
В среднем, у шагового двигателя на один оборот вала, приходится около ста шагов. Но это сильно зависит от модели двигателя, а также от его конструкции.
Один из недостатков шаговиков, по крайней мере для меня, это довольно большой ток. Так как на обмотки напруга подается все время, а такого явления как противоЭДС в нем, в отличии от коллекторных двигателей, не наблюдается, то, по сути дела, мы нагружаемся на активное сопротивление обмоток, а оно невелико. Так что будь готов к тому, что придется городить мощный драйвер на MOSFET транзисторах или затариваться спец микросхемами.
Типы шаговых двигателей
Если не углубляться во внутреннюю конструкцию, число шагов и прочие тонкости, то с пользовательской точки зрения существует три типа:
- Биполярный — имеет четыре выхода, содержит в себе две обмотки.

- Униполярный — имеет шесть выходов. Содержит в себе две обмотки, но каждая обмотка имеет отвод из середины.
- Четырехобмоточный — имеет четыре независимые обмотки. По сути дела представляет собой тот же униполярник, только обмотки его разделены. Вживую не встречал, только в книжках.
Где взять шаговый двигатель.
Вообще шаговики встречаются много где.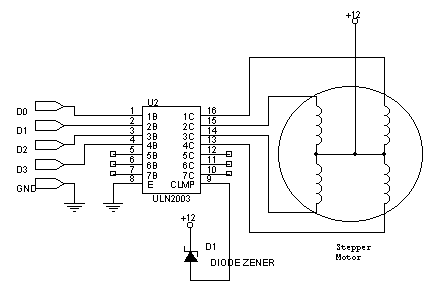 Самое хлебное место — пятидюймовые дисководы и старые матричные принтеры. Еще ими можно поживиться в древних винчестерах на 40Мб, если, конечно, рука поднимется покалечить такой антиквариат.
Самое хлебное место — пятидюймовые дисководы и старые матричные принтеры. Еще ими можно поживиться в древних винчестерах на 40Мб, если, конечно, рука поднимется покалечить такой антиквариат.
А вот в трехдюймовых флопарях нас ждет облом — дело в том, что там шаговик весьма ущербной конструкции — у него только один задний подшипник, а передним концом вал упирается в подшипник закрепленный на раме дисковода. Так что юзать его можно только в родном креплении. Либо городить высокоточную крепежную конструкцию. Впрочем, тебе может повезет и ты найдешь нетипичный флопарь с полноценным движком.
Схема управления шаговым двигателем
Я разжился контроллерами шаговиков L297 и мощным сдвоенным мостом L298N.
Лирическое отступление, при желании можно его пропустить
Именно на нем был сделан мой первый силовой блок робота. Кроме него там еще два источника питания на 5 и на 3.3 вольта, а также контроллер двух движков на L293 (такой же как и во второй реализации силового блока). В качестве контроллера тогда был выбран АТ89С2051. Это антикварный контроллер архитектуры MSC-51 в котором из периферии только два таймера, порты да UART, но я его люблю нежно и трепетно, так как первая любовь не проходит никогда =). К сожалению исходники его мега прошивки канули в Лету вместе с убившимся винтом, так что я не могу поделиться теми извращенскими алгоритмами, которые были туда засунуты. А там был и двухканальный ШИМ, и I2C Slave протокол, и контроль за положением шаговика с точным учетом его перемещения. Короче, знатный был проект. Ныне валяется трупом, т.к. все лень запустить Keil uVision и написать новую прошивку. Да и ассемблер С51 я стал уже забывать.
В качестве контроллера тогда был выбран АТ89С2051. Это антикварный контроллер архитектуры MSC-51 в котором из периферии только два таймера, порты да UART, но я его люблю нежно и трепетно, так как первая любовь не проходит никогда =). К сожалению исходники его мега прошивки канули в Лету вместе с убившимся винтом, так что я не могу поделиться теми извращенскими алгоритмами, которые были туда засунуты. А там был и двухканальный ШИМ, и I2C Slave протокол, и контроль за положением шаговика с точным учетом его перемещения. Короче, знатный был проект. Ныне валяется трупом, т.к. все лень запустить Keil uVision и написать новую прошивку. Да и ассемблер С51 я стал уже забывать.
Схема включения L298N+L297 до смешного проста — надо тупо соединить их вместе. Они настолько созданы друг для друга, что в даташите на L298N идет прямой отсыл к L297, а в доке на L297 на L298N.
Осталось только подключить микроконтроллер.
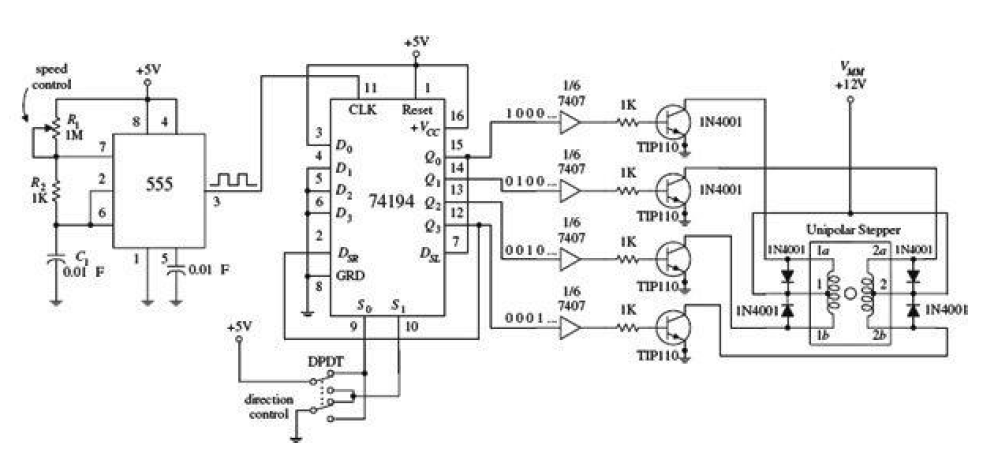
- На вход CW/CCW подаем направление вращения — 0 в одну сторону, 1 — в другую.
- на вход CLOCK — импульсы. Один импульс — один шаг.
- вход HALF/FULL задает режим работы — полный шаг/полушаг
- RESET сбрасывает драйвер в дефолтное состояние ABCD=0101.
- CONTROL определяет каким образом задается ШИМ, если он в нуле, то ШИМ образуется посредством выходов разрешения INh2 и INh3, а если 1 то через выходы на драйвер ABCD. Это может пригодится, если вместо L298 у которой есть куда подключать входы разрешения INh2/INh3 будет либо самодельный мост на транзисторах, либо какая-либо другая микросхема.
- На вход Vref надо подать напряжение с потенциометра, которое будет определять максимальную перегрузочную способность. Подашь 5 вольт — будер работать на пределе, а в случае перегрузки сгорит L298, подашь меньше — при предельном токе просто заглохнет.

Если же на защиту пофигу, то можешь заодно и резисторы, висящие на выходе sense выкинуть нафиг. Это токовые шунты, с них L297 узнает какой ток течет через драйвер L298 и решает сдохнет он и пора отрубать или еще протянет. Там нужны резисторы помощней, учитывая что ток через драйвер может достигать 4А, то при рекомендуемом сопротивлении в 0.5 Ом, будет падение напряжения порядка 2 вольт, а значит выделяемая моща будет около 4*2=8 Вт — для резистора огого! Я поставил двухваттные, но у меня и шаговик был мелкий, не способный схавать 4 ампера.
 Если же их покупать, то на L6208 получается даже чуть дешевле.
Если же их покупать, то на L6208 получается даже чуть дешевле.Документация по микросхемам:
Kottada | www.visitportugal.com
Kottada
Рестораны и кафе
Контакты
ru
Мнение пользователей
Для того, чтобы оставить комментарий, необходимо пройти логин.
Вместимость
: 70
Номера для некурящих
Место для курения
Автостоянка
Бронирование:
Необходимо
Рекомендуемая цена
: $$$ (20€ — 30€)
Принимаются кредитные карты
Как добраться
Тип транспорта На автомобиле или мотоциклеПешком
Пункт отправления
. ..AbrantesÁguedaAguiar da BeiraAlandroalAlbergaria-a-VelhaAlbufeiraAlcácer do SalAlcanenaAlcobaçaAlcocheteAlcoutimAlenquerAlfândega da FéAlijóAljezurAljustrelAlmadaAlmancilAlmeidaAlmeirimAlmodôvarAlpiarçaAlteAlter do ChãoAlvaiázereAlvitoAmadoraAmaranteAmaresAnadiaAngra do HeroísmoAnsiãoArcos de ValdevezArganilArmação de PêraArmamarAroucaArraiolosArronchesArruda dos VinhosAveiroAvisAzambujaBaiãoBarcelosBarrancosBarreiroBatalhaBejaBelmonteBenaventeBombarralBorbaBoticasBragaBragançaBuçacoCabeceiras de BastoCadavalCaldas da RainhaCaminhaCampo MaiorCantanhedeCarrazeda de AnsiãesCarregal do SalCartaxoCascaisCastanheira de PêraCastelo BrancoCastelo de PaivaCastelo de VideCastelo MendoCastelo NovoCastelo RodrigoCastro DaireCastro MarimCastro VerdeCelorico da BeiraCelorico de BastoChamuscaChavesCinfãesCoimbraCondeixa-a-NovaConímbrigaConstânciaCorucheCosta de CaparicaCovilhãCratoCubaCuriaElvasEntroncamentoEriceiraEspinhoEsposendeEstarrejaEstorilEstremozÉvoraFafeFaroFátimaFelgueirasFerreira do AlentejoFerreira do ZêzereFigueira da FozFigueira de Castelo RodrigoFigueiró dos VinhosFornos de AlgodresFreixo de Espada à CintaFronteiraFunchalFundãoGaviãoGóisGolegãGondomarGouveiaGrândolaGuardaGuimarãesHortaIdanha-a-NovaIdanha-a-VelhaIlha da GraciosaIlha da MadeiraIlha das FloresIlha de Porto SantoIlha de Santa MariaIlha de São JorgeIlha de São MiguelIlha do CorvoIlha do FaialIlha do PicoIlha TerceiraÍlhavoLagoaLagosLamegoLeiriaLinhares da BeiraLisboaLouléLouresLourinhãLousãLousadaLusoMaçãoMacedo de CavaleirosMafraMaiaMangualdeManteigasMarco de CanavesesMarialvaMarinha GrandeMarvãoMatosinhosMealhadaMedaMelgaçoMelidesMértolaMesão FrioMiraMiranda do CorvoMiranda do DouroMirandelaMogadouroMoimenta da BeiraMoitaMoledo do MinhoMonçãoMonchiqueMondim de BastoMonforteMonfortinhoMonsantoMonsarazMontalegreMonte GordoMonte RealMontemor-o-NovoMontemor-o-VelhoMontijoMoraMortáguaMouraMourãoMurçaMurtosaNazaréNelasNisaÓbidosOdemiraOdivelasOeirasOleirosOlhãoOliveira de AzeméisOliveira de FradesOliveira do BairroOliveira do HospitalOurémOuriqueOvarPaços de FerreiraPalmelaPampilhosa da SerraParedesParedes de CouraPedrogão GrandePenacovaPenafielPenalva do CasteloPenamacorPenedonoPenelaPenichePeso da RéguaPinhãoPinhelPiódãoPombalPonta DelgadaPonte da BarcaPonte de LimaPonte de SorPortalegrePortelPortimãoPortoPorto CovoPorto de MósPóvoa de LanhosoPóvoa de VarzimProença-a-NovaQuarteiraRedondoReguengos de MonsarazResendeRibeira de PenaRio MaiorSabrosaSabugalSagresSalvaterra de MagosSanta Comba DãoSanta Maria da FeiraSanta Marta de PenaguiãoSantarémSantiago do CacémSanto TirsoSão Brás de AlportelSão João da MadeiraSão João da PesqueiraSão Martinho do PortoSão Pedro do SulSardoalSátãoSeiaSeixalSernancelheSerpaSertãSesimbraSetúbalSever do VougaSilvesSinesSintraSobral de Monte AgraçoSortelhaSoureSouselTábuaTabuaçoTaroucaTaviraTerras de BouroTomarTondelaTorre de MoncorvoTorres NovasTorres VedrasTrancosoTrofaTróiaVagosVale de CambraValençaValongoValpaçosVendas NovasViana do AlentejoViana do CasteloVidagoVidigueiraVieira do MinhoVila de ReiVila do BispoVila do CondeVila FlorVila Franca de XiraVila Nova da BarquinhaVila Nova de CerveiraVila Nova de FamalicãoVila Nova de Foz CôaVila Nova de GaiaVila Nova de MilfontesVila Nova de PaivaVila Nova de PoiaresVila Pouca de AguiarVila Praia de ÂncoraVila RealVila Real de Santo AntónioVila Velha de RódãoVila VerdeVila ViçosaVilamouraVimiosoVinhaisViseuVizelaVouzelaZambujeira do Mar
..AbrantesÁguedaAguiar da BeiraAlandroalAlbergaria-a-VelhaAlbufeiraAlcácer do SalAlcanenaAlcobaçaAlcocheteAlcoutimAlenquerAlfândega da FéAlijóAljezurAljustrelAlmadaAlmancilAlmeidaAlmeirimAlmodôvarAlpiarçaAlteAlter do ChãoAlvaiázereAlvitoAmadoraAmaranteAmaresAnadiaAngra do HeroísmoAnsiãoArcos de ValdevezArganilArmação de PêraArmamarAroucaArraiolosArronchesArruda dos VinhosAveiroAvisAzambujaBaiãoBarcelosBarrancosBarreiroBatalhaBejaBelmonteBenaventeBombarralBorbaBoticasBragaBragançaBuçacoCabeceiras de BastoCadavalCaldas da RainhaCaminhaCampo MaiorCantanhedeCarrazeda de AnsiãesCarregal do SalCartaxoCascaisCastanheira de PêraCastelo BrancoCastelo de PaivaCastelo de VideCastelo MendoCastelo NovoCastelo RodrigoCastro DaireCastro MarimCastro VerdeCelorico da BeiraCelorico de BastoChamuscaChavesCinfãesCoimbraCondeixa-a-NovaConímbrigaConstânciaCorucheCosta de CaparicaCovilhãCratoCubaCuriaElvasEntroncamentoEriceiraEspinhoEsposendeEstarrejaEstorilEstremozÉvoraFafeFaroFátimaFelgueirasFerreira do AlentejoFerreira do ZêzereFigueira da FozFigueira de Castelo RodrigoFigueiró dos VinhosFornos de AlgodresFreixo de Espada à CintaFronteiraFunchalFundãoGaviãoGóisGolegãGondomarGouveiaGrândolaGuardaGuimarãesHortaIdanha-a-NovaIdanha-a-VelhaIlha da GraciosaIlha da MadeiraIlha das FloresIlha de Porto SantoIlha de Santa MariaIlha de São JorgeIlha de São MiguelIlha do CorvoIlha do FaialIlha do PicoIlha TerceiraÍlhavoLagoaLagosLamegoLeiriaLinhares da BeiraLisboaLouléLouresLourinhãLousãLousadaLusoMaçãoMacedo de CavaleirosMafraMaiaMangualdeManteigasMarco de CanavesesMarialvaMarinha GrandeMarvãoMatosinhosMealhadaMedaMelgaçoMelidesMértolaMesão FrioMiraMiranda do CorvoMiranda do DouroMirandelaMogadouroMoimenta da BeiraMoitaMoledo do MinhoMonçãoMonchiqueMondim de BastoMonforteMonfortinhoMonsantoMonsarazMontalegreMonte GordoMonte RealMontemor-o-NovoMontemor-o-VelhoMontijoMoraMortáguaMouraMourãoMurçaMurtosaNazaréNelasNisaÓbidosOdemiraOdivelasOeirasOleirosOlhãoOliveira de AzeméisOliveira de FradesOliveira do BairroOliveira do HospitalOurémOuriqueOvarPaços de FerreiraPalmelaPampilhosa da SerraParedesParedes de CouraPedrogão GrandePenacovaPenafielPenalva do CasteloPenamacorPenedonoPenelaPenichePeso da RéguaPinhãoPinhelPiódãoPombalPonta DelgadaPonte da BarcaPonte de LimaPonte de SorPortalegrePortelPortimãoPortoPorto CovoPorto de MósPóvoa de LanhosoPóvoa de VarzimProença-a-NovaQuarteiraRedondoReguengos de MonsarazResendeRibeira de PenaRio MaiorSabrosaSabugalSagresSalvaterra de MagosSanta Comba DãoSanta Maria da FeiraSanta Marta de PenaguiãoSantarémSantiago do CacémSanto TirsoSão Brás de AlportelSão João da MadeiraSão João da PesqueiraSão Martinho do PortoSão Pedro do SulSardoalSátãoSeiaSeixalSernancelheSerpaSertãSesimbraSetúbalSever do VougaSilvesSinesSintraSobral de Monte AgraçoSortelhaSoureSouselTábuaTabuaçoTaroucaTaviraTerras de BouroTomarTondelaTorre de MoncorvoTorres NovasTorres VedrasTrancosoTrofaTróiaVagosVale de CambraValençaValongoValpaçosVendas NovasViana do AlentejoViana do CasteloVidagoVidigueiraVieira do MinhoVila de ReiVila do BispoVila do CondeVila FlorVila Franca de XiraVila Nova da BarquinhaVila Nova de CerveiraVila Nova de FamalicãoVila Nova de Foz CôaVila Nova de GaiaVila Nova de MilfontesVila Nova de PaivaVila Nova de PoiaresVila Pouca de AguiarVila Praia de ÂncoraVila RealVila Real de Santo AntónioVila Velha de RódãoVila VerdeVila ViçosaVilamouraVimiosoVinhaisViseuVizelaVouzelaZambujeira do Mar
É necessário seleccionar um ponto de partida.
Интерфейсные модули Siemens SIMATIC S7-400 IM460, IM461, IM463 построения, организации связи
6ES7460-0AA01-0AB0
SIMATIC S7-400, IM 460-0, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПЕРЕДАТЧИК, ДЛЯ СИСТЕМ ЛОКАЛЬНОГО ВВОДА-ВЫВОДА, БЕЗ ЦЕПЕЙ ПИТАНИЯ, С K-ШИНОЙ
Альтернативный код заказа (артикул) — 6ES74600AA010AB0
6ES7460-1BA01-0AB0
SIMATIC S7-400, IM 460-1, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПЕРЕДАТЧИК, ДЛЯ СИСТЕМ ЛОКАЛЬНОГО ВВОДА-ВЫВОДА, С ЦЕПЯМИ ПИТАНИЯ, БЕЗ K-ШИНЫ
Альтернативный код заказа (артикул) — 6ES74601BA010AB0
6ES7460-3AA01-0AB0
SIMATIC S7-400, IM 460-3, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПЕРЕДАТЧИК, ДЛЯ СИСТЕМ РАСПРЕДЕЛЕННОГО ВВОДА-ВЫВОДА, ДЛИНА ЛИНИИ СВЯЗИ ДО 102M, С K-ШИНОЙ
Альтернативный код заказа (артикул) — 6ES74603AA010AB0
6ES7461-0AA00-7AA0
SIMATIC S7-400, ТЕРМИНАЛЬНЫЙ РЕЗИСТОР ДЛЯ ИНТЕРФЕЙСНОГО МОДУЛЯ IM 461-0
Альтернативный код заказа (артикул) — 6ES74610AA007AA0
6ES7461-0AA01-0AA0
SIMATIC S7-400, IM 461-0, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПРИЕМНИК, ДЛЯ СИСТЕМ ЛОКАЛЬНОГО ВВОДА-ВЫВОДА, БЕЗ ЦЕПЕЙ ПИТАНИЯ, С K-ШИНОЙ
Альтернативный код заказа (артикул) — 6ES74610AA010AA0
6ES7461-1BA01-0AA0
SIMATIC S7-400, IM 461-1, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПРИЕМНИК, ДЛЯ СИСТЕМ ЛОКАЛЬНОГО ВВОДА-ВЫВОДА, С ЦЕПЯМИ ПИТАНИЯ, БЕЗ K-ШИНЫ
Альтернативный код заказа (артикул) — 6ES74611BA010AA0
6ES7461-3AA00-7AA0
SIMATIC S7-400, ТЕРМИНАЛЬНЫЙ РЕЗИСТОР ДЛЯ ИНТЕРФЕЙСНОГО МОДУЛЯ IM 461-3
Альтернативный код заказа (артикул) — 6ES74613AA007AA0
6ES7461-3AA01-0AA0
SIMATIC S7-400, IM 461-3, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПРИЕМНИК, ДЛЯ СИСТЕМ РАСПРЕДЕЛЕННОГО ВВОДА-ВЫВОДА, ДЛИНА ЛИНИИ СВЯЗИ ДО 102M, С K-ШИНОЙ
Альтернативный код заказа (артикул) — 6ES74613AA010AA0
6ES7463-2AA00-0AA0
SIMATIC S7-400, IM 463-2, ИНТЕРФЕЙСНЫЙ МОДУЛЬ, ПЕРЕДАТЧИК, ДЛЯ СИСТЕМ РАСПРЕДЕЛЕННОГО ВВОДА-ВЫВОДА СО СТОЙКАМИ РАСШИРЕНИЯ SIMATIC S5 С ИНТЕРФЕЙСНЫМИ МОДУЛЯМИ IM 314, ДЛИНА ЛИНИИ СВЯЗИ ДО 600M
Альтернативный код заказа (артикул) — 6ES74632AA000AA0
6ES7468-1AH50-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 0. 75M
75M
Альтернативный код заказа (артикул) — 6ES74681AH500AA0
6ES7468-1BB50-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 1.5M
Альтернативный код заказа (артикул) — 6ES74681BB500AA0
6ES7468-1BF00-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 5M
Альтернативный код заказа (артикул) — 6ES74681BF000AA0
6ES7468-1CB00-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 10M
Альтернативный код заказа (артикул) — 6ES74681CB000AA0
6ES7468-1CC50-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 25M
Альтернативный код заказа (артикул) — 6ES74681CC500AA0
6ES7468-1CF00-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 50M
Альтернативный код заказа (артикул) — 6ES74681CF000AA0
6ES7468-1DB00-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С K-ШИНОЙ, ДЛИНА 100M
Альтернативный код заказа (артикул) — 6ES74681DB000AA0
6ES7468-3AH50-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С ЦЕПЯМИ ПИТАНИЯ, БЕЗ K-ШИНЫ, ДЛИНА 0. 75M
75M
Альтернативный код заказа (артикул) — 6ES74683AH500AA0
6ES7468-3BB50-0AA0
SIMATIC S7-400, ИНТЕРФЕЙСНЫЙ КАБЕЛЬ С ЦЕПЯМИ ПИТАНИЯ, БЕЗ K-ШИНЫ, ДЛИНА 1.5M
Альтернативный код заказа (артикул) — 6ES74683BB500AA0
Gillison. Circumboreal gradients in plant species and functional types
Research paperBotanica Pacifica. A journal of plant science and conservation 2012. 1(1):97-107.
Article first published online: 10 SEN 2012 | DOI: 10.17581/bp.2012.01105
Circumboreal Gradients in Plant Species and Functional Types
Andrew N. Gillison
Center for Biodiversity Management, P.O. Box 120, Yungaburra, Queensland, 4884 Australia
Questions: 1) Do patterns of richness and composition of vascular plant species
and plant functional types (PFTs) vary consistently along environmental gradients
in high northern latitudes? 2) What factors influence their distribution? 3) Are there
implications for mapping and managing vegetation?
Location: Circumglobal 40º to 70ºN.
Methods: A standard sampling protocol was used to record vegetation in 111 (40×5 m)
transects focusing on the circumboreal zone but within a broader environmental context
including Arctic Fjaeldmark and tundra, upland continental and maritime meadows,
coastal dunes, desert steppe, boreal shrubland and notthern temperate broadleaf-
conifer forest. Variables included vascular plant species and PFTs (functional
modi), vegetation structure, plant functional complexity (PFC) Shannon and Simpson’s
(functional) diversity indices and site physical features including key climate elements.
Multidimensional scaling (MDS) and standard regression analysis were used to explore
regional vegetation gradients.
Results: Highest counts of species, PFTs, PFC, and functional diversity indices were
recorded in the Russian Far East. Most intensive clustering was revealed through MDS
of species composition whereas analyses of species-weighted PFTs revealed broader
overlapping gradients linking Fennoscandia and western Europe with north America. Central Mongolian sites were clearly separate from those in the Russian Far East that
overlapped with central Europe and the high Caucasus. PFT-based data showed more
significant linkages with vegetation structure and climate variables than species or individual
traits.
Central Mongolian sites were clearly separate from those in the Russian Far East that
overlapped with central Europe and the high Caucasus. PFT-based data showed more
significant linkages with vegetation structure and climate variables than species or individual
traits.
Conclusions: Species and PFT-based data provide complementary support for the
existence of identifiable vegetation gradients within the circumboreal zone. Apart
from floristic evolutionary factors, vegetation response to disturbance and substrate
appears to be secondary to climate as the primary environmental determinant. Unified
systematic sampling and readily transferable technology are needed to better understand
the complex factors influencing vegetation patterns in these high latitudes.
Гиллисон Э.Н. Циркумбореальные градиенты видов растений и функциональных типов. Вопросы: 1) Закономерны ли изменения спектров видового состава и функциональных типов сосудистых растений вдоль
экологических градиентов в высоких северных широтах? 2) Какие факторы влияют на их распределение? 3) Возможно ли
применение данных закономерностей для отображения растительного покрова?
Географическая привязка: В пределах широт от 40º до 70º N. Методы: стандартные геоботанические описания растительности на 111 (40×5 м) трансектах в циркумбореальной
зоне. В
качестве
переменных использованы виды сосудистых растений и функциональные типы растений (ФТР), структура растительности,
индексы сложности структуры растительного покрова, индексы разнообразия Шеннона и Симпсона, физические
характеристики местообитаний, включая ключевые параметры климата. Многомерное шкалирование (MDS) и стандартный
регрессионный анализ были использованы для изучения региональных градиентов растительности.
Результаты: Наибольшие показатели видового богатства, ФТР и разнообразия функциональных параметров было
отмечено
на российском Дальнем Востоке. Кластеризация по видовому богатству получена по методу многомерного
шкалирования. Анализ спектров
ФТР показал сильные связи Фенноскандии и Западной Европы с Северной Америкой.
Районы Центральной Монголии отличаются от российского Дальнего Востока, спектр ФТР которого оказался
сходным с таковым центральной Европы и высокогорного Кавказа.
Методы: стандартные геоботанические описания растительности на 111 (40×5 м) трансектах в циркумбореальной
зоне. В
качестве
переменных использованы виды сосудистых растений и функциональные типы растений (ФТР), структура растительности,
индексы сложности структуры растительного покрова, индексы разнообразия Шеннона и Симпсона, физические
характеристики местообитаний, включая ключевые параметры климата. Многомерное шкалирование (MDS) и стандартный
регрессионный анализ были использованы для изучения региональных градиентов растительности.
Результаты: Наибольшие показатели видового богатства, ФТР и разнообразия функциональных параметров было
отмечено
на российском Дальнем Востоке. Кластеризация по видовому богатству получена по методу многомерного
шкалирования. Анализ спектров
ФТР показал сильные связи Фенноскандии и Западной Европы с Северной Америкой.
Районы Центральной Монголии отличаются от российского Дальнего Востока, спектр ФТР которого оказался
сходным с таковым центральной Европы и высокогорного Кавказа. ФТР проявляют более тесные связи со структурой
растительности и климатическими переменными, чем видой состав и видовое богатство.
Выводы: Виды и ФТР представляют дополнительный инструмент для идентификации градиентов
растительности в циркумбореальный
зоне. Помимо флористических и эволюционных факторов, климат является основным детерминантом
распределения
растительного покрова, а реакция растительности на субстрат или экзогенные факторы
выходит на второй
план. Методика систематического отбора проб и несложная техника сбора данных позволяет лучше понять факторы, оказывающие
влияние на закономерности распределения растительности в высоких широтах. (Переведено редколлегией).
ФТР проявляют более тесные связи со структурой
растительности и климатическими переменными, чем видой состав и видовое богатство.
Выводы: Виды и ФТР представляют дополнительный инструмент для идентификации градиентов
растительности в циркумбореальный
зоне. Помимо флористических и эволюционных факторов, климат является основным детерминантом
распределения
растительного покрова, а реакция растительности на субстрат или экзогенные факторы
выходит на второй
план. Методика систематического отбора проб и несложная техника сбора данных позволяет лучше понять факторы, оказывающие
влияние на закономерности распределения растительности в высоких широтах. (Переведено редколлегией).
Keywords: circumboreal gradients, plant functional types, uniform sampling protocol, циркумбореальные градиенты, функциональный тип растений, универсальный протокол сбора данных
FULL TEXT PDF SUPPLEMENTARY MATERIALS
References
Ahti T, Hamet-Ahti L & Jalas J 1968.
Baldocchi D, Kelliher FM, Black TA & Jarvis P 2000. Climate and vegetation controls on boreal zone energy exchange. Global Change Biology 6(S1):69-83. CrossRef
Belbin L 1991. Semi-strong Hybrid Scaling, a new ordination algorithm. Journal of Vegetation Science 2(4):491-496. CrossRef
Belbin L 2008. PATN. http://www.patn.com.au. Accessed 30 April 2012.
Bohn U, Gollub G, Hettwer C, Neuhauslova Z, Schlueter H & Weber H 2003. Karte der naturlichen Vegetation Europas. Map of the natural vegetation of Europe. Federal Agency for Nature Conservation, Bonn.
Box EO 1981. Macroclimate and plant forms: An introduction to predictive modeling in phytogeography. Tasks for Vegetation Science -1. Dr. W. Junk, The Hague, 258 pp. CrossRef
Box EO 1996. Plant functional types and climate at the global scale. Journal of Vegetation Science 7(3):309-320. CrossRef
Bradley SW, Rowe JS & Tarnocai C 1982.![]() An ecological land survey of the Lockhart River map area, Northwest Territories. In: Ecological Land Classification. Series 16. Lands Directorate, Environment Canada, Ottawa, Ontario, 150 pp.
An ecological land survey of the Lockhart River map area, Northwest Territories. In: Ecological Land Classification. Series 16. Lands Directorate, Environment Canada, Ottawa, Ontario, 150 pp.
Brandt JP 2009. The extent of the North American boreal zone. Environmental Review 17(1):101-161. CrossRef
Brooks JR, Flanagan LB, Buchmann N & Ehleringer JR 1997. Carbon isotope composition of boreal plants: functional grouping of life forms. Oecologia 110(3):301-311. CrossRef
Bugmann H 1996. Functional types of trees in temperate and boreal forests: classification and testing. Journal of Vegetation Science 7(3):359-370. CrossRef
Chapin FS III 2003. Effects of plant traits on ecosystem and regional processes: a conceptual framework for predicting the consequences of global change. Annals of Botany 91:455-463. CrossRef
Chapin FS III, Bret-Harte MS, Hobbie SE & Zhong H 1996. Plant functional types as predictors of transient responses of Arctic vegetation to global change. Journal of Vegetation Science 7(3):347-358. CrossRef
Journal of Vegetation Science 7(3):347-358. CrossRef
Chapin FS III 1993. Functional role of growth forms in ecosystem and global processes. In: Scaling physiological processes. Leaf to globe (J. R. Ehleringer & C. B. Field, eds.), pp. 287-312, Academic Press, London. CrossRef
Craine JM, Froehle DG, Tilman DA, Wedin FS & Chapin FS III 2001. The relationships among root and leaf traits of 76 grassland species and relative abundance along fertility and disturbance gradients. Oikos 93(2):274-285. CrossRef
Diaz S & Cabido M 1997. Plant functional types and ecosystem function in relation to global change. Journal of Vegetation Science 8(4):463-474. CrossRef
Douma JC, de Haan MWA, Aerts R, Witte JPM & van Bodegom PM 2012. Succession-induced trait shifts across a wide range of NW European ecosystems are driven by light and modulated by initial abiotic conditions. Journal of Ecology 100(2):366-380. CrossRef
Ermakov N & Morozova O 2011. Syntaxonomical survey of boreal oligotrophic pine forests in northern Europe and Western Siberia.
Eviner VT & Chapin FS III 2003. Functional matrix: a conceptual framework for predicting multiple plant effects on ecosystem processes. Annual Reviews of Ecology and Systematics 34:455-485. CrossRef
Gillison AN & Carpenter G 1997. A generic plant functional attribute set and grammar for dynamic vegetation description and analysis. Functional Ecology 11(6):775-783. CrossRef
Gillison AN & Liswanti N 2004. Assessing biodiversity at landscape level: the importance of environmental context. Agriculture, Ecosystems and Environment 104:75-86. CrossRef
Gillison AN 2002. A generic, computer-assisted method for rapid vegetation classification and survey: tropical and temperate case studies. Conservation Ecology 6(3) [online] http://www.consecol.org/vol6/iss2/art3
Gillison AN 2012. Plant functional types and traits at the community, ecosystem and world level. In: Vegetation Ecology (E. van der Maarel & J. Franklin, eds.), chapter 12, Wiley-Blackwell, Oxford, UK (in press).
Gillison AN, Jones DT, Susilo FX & Bignell DE 2003. Vegetation indicates diversity of soil macroinvertebrates: a case study with termites along a land-use intensification gradient in lowland Sumatra. Organisms, Diversity & Evolution 3(2): 111-126. CrossRef
Hamet-Ahti L 1979. The dangers of using the timberline as the «zero» line in comparative studies on altitudinal vegetation zones. Phytocoenologia 6:49-54.
Hamet-Ahti L 1981. The boreal zone and its biotic subdivision. Fennia 159(1):69-75.
Harrison SP & Prentice IC 2003. Climate and CO2 controls on global vegetation distribution at the last glacial maximum: analysis based on palaeovegetation data, biome modelling and palaeoclimate simulations. Global Change Biology 9(7):983-1004. CrossRef
Hickler T, Smith B, Sykes MT, Davis MB, Sugita S & Walker K 2004. Using a general vegetation model to simulate vegetation dynamics in northeastern U. S.A. Ecology 85(2):519-530. CrossRef
S.A. Ecology 85(2):519-530. CrossRef
Jackson RB, Canadell J, Ehleringer JR, Mooney HA, Sala OE & Schulze ED 1996. A global analysis of root distribution for terrestrial biomes. Oecologia 108(3):389-411. CrossRef
Kaplan JO, Bigelow NH, Prentice IC, Harrison SP, Bartlein PJ, Christensen TR, Cramer W, Matveyeva NV, McGuire AD, Murray DF, Razzhivin VY, Smith B, Walker DA, Anderson PM, Andreev AA, Brubaker LB, Edwards ME & Lozhkin AV 2003. Climate change and Arctic ecosystems: 2. Modeling, paleodata-model comparisons, and future projections. Journal of Geophysical Research 108:D19, 8171. CrossRef
Krestov PV & Nakamura Y 2007. Climatic controls of forest vegetation distribution in Northeast Asia. Berichte der Reinhold-Tuxen-Gesellschaft 19:131-145.
Krestov PV 2003. Forest Vegetation of Easternmost Russia (Russian Far East). In: Forest vegetation of Northeast Asia (J. Kolbek et al., eds.), pp. 93-180, Kluwer Academic Publishers, Dordrecht. CrossRef
Krestov PV, Song JS, Nakamura Y & Verkholat VP 2006. A phytosociological survey of the deciduous temperate forests of mainland Northeast Asia. Phytocoenologia 36(1):77-150. CrossRef
A phytosociological survey of the deciduous temperate forests of mainland Northeast Asia. Phytocoenologia 36(1):77-150. CrossRef
Krestov PV 2011. Climatic control of eastern Russia in the Holocene. In: Northeast Asia Eco-Forum on Sustainable Development and Regional Ecological Security (Abstracts), Shenyang, China. http://www.iae.cas.cn/qt/tzgg/201109/W020110920572492470881.doc
Lavorel S, Grigulis K, Lamarque P, Colace MP, Garden D, Girel J, Pellet G & Douzet R 2011. Using plant functional traits to understand the landscape distribution of multiple ecosystem services. Journal of Ecology 99(1):135-147. CrossRef
Lavrenko EM & Sochova VB (eds.) 1954. Geobotanical map of the USSR (scale 1:4 million). Komarov Botanical Institute, Leningrad (in Russian).
Lewandowski AS, Noss RF & Parsons DR 2010. The effectiveness of surrogate taxa for the representation of biodiversity. Conservation Biology 24(5):1367-1377. CrossRef
Liira J, Schmidt T, Aavik T, Arens P, Augenstein I, Bailey D, Billeter R et al. 2008. Plant functional group composition and large-scale species richness in European agricultural landscapes. Journal of Vegetation Science 19(1):3-14. CrossRef
2008. Plant functional group composition and large-scale species richness in European agricultural landscapes. Journal of Vegetation Science 19(1):3-14. CrossRef
Nakamura Y, Krestov PV & Omelko AM 2007. Bioclimate and zonal vegetation in Northeast Asia: first approximation to an integrated study. Phytocoenologia 37(2-3):443-470. CrossRef
Oleson KW, Lawrence DM, Bonan GB, Flanner MG, Kluzek E, Lawrence PJ, Levis S et al. 2010. Technical Description of version 4.0 of the Community Land Model (CLM). Climate and Global Dynamics Division National Center For Atmospheric Research. Technical Note NCAR/TN-478+STR.
Olson DM & Dinerstein E 1998. The Global 200: a representation approach to conserving the Earth’s most biologically valuable ecoregions. Conservation Biology 12(3):502-515. CrossRef
Olson DM, Dinerstein E, Wikramanayake ED, Burgess ND, Powell GVN, Underwood EC, D’Amico JA et al. 2001. Terrestrial Ecoregions of the World: A New Map of Life on Earth. BioScience 51(11):933-938. CrossRef
CrossRef
Peppe DJ, Royer DL, Cariglino B, Oliver SY, Newman S, Leight E, Enikolopov G et al. 2011. Sensitivity of leaf size and shape to climate: global patterns and paleoclimatic applications. New Phytologist 190(3):724-739. CrossRef
Posada JM, Lechowicz MJ & Kitajima K 2009. Optimal photosynthetic use of light by tropical tree crowns achieved by adjustment of individual leaf angles and nitrogen content. Annals of Botany 103(5):795-805. CrossRef
Qian H, Krestov PV, Fu PY, Wang QL, Song JS & Chourmouzis C 2003. Phytogeography of Northeast Asia. In: Forest vegetation of Northeast Asia (J. Kolbek et al., eds.), pp. 51-91, Kluwer Academic Publishers, Dordrecht. CrossRef
Qian H, Song JS, Krestov PV, Guo Q, Wu Z, Shen X & Guo X 2003. Large-scale phytogeographical patterns in East Asia in relation to latitudinal and climatic gradients. Journal of Biogeography 30(1):129-141. CrossRef
Red Book of Russian Federation (Plants and Fungi). 2008. Tovarishchestvo nauchnikh izdatelstv KMK, Moscow, 855 pp. (in Russian)
(in Russian)
Rivas-Martinez S, Sanchez-Mata D & Costa M 1999. North American boreal and western temperate forest vegetation. (Syntaxonomical synopsis of the potential natural plant communities of North America,II.) Itinera Geobotanica 12:5-316.
Simons H 2005. Global ecological zoning for the FAO Global Forest Resources Assessment 2000. Application and analysis of the map of the Natural Vegetation of Europe. In: Application and Analysis of the Map of the Natural Vegetation of Europe (U. Bohn, C. Hettwer & G. Gollub, eds.), pp. 55-69, Bonn (Bundesamt fur Naturschutz), BfN-Skripten.
Sitch S, Smith B, Prentice IC, Arneth A, Bondeau A, Cramer W, Kaplan JO et al. 2003. Evaluation of ecosystem dynamics, plant geography and terrestrial carbon cycling in the LPJ Dynamic Global Vegetation Model. Global Change Biology 9(2):161-185. CrossRef
Sjors H 1963. Amphi-Atlantic zonation, Nemoral to Arctic. In: North Atlantic Biota and Their History (?. Love & D. Love, eds. ), pp. 109-125, Pergamon Press, New York.
), pp. 109-125, Pergamon Press, New York.
Smith TM, Shugart HH, Woodward FI & Burton PJ 1992. Plant functional types. In: Vegetation Dynamics and Global Change (A. M. Solomon & H. H. Shugart, eds.), pp. 272-292, Chapman & Hall, New York, NY.
Srutek M, Kolbek J, Jarolimek I & Valachovic M 2003. Vegetation-environment relationships within and among selected natural forests in North Korea. In: Forest Vegetation of Northeast Asia (J. Kolbek et al., eds.), pp. 363-382, Kluwer Academic Publishers, Dordrecht. CrossRef
Talbot SS & Meades WJ 2011. Circumboreal Vegetation Map (CBVM) -Mapping the green halo. Concept paper CAFF Strategy Series Report No. 3. http://www.iavs.org/uploads/CBVMConceptPaper.pdf
Thessler S, Ruokolainen K, Tuomisto H & Tomppo E 2005. Mapping gradual landscape-scale floristic changes in Amazonian primary rain forests by combining ordination and remote sensing. Global Ecology & Biogeography 14(4):315-325. CrossRef
Vygodskaya NN, Groisman PY, Tchebakova NM, Kurbatova JA, Panfyorov O, Parfenova EI & Sogachev AF 2007. Ecosystems and climate interactions in the boreal zone of northern Eurasia. Environmental Research Letters 2(4):(045033) (1-7). CrossRef
Ecosystems and climate interactions in the boreal zone of northern Eurasia. Environmental Research Letters 2(4):(045033) (1-7). CrossRef
Walker DA, Elvebakk A, Talbot SS & Daniels FJA 2005. The Second International Workshop on Circumpolar Vegetation Classification and Mapping: a tribute to Boris A. Yurtsev. Phytocoenologia 35(4):715-726. CrossRef
Walker DA, Raynolds MK, Daniels FJA, Einarsson E, Elvebakk A, Gould WA, Katenin AE, Kholod SS, Markon CJ, Melnikov EE, Moskalenko NG, Talbot SS, Yurtsev BA & the CAVM Team. 2005. The Circumpolar Arctic Vegetation Map. Journal of Vegetation Science 16(3):267-282. CrossRef
Wardle D, Barker G, Bonner K & Nicholson K 1998. Can comparative approaches based on plant ecophysiological traits predict the nature of biotic interactions and individual plant species in ecosystems? Journal of Ecology 86(3):405-420. CrossRef
Westoby M 1998. A leaf-height-seed (LHS) plant ecology strategy scheme. Plant and Soil 199(2):213-227. CrossRef
CrossRef
Wright IJ, Reich PB, Westoby M, Ackerly DD, Baruch Z, Bongers F, Cavender-Bares J et al. 2004. The worldwide leaf economics spectrum. Nature 428 (6985):821-827. CrossRef
Zemmrich A 2010. Plant communities along an elevational gradient under special consideration of grazing in western Mongolia. Phytocoenologia 40(2-3):91-115. CrossRef
| 1 | Артикул | 1224001730 |
| 2 | Маркировка по газу | 2 Ex nA II T6 Gc X |
| 3 | Маркировка по пыли | Ex tc IIIC T80 C Dc X |
| 4 | Маркировка по рудничному газу и угольной пыли | — |
| 5 | Тип ИС | LED |
| 6 | Световой поток | 8400 лм |
| 7 | Мощность светильника | 72 Вт |
| 8 | Энергоэффективность | 117 лм/Вт |
| 9 | Индекс цветопередачи (CRI) | >70 |
| 10 | Коррелированная цветовая температура (в сфере) | 5000 K |
| 11 | Коэффициент мощности (cos φ) | > 0,96 |
| 12 | Переменный/постоянный ток (AC/DC) | Да |
| 13 | Диммирование | — |
| 14 | Напряжение питания | 230 В |
| 15 | Класс защиты от поражения током | I |
| 16 | Климатическое исполнение | УХЛ1 |
| 17 | Температурный режим | от -60 до +55 C |
| 18 | Цвет корпуса | Металлик |
| 19 | Класс пожароопасности | П-ІІа |
| 20 | Коэффициент пульсации | <5% |
| 21 | Степень защиты (IP) | IP66 |
| 22 | Ударопрочность | IK08/7 Дж |
| 23 | Класс энергоэффективности | A+ |
| 24 | Блок аварийного питания | Нет |
| 25 | Угол обзора | D30 |
| 26 | Гарантия | 36 мес. |
Таблица соответствия марок сталей ГрондГрупп (поставка промышленного крепежа)
Внимание! Указаны как прямые, так и ближайшие аналоги!
| Группа материалов | Страна/стандарт | ||||||
| США | Германия/Италия | Великобри- тания | Франция | Япония | Россия | ||
Твердость HB | AISI/SAE | W.Nr. | DIN | BS | AFNOR | JIS | ГОСТ |
Gr. 50 50 | 1,0050 | St50-20 | 43/35HS | A50 | SS500 | С285 | |
| 1,0070 | St70-2 | E360 | A70 | С375 | |||
A283 Grade A | 1,0035 | S185/Fe 310-0 | HR 15 | A33 | SS330 | Ст0 | |
| A53 Gr A | St35 | S360 | Ст2 | ||||
| A 107 | 1,0036 | USt 37-2 | SS400 | Ст3кп | |||
| A 414 Grade A | 1,0038 | S235J2G3 / Fe 360 D1 | HS 37/23 | S235J2G3 | SS330 | Ст3сп | |
| A 570 Grade 50 | 1,0050 | St 50-2 | SS490 | Ст5сп | |||
| A 572 Grade 65 | 1,0060 | E335/Fe 590-2 | 55 C | E 335 | SM570 | Ст6 | |
| Качественная углеродистая сталь | |||||||
| 1008 | 1,1121 | C10 | 040A10 | AF-34 | SPHE | 08пс | |
| A516-55 | 13Mn6 | 68F62H5 | SB49 | 09Г2С | |||
| C1010 | 1,0301 | C10 | 040A10 | C10RR | S9CK | 10 | |
A201Gr. Afx Afx | 1,0345 | ASt35 | 141-360 | A37AP | SGV410 | 12К | |
| 180-240 | 1015 | 1,1141 | Ck15 | 080M15 | XC12 | S15C | 15 |
| 180-240 | 1015 | 1,0401 | C15 | 080M15 | C 18 | 15 | |
| 150-200 | 1020 | 1,0402 | C22 | 055 M 15 | S20C | 20 | |
| 150-200 | 1025 | 1,1158 | Ck25 | (070 M 26) | 2 C 25 | S25C | 25 |
| 170-230 | 1035 | 1,0501 | C35 | 060A35 | AF 42 C 20 | S35C | 35 |
| 170-220 | 1035 | 1,1183 | Cf35 | 080A35 | XC 38 H 1 TS | 35 | |
| 210-280 | 1035 | 1,1157 | 40Mn4 | 150M36 | 35M5 | 40Г | |
| 190-240 | 1045 | 1,1191 | Ck45 | 080M46 | XC45 | S45C | 45 |
| 190-240 | 1045 | 1,0503 | C45 | 080M46 | C 45 | S45C | 45 |
| 200-250 | 1050 | 1,1213 | Cf53 | 070M55 | XC 48 H 1 TS | S50C | 50 |
| 210-270 | 1055 | 1,0535 | C55 | 070M55 | C 54 | S55C | 55 |
| 210-270 | 1055 | 1,1203 | Ck55 | 070M55 | 2 C 55 | S55C | 55 |
| 230-270 | 1060 | 1,0601 | C60 | 060 A 62 | C 60 | S58C | 60 |
| 230-290 | 1060 | 1,1221 | Ck60 | 060A62 | 2 C 60 | S58C | 60 |
| 300-330 | 1095 | 1,1274 | Ck101 | CS95 | C100RR | ||
| 160-230 | 1140 | 1,0726 | 35S20 | 212M36 | 35MF6 | А30 | |
| 130-230 | 1215 | 1,0736 | 9SMn36 | S300 | |||
| 200-260 | 1330 | 1,1170 | 28Mn6 | 150M28 | 20M5 | SCMn2 | 30Г |
| 200-270 | 1335 | 1,1167 | 36Mn5 | 150 M 36 | 40M5 | SCMn3 | 35Г2 |
| 290-320 | 9255 | 1,0904 | 55Si7 | 250A53 | 55S7 | 55С2 | |
| 120-220 | 11L08 | 1,0722 | 10SPb20 | 10PbF2 | А12 | ||
| 130-220 | 12L13 | 1,0718 | 9SMnPb28 | S250Pb | |||
| 130-230 | 12L14 | 1,0737 | 9SMnPb36 | S300Pb | |||
| Низколегированная углеродистая сталь | |||||||
| 160-220 | 2515 | 1,5680 | 12Ni19 | Z 18 N 5 | Z18N5 | ||
| 210-280 | 3135 | 1,5710 | 36NiCr6 | 640A35 | 35NC6 | SNC236 | 40ХН |
| 250-360 | 3415 | 1,5732 | 14NiCr10 | 14NC11 | SNC815 | 12ХН3А | |
| 200-290 | 4130 | 1,7218 | 25CrMo4 | 708 A 25 | 25CD4 | SCM420 | 20ХМ |
| 230-330 | 4137 | 1,7220 | 34CrMo4 | 708A37 | 35CD4 | SCM435H | АС38ХГМ 35ХМ |
| 230-330 | 4140 | 1,7223 | 41CrMo4 | 708M40 | 42CD4TS | SCM440 | 40ХФА 38ХМА |
| 240-360 | 4140 | 1,7225 | 42CrMo4 | 708M40 | 42CD4 | SCM440H | 40ХН2МА |
| 270-360 | 4340 | 1,6582 | 34CrNiMo6 | 817M40 | 35NCD6 | SNCM447 | 38Х2Н2МА |
| 140-180 | 4520 | 1,5423 | 16Mo5 | ||||
| 210-270 | 5015 | 1,7015 | 15Cr3 | 523M15 | 12C3 | SCr415 | 15Х |
| 200-330 | 5115 | 1,7131 | 16MnCr5 | 527 M 17 | 16 MC 4 | SMnC420 | 18ХГ |
| 210-290 | 5132 | 1,7033 | 34Cr4 | 530A32 | 32C4 | SCr430H | 35Х |
| 210-230 | 5140 | 1,7045 | 42Cr4 | 530 A 40 | 42 C 4 TS | SCr435 | 40Х |
| 240-330 | 5140 | 1,7035 | 41Cr4 | 530M40 | 42C4 | SCr440H | 40Х |
| 320-330 | 5155 | 1,7176 | 55Cr3 | 525 A 58 | 55 Cr 3 | SUP9 | 50ХГА |
| 240-360 | 6150 | 1,8159 | 50CrV4 | 735A51 | 51 CV 4 | SCM445H | 50ХФА |
| 210-330 | 8620 | 1,6523 | 21NiCrMo2 | 805M20 | 20NCD2 | SNCM220 | 20ХГНМ |
| 320-330 | 9262 | 1,7108 | 60SiCr7 | 60SC7 | SUP6 | 60С2 | |
| 240-330 | 9840 | 1,6511 | 36CrNiMo4 | 817 M 37 | 40NCD3 | SCNM439 | 40ХН2МА |
| 150-200 | A350 LF5 | 1,5622 | 14Ni6 | 16N6 | |||
| 200-260 | A353 | 1,5662 | X8Ni9 | 3603-509 LT | 9 Ni 490 | ||
| 270-370 | 3415; 3310 | 1,5752 | 14NiCr14 | 655M13 | 12NC15 | SNC815 | 12Х2Н4А |
| 140-180 | A 182 F22 | 1,7380 | 10CrMo9 10 | 3606-622 | 12CD9;10 | SFVAF22A | 10Х2М |
| 140-180 | A 182- F 11 | 1,7335 | 13CrMo4 4 | 1502 620-540 | 15 CD 3. 5 5 | SFVAF12 | 12ХМ |
| 140-170 | A204 GrA | 1,5415 | 15Mo3 | 1503-243 | 15D3 | STBA12 | |
| 290-300 | E 71400 | 1,8509 | 41CrAIMo7 | 905M39 | 40CAD6, 12 | ||
| 200-330 | 1,7262 | 15CrMo5 | 12CD4 | ||||
| 150-200 | 1,7715 | 14MoV63 | 1503-660- 460 | ||||
| 300-400 | 1,6587 | 17CrNiMo6 | 18NCD6 | SNCM815 | 18Х2Н4ВА | ||
| 300-430 | 1,7361 | 32CrMo12 | 722M24 | 30CD12 | |||
| Быстрорежущая сталь | |||||||
| 200-230 | 52100 | 1,3505 | 100Cr6 | 535A99 | 100C6 | SUJ2 | ШХ15 |
| 240-330 | A 128 | 1,3401 | X120Mn12 | Z120M12 | |||
| 240-300 | M2 | 1,3343 | S 6-5-2 | BM2 | Z85WDCV 06-05-04-02 | SKH51 | Р6М5 |
| 240-300 | M7 | 1,3348 | S 2-9-2 | Z100DCWV 09-04-02-02 | SKH58 | ||
| 240-320 | T1 | 1,3355 | S 18-0-1 | BT1 | Z80WCV 18-04-01 | SKH | Р18 |
| 250-320 | T4 | 1,3255 | S 18-1-2-5 | BT4 | Z80WKCV 18-05-04-01 | SKh4 | Р18К5Ф2 |
| 250-320 | 1,3243 | S 6-5-2-5 | BM 35 | Z85WDKCV 06-05-05- 04-02 | SKH55 | Р6М5К5 | |
| Высоколегированная и инструментальная сталь | |||||||
| 230-260 | A2 | 1,2363 | X100CrMoV51 | BA2 | Z100CDV5 | SKD12 | 9Х5ВФ |
| 220-240 | A6 | ||||||
| 240-280 | A7 | ||||||
| 260-270 | D2 | 1,2379 | X155CrVMo12-1 | BD2 | Z160CDV12 | SKD11 | Х12МФ |
| 260-270 | D3 | 1,2080 | X210Cr12 | BD3 | X200Cr12 | SKD1 | Х12 |
| 360-500 | h20 | 1,2365 | X 32 CrMoV 3 3 | Bh20 | 32 CDV 12-28 | SKD7 | 3Х3М3Ф |
| 360-470 | h21 | 1,2343 | X38CrMoV5-1 | Bh21 | Z 38 CDV 5 | SKD6 | 4Х5МФС |
| 330-380 | h22 | 1,2606 | X37CrMoW5-1 | Bh22 | Z35CWDV5 | SKD62 | 4Х4ВМФС |
| 360-530 | h23 | 1,2344 | X40CrMoV51 | Bh23 | Z40CDV5 | SKD61 | 4Х5МФ1С |
| 380-500 | h29 | 1,2678 | Bh29 | ||||
| 360-530 | h31 | 1,2581 | X30WCrV9 3 | Bh31 | Z30WCV9 | SKD5 | 3Х2В8Ф |
| 230-260 | L3 | 1,2067 | 102Cr6 | BL3 | Y100C6 | SUJ2 | 9Х2 |
| 240-260 | L6 | 1,2713 | 55NiCrMoV6 | BHH 224/5 | 55NCDV7 | SKT3 | 5ХНМ |
| 240-260 | M3 | 1,3342 | SC6-5-2 | Z90WDCV 06-05-04-02 | 85Х4М5Ф 2В6Л | ||
| 200-210 | O1 | 1,2510 | 100MnCrW4 | BO1 | 90MnWCrV5 | ХВСГФ | |
| 230-240 | O7 | ||||||
| 230-240 | S1 | 1,2542 | 45WCrV7 | BS1 | 45 WCV 20 | 5ХВ2С | |
| 200-220 | S7 | ||||||
| 200-250 | W110 | 1,1545 | C105W1 | SK3 | У10А | ||
| 200-230 | W112 | 1,1563 | C125W | SK1 | У13 | ||
| 230-260 | W210 | 1,2833 | 100V1 | BW2 | Y1105V | ||
| 260-270 | 1,2601 | X165CrMoV12 | SKD11 | Х12МФ | |||
| 260-270 | 1,2436 | X210CrW12 | Z 210 CW 12-01 | Х12ВМ | |||
| 230-260 | 1,2419 | 105WCr6 | 105WC13 | SKS2 | ХВГ | ||
| Ферритные и мартенситные нержавеющие стали | |||||||
| 230-240 | 1,4027 | G-X20Cr14 | 420C29 | Z20C13M | |||
| 210-240 | 1,4034 | X 46 Cr13 | 420S45 | Z 44 C 14 | SUS420J2 | 40Х13 | |
| 260-330 | 1,4086 | GX 120 Cr29 | 452C11 | ||||
| <255 | 1,4568 | X7CrNiAl177 | 301S81 | Z 9 CAN 17-07 | SUS631 | 09Х17Н7Ю | |
| 300-420 | 13-8 PH | 1,4534 | |||||
| 280-400 | 15-5 PH | 1,4540 | X4CrNiCuNb164 | Z6CNU15. 05 05 | |||
| 280-400 | 15-7 PH | 1,4532 | X7CrNiMoAl157 | Z8CNDA15.07 | |||
| 120-180 | 403 | 1,4000 | X6Cr13 | 403S17 | Z 8 C 12 | SUS410S | 08Х13 |
| <185 | 405 | 1,4002 | X 6 CrAl 13 | 405S17 | Z 8 CA 12 | SUS405 | 10Х13СЮ |
| 140-200 | 410 | 1,4006 | X12Cr13 | 410S21 | Z 10 C 13 | SUS410 | 12Х13 |
| 130-180 | 410 S | 1,4001 | X7Cr14 | 403S17 | Z 8 C 13 FF | SUS403 | 08Х13 |
| 180-240 | 416 | 1,4005 | X12CrS13 | 416S21 | Z 11 CF 13 | ||
| 230-290 | 420 | 1,4021 | X20Cr13 | 420S37 | Z 20 C 13 | SUS420J1 | 20Х13 |
| 140-200 | 430 | 1,4016 | X6Cr17 | 430S17 | Z 8 C 17 | SUS430 | 12Х17 |
| 200-260 | 430F | 1,4104 | X12CrMoS17 | Z10CF17 | |||
| 260-290 | 431 | 1,4057 | X17CrNi16-2 | 431S29 | Z15CNi6. 02 02 | SUS431 | 20Х17Н2 |
| 140-200 | 434 | 1,4113 | X6CrMo17-1 | 434S17 | |||
| 275-360 | 630 | 1,4542 | X5CrNiCuNb164 | Z7CNU16.04 | |||
| 266 — 325 | 1,4731 | X40CrSiMo10-2 | X40CrSiMo 10-2 | Z40CSD10 | SUh4 | 40Х10С2М | |
| Аустенитные нержавеющие стали | |||||||
| 130-140 | 1,4312 | GX 10 CrNi 18-8 | 302C25 | Z10CN18.9M | |||
| 130 | 1,4552 | GX 5 CrNiNb 19-11 | 347C17 | Z 6 CNNb 18.10 M | |||
| 140-200 | 1,4581 | GX5CrNiMoNb 19-11-2 | 318C17 | Z 4CNDNb 18.12 M | |||
| 120-180 | 1,4865 | G-X40NiCrSi 38 18 | 330C11 | ||||
| 150-170 | ASTM A240 | ||||||
| 240-270 | ASTM A240 | ||||||
| 330-360 | ASTM A693 | ||||||
| 230-290 | CA 6-NM | 1,4313 | X3 CrNiMo 13-4 | 425C11 | Z4CND13. 4M 4M | ||
| 140-200 | CF-8 | 1,4308 | GX5 CrNi 19-10 | 304C15 | Z6CN18.10M | ||
| 140-200 | CF-8M | 1,4408 | GX5 CrNiMo 19-11-2 | 316C16 | |||
| 150-230 | UNS N 08904 | 1,4539 | X 1 NiCrMoCuN 25-20-5 | Z 2 NCDU 25-20 | |||
| 210-290 | 301 | 1,4310 (FSt) | X 10 CrNi 18-8 | 301S21 | Z 11 CN 17-08 | SUS301 | 07Х16Н6 |
| 150-210 | 303 | 1,4305 (А1) | X 8 CrNiS 18-9 | 303S22 | Z 8 CNF 18-09 | SUS303 | 12Х18Н9 |
| 150-210 | 304 | 1,4301 (А2) | X5CrNi18 9 | 304S16 | Z6CN18.09 | SUS304 | 08Х18Н10 |
| 140-210 | 304L | 1,4306 | X2CrNi19 11 | 304S11 | Z 3 CN 19-11 FF | SUS304L | 03Х18Н11 |
| 170-230 | 304LN | 1,4311 | X2CrNiN18 10 | 304S61 | Z 3 CN 18-07 Az | SUS304LN | 03Х18Н11 |
| 150-210 | 305 | 1,4303 (А2) | X 4 CrNi18-12 | 305S17 | Z 5 CN 18-11 FF | SUS305J1 | 06Х18Н11 |
| 150-230 | 309 | 1,4828 | X15CrNiSi20 12 | 309S24 | Z 9 CN 24-13 | SUh409 | 20Х20Н14 С2 |
| 170-240 | 310 | 1,4841 | X15CrNiSi25 20 | 314S25 | Z 15 CNS 25-20 | SUh410 | 20Х25Н20 С2 |
| 150-230 | 310S | 1,4845 | X12CrNi 25 21 | 310S24 | Z12CN25 20 | SUS310S | 10Х23Н18 |
| 160-220 | 316 | 1,4401 (А4) | X5CrNiMo 17 12 2 | 316S13 | Z6CND17. 11 11 | SUS316 | 08Х16Н11 М3 |
| <215 | 316 | 1,4436 | X 5 CrNiMo 17-13-3 | 316S33 | Z6CND18- 12-03 | SUS316 | 08Х16Н11 М3 |
| <215 | 316L | 1,4404 | X 2 CrNiMo 17-12-2 | 316S11 | Z2CND17.12 | SUS316 | 03Х17Н14 М3 |
| 150-210 | 316L | 1,4435 | X2CrNiMo 18-14-3 | 316S11 | Z 3 CND 17-13-03 | SUS316L | 03Х17Н14 М3 |
| 180-240 | 316LN | 1,4429 | X2CrNiMoN 17 13 3 | 316S63 | Z 3 CND 17-12 Az | SUS316LN | 03Х16Н15 М3 |
| 150-220 | 316Ti | 1,4571 (А5) | X6CrNiMoTi 17 12 2 | 320S18 | Z6NDT17.12 | 316Ti | 08Х17Н 13М2Т |
| 150-210 | 317L | 1,4438 | X 2 CrNiMo 18-15-4 | 317S12 | Z 2 CND 19-15-04 | SUS317L | |
| 150-230 | 318 | 1,4583 | X10CrNiMoNb 18 12 | 09Х16Н 15М3Б | |||
| 150-220 | 321 | 1,4541 (А3) | X6CrNiTi18 10 | 321S31 | Z6CNT18. 10 10 | SUS321 | 08Х18Н10Т |
| 150-230 | 321 | 1,4878 | X12CrNiTi18 9 | 321S51 | Z 6 CNT 18-10 | SUS321H | 12Х18Н10Т |
| 170-240 | 330 | 1,4864 | X12NiCrSi36 16 | NA 17 | Z 20 NICS 33-16 | SUh430 | |
| 160-230 | 347 | 1,4550 | X6CrNiNb18 10 | 314S20 | Z6CNNb1 8.10 | SUS347 | 08Х18Н 12Б |
| 140-200 | 405 | 1,4724 | X10CrAI13 | 403S17 | Z 13 C 13 | SUS405 | 10Х13СЮ |
| 160-220 | 446 | 1,4762 | X10CrAI 24 | Z 12 CAS 25 | SUh546 | 15Х28 | |
| Аустенитно-ферритные нержавеющие стали | |||||||
| 200-270 | 329 | 1,4460 | X 3 CrNiMoN 27-5-2 | Z 5 CND 27-05 Az | SUS329J1 | 08Х21Н 6М2Т | |
| <290 | S31500 | 1,4417 | GX 2 CrNiMoN 25-7-3 | ||||
| <270 | S31803 | 1,4462 | X 2 CrNiMoN 22-5-3 | 318S13 | Z 3 CND 22-05 Az | ||
| <260 | S32304 | 1,4362 | X 2CrNiN 23-4 | 03Х23Н6 | |||
| 160-230 | 1,4821 | X20CrNiSi254 | X15CrNiSi254 | Z20CNS 25. | |||
| <302 | S32550 | ||||||
| <310 | S32750 | 1,4410 | X 2 CrNiMoN 25-7-4 | Z5CND 20.12M | |||
| <270 | S32760 | ||||||
| Серый чугун | |||||||
| 1175 | No 20 B | 0,6010 | GG 10 | Grade 100 | Ft 10 D | FC100 | СЧ10 |
| 185 | No 25 B | 0,6015 | GG 15 | Grade 150 | Ft 15 D | FC150 | СЧ15 |
| 205 | No 30 B | 0,6020 | GG 20 | Grade 220 | Ft 20 D | FC200 | СЧ20 |
| 220 | No 35 B | 0,6025 | GG 25 | Grade 260 | Ft 25 D | FC250 | СЧ25 |
| 230 | No 45 B | 0,6030 | GG 30 | Grade 300 | R 30 D | FC300 | СЧ30 |
| 235 | No 50 B | 0,6035 | GG 35 | Grade 350 | Ft 35 D | FC350 | СЧ35 |
| 250 | No 55 B | 0,6040 | GG 40 | Grade 400 | Ft 40 D | ||
| Высокопрочный чугун (с шаровидным графитом) | |||||||
| 143-187 | 60-40-18 | 0,7033 | GGG 35. 3 3 | 350/22 | FGS 350-22 | FCD350-22L | ВЧ40 |
| 156-217 | 65-45-12 | 0,7040 | GGG 40 | 420/12 | FCD400 | ВЧ40 | |
| 187-255 | 80-55-06 | 0,7050 | GGG 50 | 500/7 | FGS 500-7 | FCD500 | ВЧ50 |
| 210-280 | 80-60-03 | 0,7060 | GGG 60 | 600/3 | FGS 600-3 | FCD600 | ВЧ60 |
| 241-302 | 100-70-03 | 0,7070 | GGG 70 | 700/2 | FGS 700-2 | FCD700 | ВЧ70 |
| 265-302 | 120-90-02 | 0,7080 | GGG 80 | 900/2 | FGS 900-2 | FCD800 | ВЧ80 |
| Ковкий чугун | |||||||
| 150 max | 32510 | 0,8135 | GTS-35 | MN 350-10 | FCMB35 | КЧ35 | |
| 149-197 | 40010 | 0,8145 | GTS-45 | MN450-6 | FCMP440 | КЧ45 | |
| 179-229 | 50005 | 0,8155 | GTS-55 | P50-05 | FCMP540 | КЧ55 | |
| 217-269 | 70003 | 0,8165 | GTS-65 | P60-03 | |||
| 269-321 | 90001 | 0,8170 | GTS-70 | P70-02 | Mn 700-2 | ||
| 230 | 0,8035 | GTW-35-04 | W340/3 | MB35-7 | |||
| 220 | 0,8040 | GTW-40-5 | W410/4 | MB40-10 | |||
| 220 | 0,8045 | GTW-45-07 | |||||
| 165 | 0,8055 | GTW-55 | |||||
| 180 | 0,8065 | GTW-65 | |||||
| Безферритные материалы | |||||||
| 20 | 1050 | 3,0255 | Al99,5 | 1B | A5 | 1050 | АД0 |
| 80-160 | 2011 | 3,1655 | AlCu6BiPb | FC1 | A-U5PbBi | ||
| 45-105 | 2017 | 3,1325 | AlCu4MgSi | A-U4G | 2017 | Д1 | |
| 45-135 | 2024 | 3,1355 | AlCu4Mg1 | L97 | A-U4G1 | 2024 | Д16 |
| 28-55 | 5005 | 3,3315 | AlMg1 | N41 | A-G0,6 | 5005 | АМг1 |
| 36-63 | 5050 | 3,3316 | AlMg1,5 | 3L44 | A-G1,5 | ||
| 47-88 | 5052 | 3,3523 | AlMg2,5 | 2L56 | A-G2,5C | ||
| 65-120 | 5056 | 3,3549 | AlMg5Cr | N6 | |||
| 77-93 | 5083 | 3,3547 | ASlMg4,5Mn | N8 | A-G4,5MC | 5083 | АМг4 |
| 70-87 | 5086 | 3,3545 | AlMg4 | A-G4MC | |||
| 62-81 | 5454 | AlMg3Mn | N51 | A-G2,5MC | |||
| 60-95 | 5754 | 3,3535 | AlMg3 | N5 | A-G3M | 5154 | АМг3 |
| 25-105 | 6063 | 3,3206 | AlMg0,5Si | H9 | 6063 | АД31 | |
| 58-95 | 6351 | 3,2315 | AlSiMg0,5Mn | h40 | 6061 | АД35 | |
| 53-105 | 7005 | 1915 | |||||
| 132-147 | 7050 | 3,4345 | AlZn6CuMgZr | L 86 | AZ 4 GU/ 9051 | ||
| 60-150 | 7075 | 3,4365 | AlZn5,5MgCu | DTD5074 | A-Z5GU | 7075 | В95 |
| — | 360 | 3,2383 | R2147AlSi10Mg | LM 9 | AC2B | АК5М2 | |
| — | 413 | 3,2582 | R2147AlSi12 | ADC1 | |||
| Наимено -вание | Высокотемпературные сплавы (на основе железа) | ||||||
| 20CB-3 | ASTM B463 | ||||||
| Aermet 100 | |||||||
| AL 36 | ASTM F1684 | ||||||
| AL 42 | ASTM F30 | ||||||
| AL 4750 | ASTM B753 | ||||||
| AL-6XN Alloy | ASTM SB688 | ||||||
| ALLOY 21-6-9 | ASTM A666 | ||||||
| Allvac 330 | 5592, 5716 | ||||||
| Armco 18 | |||||||
| Armco 20-45-5 | |||||||
| Crusible A286 | ASTM 368 | 1,4980 | HR 5152 | Z06 NCT 25 | |||
| Discaloy 16/25/6 | 5725 | Z3 NCT 25 | |||||
| Discaloy 24 | ASTM A638 | Z3 NCT 25 | |||||
| Greek Ascoloy | 5508 | ||||||
| Haynes 556 | 5768 | X12CrCoNi2120 | |||||
| Incoloy 800 | ASME SB 409 | X10NiCrAlTi3220 | 3082-76 | 25 NC 3520 | |||
| Incoloy 801 | 5552 | G-X50CrNi3030 | |||||
| Incoloy 802 | |||||||
| Incoloy 803 | |||||||
| Incoloy DS | X12NiCrSi3616 | 3072-76 | |||||
| Jethete M-152 | 5718, 5719 | Z12 CND 12 | |||||
| N 155 | 5768 | Z12 CNKDW 20 | |||||
| N 156 | |||||||
| S 590 | 5533 | X40CoCrNi2020 | Z42 CKNDW | ||||
| Sanicro 30 | X2NiCrAlTi3220 | ||||||
| Vasco 13-8 Mo | 5629 | ||||||
| VascoMax C-200 | |||||||
| VascoMax C-250 | 6501, 6512, 6520 | ||||||
| VascoMax C-300 | 6514 | ||||||
| VascoMax C-350 | |||||||
| VascoMax T-200 | |||||||
| VascoMax T-250 | 6518, 6519, 6591 | ||||||
| Наимено вание | Высокотемпературные сплавы (на основе кобальта) | ||||||
| Altemp S 816 | 5534 | CoCr20Ni20W | |||||
| HS 21 | ASTM F-75 | CoCr28Mo | 3531 | ||||
| HS 25 | AISI 670 | CoCr20W15Ni | KC 20 WN | ||||
| HS 30 | CoCr26Ni14Mo | ||||||
| HS 31 | ASTM A567 | CoCr25NiW | 3146 | KC 25 NW | |||
| HS 36 | CoCr19W14NiB | ||||||
| Jetalloy 209 | |||||||
| L 251 | |||||||
| L 605 | 5759 | CoCr20W15Ni | KC 20 WN | ||||
| M 203 | |||||||
| M 204 | |||||||
| M 205 | |||||||
| MAR M-322 | CoCr22W9TaZrNb | ||||||
| MAR M-509 | CoCr24Ni10WtaZrB | 3146-3 | |||||
| MAR M-905 | |||||||
| MAR M-918 | CoCr20Ni20Ta | ||||||
| MAR-M 302 | CoCrW10TaZrB | ||||||
| MP35N | |||||||
| Nickelvac TJA-1537 | ASTM F1537 | ||||||
| Stellite SF1 | KC 33 W13 | ||||||
| Stellite SF12 | KC 28 W8 | ||||||
| StelliteSF 6 V-36 | 5387 | CoCr25Ni20 M0WNb | KC 26 NW | ||||
| WI-52 | CoCr21Mo11W | ||||||
| X 40 | ASTM A567 | CoCr25NiW | 3146-2 | ||||
| X 45 | |||||||
| X 50 | |||||||
| Наимено -вание | Высокотемпературные сплавы (на основе никеля) | ||||||
| AL 22 | ASME SB575 | ||||||
| Allcor | |||||||
| Astroloy | |||||||
| Duranickel 310 | |||||||
| GMR 235 | AISI:686 | ||||||
| GMR 235-D | NiCr16MoAl | ||||||
| Hastelloy B | 5396A | S-NiMo30 | ND27FeV | ||||
| Hastelloy B-2 | |||||||
| Hastelloy C | 5388C | NiCr17Mo17FeW | NC17DWY | ||||
| Hastelloy D | |||||||
| Hastelloy N | |||||||
| Hastelloy R235 | |||||||
| Hastelloy W | |||||||
| Hastelloy X | 5536 | 2,4665 | NiCr22FeMo | HR6,204 | NC22FeD | ||
| Haynes 75 | |||||||
| HS 27 | NiCo32Cr26Mo | KC20WN | |||||
| IN 100 | 5397 | NiCo15Cr10MoAlTi | NK15CAT | ||||
| IN 713 | |||||||
| Incoloy 020 | ASME SB463 | 2,4660 | |||||
| Incoloy 804 | |||||||
| Incoloy 825 | ASME SB424 | 2,4858 | NiCr21Mo | 3072-76 | NC21FeDU | ||
| Incoloy 901 | 5660 | NiFe35Cr14MoTi | Z8NCDT42 | ||||
| Incoloy 903 | |||||||
| Incoloy 925 | |||||||
| Inconel 600 | 5540 | 2,4816 | NiCr15Fe | 3072-76 | NC15Fe | ||
| Inconel 601 | 5715 | 2,4851 | |||||
| Inconel 617 | 2,4663 | ||||||
| Inconel 622 | 2,4602 | ||||||
| Inconel 625 | ASME SB443 | 2,4856 | NiCr22Mo9Nb | NC22FeDNB | |||
| Inconel 620 | 2,4642 | ||||||
| Inconel 700 | NiCo28Cr15MoAlTi | NK27CADT | |||||
| Inconel 702 | 5550 | ||||||
| Inconel 706 | 57-2 | ||||||
| Inconel 713 | 5391 | G-NiCr13Al16MoNb | 3146,3 | NC13AD | |||
| Inconel 718 | 5383 | 2,4668 | NiCr19Fe19NbMo | HR8 | NC19FeNb | ||
| Inconel 718-OP | |||||||
| Inconel 720 | |||||||
| Inconel 721 | |||||||
| Inconel 722 | 5541 | NiCr16FeTi | NC16Feti | ||||
| Inconel 725 | |||||||
| Inconel 751 | 2,4694 | ||||||
| Inconel X-750 | 5542 | 2,4669 | NiCr16FetTi | NC15FeTNb | |||
| Jessop G 81 | NiCr20Co18Ti | ||||||
| Jethete M-252 | 5551 | G-NiCr19Co | |||||
| MAR-M 200 | NiW13Co10Cr9AlTi | NKW10CATaHf | |||||
| MAR-M 246 | NiCo10W10Cr9AlTi | ||||||
| MAR-M 421 | NiCr16Co10WalTi | ||||||
| MAR-M 432 | NiCo20Cr16WAlTi | ||||||
| Monel 400 | 4544 | 2,4360 | NiCu30Fe | 3072-76 | NU30 | ||
| Monel K 500 | 4676 | 2,4375 | NiCu30Al | 3072-76 | |||
| Monel R 405 | 4674 | ||||||
| Nimocast 713 | 5391A | G-NiCr13A16MoNb | HC203 | NC13AD | |||
| Nimocast PD 16 | NiFe33Cr17Mo | ||||||
| Nimocast PE 10 | HC202 | NC20N13 | |||||
| Nimonic 105 | 2,4634 | NiCo20Cr15MoAlTi | HR3 | NCKD20ATV | |||
| Nimonic 115 | 2,4636 | NiCo15Cr15MoAlTi | HR401,601 | NCVK15ATD | |||
| Nimonic 75 | 2,4630 | NiCr20Ti | HR5, 203-4 | NC20T | |||
| Nimonic 80A | 2,4631 | NiCr20TiAl | HR401,601 | NC20TA | |||
| Nimonic 86 | |||||||
| Nimonic 90 | 2,4632 | NiCr20Co18Ti | HR2,202 | NCK20TA | |||
| Nimonic 901 | 5660, 5661 | 2,4662 | NiCr15MoTi | Z8NCDT42 | |||
| Nimonic 95 | |||||||
| Nimonic C-22 | |||||||
| Nimonic C-263 | 2,4650 | NiCr20CoMoTi | HR10 | NCK20D | |||
| Nimonic C-276 | ASME SB575 | 2,4819 | |||||
| Nimonic PE 13 | 5536E | NiCr22Fe18Mo | HR6,204 | NC22FeD | |||
| Nimonic PE 16 | NiFe33Cr17Mo | HR207 | NW11AC | ||||
| Nimonic PK 25 | 5751A | NKCD20ATU | |||||
| Nimonic PK 31 | |||||||
| Nimonic PK 33 | NiCr20Co16MoTi | 5057 | NC19KDU/V | ||||
| R-235 | |||||||
| Refractaloy 26 | AISI:690 | Z6NKCDT38 | |||||
| Rene’ 100 | NiCo15Cr10MoAlTi | ||||||
| Rene’ 125 | |||||||
| Rene’ 41 | 5712, 5713 | NiCr19Co11MoTi | NC19KDT | ||||
| Rene’ 63 | |||||||
| Rene’ 77 | |||||||
| Rene’ 80 | |||||||
| Rene’ 95 | NC14K8 | ||||||
| TRW VIA | NiTa9Co8W6CrAl | ||||||
| Udimet 500 | AISI:684 | NiCr18CoMoAlTi | NCK19DAT | ||||
| Udimet 520 | |||||||
| Udimet 630 | NiCr19NbMo | ||||||
| Udimet 700 | AISI:687 | NiCo15Cr15MoAlTi | NCKD20AT | ||||
| Udimet 710 | NCK18TDA | ||||||
| Udimet 718 | 5583 | NiCr19Fe19NbMo | HR8 | NC19FeNb | |||
| Waspaloy | 5544 | 2,4654 | NiCr20Co14MoTi | NC20K14 | |||
Наимено- вание | Титановые сплавы-α | ||||||
| Ti-5Al-2.5Sn | ASTM: B 265 | TiAl5Sn2 | TA 14,17 | T-A5E | |||
| Ti-7Al-4Mo | ASTM: B 381 | TiAl7Mo4 | |||||
| Ti-8Al-1Mo-1V | 4915, 4933, 4972 | TiAl8Mo1V1 | |||||
| Ti-6Al-4Zr-2Mo-2Sn | 4919, 4975,4976 | TiAl6Zr4Mo2Sn2 | |||||
Наимено | Титановые сплавы-αβ | ||||||
| Ti-6Al-4V | 4906, 4920, 4928, 4965, 4967 | TiAl6V4 | TA 10-13; TA 28 | T-A6V | |||
| Ti-6Al-6V-2Sn | 4971 | TiAl6V6Sn2 | |||||
| Ti-4Al-4 Mo-2Sn-0.5Si | TiAl4Mo4Sn2Si0.5 | 5103 | T-A4DE | ||||
| Ti-4Al-4 Mo-4Sn-0.5Si | TiAl4Mo4Sn4Si0.5 | 5203 | |||||
| Ti-7Al-4Mo | ASTM: B 381 | TiAl7Mo4 | |||||
| Ti-6Al-5Zr-0.5Mo-0.25Si | TiA6Zr5Mo0.5Si0.25 | T-AGZ-50 | |||||
| Ti-6Al-5Zr +4Mo-Cu-0.2Si | TiAl6Zr5Mo4CuSi0.2 | M201 | |||||
| Allvac 3-2.5 | 4943, 4944 | ||||||
| Allvac 6-4ELI | 4907, 4930, 4931 | ||||||
| Allvac 6-2-4-6 | 4981 | ||||||
| Allvac Ti-17 | 4995 | ||||||
Наимено- вание | Титановые сплавы-β | ||||||
Ti-13V-11Cr- 3Al | 4917 | TiV13Cr11Al3 | |||||
| Ti-8Mo-8V-2Fe-3Al | |||||||
| Ti-3Al-8V-6Cr-4Mo-4Zr | |||||||
| Ti-11.5Mo-6Zr-4.5Sn | |||||||
Наимено- вание | Титановые сплавы-чистые | ||||||
| Ti 99.5 | ASTM: B381F4 | Ti 99.5 | TA 6 | AIR:9182 T60 | |||
| Ti 99.6 | ASTM: B381F3 | Ti 99.6 | AIR: 9182 T50 | ||||
| Ti 99.7 | ASTM: B381F2 | Ti 99.7 | TA 2-5 | AIR: 9182 T40 | |||
| Ti 99.8 | ASTM: B381F1 | Ti 99.8 | TA 1 | AIR: 9182 T35 | |||
ARCTIC.OPL ECO LED TH Светодиодные пылевлагозащищенные светильники c узким корпусом
ARCTIC.OPL ECO LED TH
Серия светильников в узком корпусе (TH) со степенью защиты IP65 и высокой светоотдачей. Большое количество модификаций, различающихся габаритными размерами и световым потоком для замены светильников типа ЛСП.
Установка
Крепление светильника непосредственно на поверхность потолка или стен без использования монтажных пластин. Для установки светильника на подвесы необходимо заказывать свпециальные крепления: Комплект крепления светильника ARCTIC на трос с витым крюком (код заказа — 2069000330). Под заказ возможно изготовление светильника со сквозной проводкой.
Конструкция
Корпус SMC — полиэстер усиленный стекловолокном.
Оптическая часть
Опаловый рассеиватель (OPL) из поликарбоната крепится к корпусу защелками из полиамида. Под заказ возможна комплектация с защелками из нержавеющей стали. Тип светодиодов: SMD.
Тип источника света
LED
Комплектация
Светильник в сборе. Цветовая температура — 4000К под заказ.
Области использования
- Магазины / бутики
- Промышленные предприятия
- Складские объекты
- II
- IP65
- IK02/0,2 Дж
- УХЛ2
- от 0 до +40
- от -40 до +40
- True
Список моделей
| Название | Световой поток | Мощность | лм/Вт | Диаметр | Высота | Вес | Артикул | Базовая цена |
|---|---|---|---|---|---|---|---|---|
| ARCTIC.OPL ECO LED 600 TH 5000K | 1950 лм | 19 Вт | 103 | 671 мм | 110 мм | 1.5 кг | 1088000030 | 3 698 р |
| ARCTIC.OPL ECO LED 1200 TH 5000K | 3350 лм | 30 Вт | 112 | 1280 мм | 110 мм | 3.6 кг | 1088000010 | 5 463 р |
| ARCTIC.OPL ECO LED 1200 TH 4000K | 3300 лм | 32 Вт | 103 | 1280 мм | 110 мм | 3.6 кг | 1088000240 | 5 463 р |
| ARCTIC.OPL ECO LED 1500 TH 5000K | 4000 лм | 39 Вт | 103 | 1578 мм | 110 мм | 3.2 кг | 1088000020 | 6 295 р |
| ARCTIC.OPL ECO LED 1500 TH EM 5000K | 4000 лм | 39 Вт | 103 | 1578 мм | 110 мм | 3.9 кг | 1088000250 | 11 768 р |
| Кузов | Цвет | Черный |
|---|---|---|
| Габаритные размеры | Ширина | 946 мм (37-1 / 4 «) |
| Высота | 139 мм (5-1 / 2 «) | |
| Глубина | 404 мм (15-15 / 16 дюймов) | |
| Масса | Масса | 6.6 кг (14 фунтов 9 унций) без батарей |
| Клавиатура | Количество ключей | 61 |
| Сенсорное реагирование | Мягкий, средний, жесткий, фиксированный | |
| Другие контроллеры | Угловой изгиб | Есть |
| Ручки управления | Есть | |
| Дисплей | Тип | ЖК-дисплей (жидкокристаллический дисплей) |
| Язык | Английский | |
| Панель | Язык | Английский |
| Генерация тона | Технология генерации тона | Стерео сэмплирование AWM |
| Полифония | Количество полифоний (макс.) | 48 |
| Предустановка | Количество голосов | 758 (237 панельных тембров + 24 набора ударных / спецэффектов + 40 арпеджио + 457 тембров XGlite) |
| Избранные голоса | 8 Sweet! Голоса, 3 Круто! Голоса, 3 динамических голоса | |
| Совместимость | GM | Есть |
| XGlite | Есть | |
| Типы | DSP | 10 типов (назначаются на ручках управления) |
| Реверберация | 12 типов | |
| Хор | 5 типов | |
| Главный эквалайзер | 6 типов | |
| Гармония | 26 типов | |
| Функции | Dual / Layers | Есть |
| Сплит | Есть | |
| Арпеджио | 150 типов | |
| Подавитель мелодий | Есть | |
| Кроссфейд | Да (для внутреннего / AUX IN) | |
| Предустановка | Количество предустановленных стилей | 235 |
| аппликатура | Многопальцевый | |
| Управление стилем | ACMP ВКЛ / ВЫКЛ, СИНХРОНИЗАЦИЯ, СИНХРОНИЗАЦИЯ, СТАРТ / СТОП, ВВЕДЕНИЕ / ЗАВЕРШЕНИЕ / rit., ОСНОВНОЕ / АВТО ЗАПОЛНЕНИЕ, ТРЕК ВКЛ / ВЫКЛ | |
| Формат файла | Формат файла стилей (SFF) | |
| Прочие функции | Настройка в одно касание (OTS) | Есть |
| Расширяемость | Стиль расширения | 10 |
| Предустановка | Количество пазов | 35 |
| Кол-во секций | 5 (4 раздела + 1 музыкальный апогей / финал) | |
| Предустановка | Количество предустановленных композиций | 30 |
| Запись | Количество композиций | 10 |
| Кол-во дорожек | 6 (5 мелодий + 1 создатель стиля / грува) | |
| Объем данных | Прибл.19 000 нот (когда записаны только «мелодические» дорожки) | |
| Функция записи | Есть | |
| Совместимый формат данных | Воспроизведение | SMF (форматы 0 и 1) |
| Запись | Исходный формат файла (функция преобразования SMF 0) | |
| Время записи (макс.) | 80 минут (прибл. 0,9 ГБ) на композицию | |
| Формат | Воспроизведение | WAV (44,1 кГц, 16 бит, стерео) |
| Запись | WAV (44,1 кГц, 16 бит, стерео) | |
| Тип отбора проб | Обычный, Один выстрел, Петля | |
| Сэмплы (пресет / пользователь) | 5 | |
| Время выборки | Прибл.9,6 с | |
| Источники отбора проб | ВХОД ВСПОМ. | |
| Формат выборки | Исходный формат файла (16 бит, стерео) | |
| Частота дискретизации | 44,1 кГц | |
| Аудиоинтерфейс USB | 44,1 кГц, 16 бит, стерео | |
| Регистрация | Количество кнопок | 4 (х 8 банков) |
| Общий контроль | Метроном | Есть |
| Диапазон темпа | 11–280 | |
| Транспонировать | от -12 до 0, от 0 до +12 | |
| Тюнинг | 427.0 — 440,0 — 453,0 Гц (с шагом примерно 0,2 Гц) | |
| Настройка шкалы | Есть | |
| Разное | Кнопка PIANO | Да (кнопка Portable Grand) |
| Склад | Внутренняя память | Прибл. 1,73 МБ |
| Внешние диски | Флэш-накопитель USB | |
| Возможности подключения | ВХОД ПОСТОЯННОГО ТОКА | DC IN 12 В |
| ВХОД ВСПОМ. | Да (стерео-мини) | |
| Наушники | x 1 (ТЕЛЕФОНЫ / ВЫХОД) | |
| Педаль сустейна | Есть | |
| USB К УСТРОЙСТВУ | Есть | |
| USB К ХОСТУ | Да (MIDI / аудио: 44.1 кГц, 16 бит, стерео) | |
| Усилители | 6 Вт + 6 Вт (при использовании адаптера переменного тока PA-150) | |
| Динамики | 12 см x 2 | |
| Блок питания | Адаптеры переменного тока (PA-150 или аналог, рекомендованный Yamaha) или батареи (шесть щелочных (LR6), марганцевых (R6) или никель-металлгидридных аккумуляторных (HR6) батарей размера «AA») | |
| Потребляемая мощность | 8 Вт (при использовании адаптера переменного тока PA-150) | |
| Функция автоматического отключения питания | Есть | |
| Принадлежности в комплекте | Пюпитр | Есть |
| Сборник песен | Скачать с сайта | |
463 мм (18 дюймов), фиксатор со штифтом
- Обзор технических характеристик
- Ширина
18.2 дюйма (463 мм) - Объем
7,1 фут³ (200 л) - Вес
551,2 фунта (250 кг) - Толщина базовой кромки
1,3 дюйма (32 мм)
Ковши Cat® для тяжелых условий эксплуатации для экскаваторов-погрузчиков хорошо подходят для полукристаллических грунтов или там, где необходимо выламывать и удалять твердые насыпи.
- Ширина 18,2 дюйма (463 мм)
- Вместимость 7,1 фут3 (200 л)
- Вес 551,2 фунта (250 кг)
- Толщина базовой кромки 1.3 дюйма (32 мм)
- Радиус наконечника 45 дюймов (1144 мм)
- Тип интерфейса ()
Стандартное оборудование
Система впуска воздуха
- Выпускной коллектор из чугуна — боковой выпуск
- Впускной коллектор
Система контроля
- Генератор 12 В
- Стартер на 12 В
- Электронный запорный соленоид (ESOS)
Система охлаждения
- Насос охлаждающей жидкости с ременным приводом
- Реле температуры охлаждающей жидкости
- Вентилятор охлаждения
Топливная система
- ТНВД
- Накрутка топливного фильтра
Общий
- Блок цилиндров из чугуна
- Закрытый сапун
- Устройство для облегчения пуска свечей накаливания
- Возможность холодного пуска до –20 ° C (-4 ° F) (с поддержкой)
- Преодолеваемый подъём под углом 35 ° непрерывный
Масляная система
- Реле давления смазочного масла
- Картер смазочного масла
- Накрутка масляного фильтра
Дополнительное оборудование
Криоконсервация гемопоэтических стволовых клеток
Am J Hematol.Авторская рукопись; доступно в PMC 2007 12 ноября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2075525
NIHMSID: NIHMS23297
Медицинский центр Роджера Уильямса, отделение трансплантации костного мозга, Восточное крыло, Провиденс, Родереспон,
Кому: Дэвиду Берцу, доктору медицины, доктору философии, Медицинский центр Роджера Уильямса, отделение трансплантации костного мозга, Восточное крыло, 825 Chalkstone Avenue, Providence, RI 02908-4735. Электронная почта: ten.labolgcbs@ZREB См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Трансплантация стволовых клеток представляет собой важный подход к лечению многих злокачественных и незлокачественных заболеваний. В основе этих подходов лежит способность криоконсервировать клетки костного мозга для будущего использования. Этот метод обычно используется во всех аутологичных условиях и имеет решающее значение при трансплантации пуповинной крови. Различные криоконсерванты использовались с различными методами замораживания и оттаивания, как описано в следующих главах. Эффективность замораживания неоднократно доказывалась, и была установлена способность длительного хранения костного мозга к повторному заселению.Стандартные подходы, описанные здесь, используются во многих лабораториях, поскольку эта область продолжает развиваться.
Ключевые слова: стволовые клетки, костный мозг, криоконсервант, методы замораживания
ВВЕДЕНИЕ
Роль трансплантации гемопоэтических стволовых клеток в лечении гематологических и негематологических злокачественных новообразований быстро возрастает. В определенных ситуациях свежие стволовые клетки могут использоваться при аллогенной трансплантации. Если передача от донора к реципиенту может быть осуществлена в течение 72 часов, протоколы предварительного хранения при температурах выше нуля должны быть на месте.Однако современные терапевтические стратегии требуют криоконсервации клеток-предшественников практически для всех аутологичных и многих аллогенных трансплантатов. Доказано, что эта стратегия безопасна и не связана со значительными неблагоприятными исходами, связанными с невозможностью приживления, болезнью трансплантата против хозяина (GVHD) или неудачей приживления [1].
Процесс криоконсервации важен для всех типов сбора стволовых клеток, но, возможно, особенно важен для пуповинной крови (UCB).Фактический трансплантат здесь собирают во время рождения и используют позже для еще, на момент сбора урожая, часто неопределенного реципиента. UCB обычно хранится в государственных или частных банках пуповинной крови. Государственные банки пуповинной крови, как правило, являются некоммерческими организациями, которые предлагают донорское отделение соответствующим получателям через национальные или международные реестры потенциальным нуждающимся реципиентам [2]. В банках пуповинной крови хранятся донорские образцы для донора или, в случае государственных банков, для неизвестного получателя в течение неопределенного периода времени.В настоящее время насчитывается около 170 000 замороженных единиц в 37 регистрах пуповинной крови в 21 стране. На сегодняшний день пересажено две тысячи девятьсот единиц, и взрослые получили около одной трети этих единиц [3].
Процесс криоконсервации включает в себя следующие общие компоненты:
Сбор донорских клеток, который влечет за собой фактический сбор образца и уменьшение объема.
Добавление криоконсервантов
Фактическая процедура замораживания
Оценка жизнеспособности замороженного блока примерно через 72 часа
Процедура размораживания
Промывка и кондиционирование донного блока до трансплантации
Ни один метод криоконсервации не применялся повсеместно.В разных центрах трансплантации возможны различия в технике. Наш обзор показал, что за последние 15 лет наблюдались небольшие изменения [4]. В нашем учреждении мы используем стандартизированный протокол NIH для сохранения образцов аллогенных и аутологичных периферических гемопоэтических стволовых клеток и трансплантатов костного мозга.
Мы собираем гемопоэтические стволовые клетки-предшественники с минимальными манипуляциями, как определено Фондом аккредитации терапии гемопоэтическими клетками (FAHCT), с минимальной дозой клеток не менее 2.5 × 10 6 –5,0 × 10 6 CD34 (+) клеток / кг массы тела, как в настоящее время считается стандартом [5]. Затем образец центрифугируется для образования осадка, богатого клетками. В аутотрансплантатах используется донорская плазма. Супернатант из этого процесса криопреципитации используется для повторного разжижения клеток осадка после добавления раствора гепаринизированного раствора плазмалита и 10% ДМСО (диметилсульфоксида). Обычно это приводит к концентрации клеток в криоконсервате 500 × 10 -6 клеток.Мы храним костный мозг или продукт стволовых клеток периферической крови при исходной температуре –4 ° C [6]. Затем образец замораживают до целевой температуры от –156 ° C (при хранении в паровой фазе) до –196 ° C (при хранении в жидкой фазе), в зависимости от того, где в контейнере хранится образец. Чтобы гарантировать целостность донорской единицы до миелоаблативной терапии, проводится повторная оценка жизнеспособности единицы с использованием анализа трипанового синего и, если это сомнительно, анализа йодида пропидия. Перед самой инфузией стволовых клеток образец быстро размораживают на водяной бане с температурой 37 ° C.
Некоторые элементы процедуры криоконсервации все еще остаются предметом обсуждения. Опубликованы алгоритмы, различающиеся температурой замерзания, скоростью замерзания, криоконсервантами, долговечностью, температурой оттаивания и скоростью оттаивания. В этой статье будет рассмотрен статус литературы по некоторым из этих элементов [4,7,8].
ТЕМПЕРАТУРА
Температура, используемая для криопрезервации гемопоэтических стволовых клеток за последние пятнадцать лет, составляла −196, −156 или −80 ° C, что отражает температуры хранения в жидком и парообразном азоте и в механических морозильных камерах для криоконсервации. соответственно.Развитие использования криоконсервантов происходило от более низких температур примерно -196 ° C в 1980-х годах до примерно -80 ° C в 1990-х годах [2,9–16]. Аналогичные тенденции наблюдаются и для изолированных стволовых клеток пуповины. Стандартные температуры, используемые в настоящее время, составляют от –196 до –80 ° C [17–19]. В дополнение к недавним сообщениям о распространении инфекционных агентов (т. Е. Аспергилл, а также распространения вирусов) через жидкую фазу резервуаров с азотом, в настоящее время рекомендуемые оптимальные условия хранения находятся в фазе парообразного азота при -156 ° C.Механические морозильники могут стать жизнеспособной альтернативой.
Кроме того, в нескольких исследованиях изучалась возможность хранения HSC при температуре выше нуля, при 4 ° C. Доклиническое исследование, в котором изучали PBSC, мобилизованные в аутологичной плазме с помощью анализов клоногенности и жизнеспособности после хранения, показало, что хранение до пяти дней является безопасным [20]. Небольшая серия случаев, проведенная Руисом-Аргуэльесом и др. успешно использовали PBPC после 96 часов хранения при 4 ° C для спасения после химиотерапии высокими дозами [21].
СКОРОСТЬ ЗАМОРАЖИВАНИЯ
Скорость замораживания широко обсуждалась в литературе.Техника замораживания с контролируемой скоростью по-прежнему считается стандартной, в основном из-за того, что выделение тепла в переходной или эвтактической точке (около 4 ° C) считается вредным для популяции стволовых клеток. В этот момент молекулы воды в замороженном блоке находятся в точном молекулярном порядке, что приводит к термодинамическому выделению тепла термоядерного синтеза.
При замораживании с контролируемой скоростью концентрированные стволовые клетки замораживаются со скоростью 1-2 ° C / мин до температуры около -40 ° C.Затем процесс замораживания до целевого значения -120 ° C выполняется в более быстром темпе, примерно 3-5 ° C / мин. Для стволовых клеток пуповины, костного мозга и PBSC процесс замораживания с контролируемой скоростью считается стандартным [22–24], и в различных отчетах было обнаружено, что он превосходит методы неконтролируемого замораживания. Эта процедура занимает много времени и требует наличия персонала со специальными знаниями. Следовательно, было оценено использование замораживания с неконтролируемой скоростью, при котором образец сначала охлаждают до -4 ° C, а затем сразу помещают в морозильную камеру при -80 ° C или помещают в жидкую фазу азота.В нескольких отчетах [9,12,13] установлено, что неконтролируемый метод безопасен и показывает результаты, сопоставимые с процессом с контролируемой скоростью для BM и PBSC. Контролируемое исследование, проведенное Perez-Oteyza et al. [14] показали, что подходы к замораживанию с контролируемой и неконтролируемой скоростью сравнимы с точки зрения тестирования жизнеспособности и что только статистически значимое снижение клональности CFU-GM может быть обнаружено в ситуации неконтролируемого замораживания. Недавние исследования показали, что неконтролируемое замораживание также является жизнеспособным подходом для стволовых клеток UCB [25,26].Не существует единого мнения о значимости компенсации теплоты плавления во время процедуры замораживания [6]. Однако исследование Balint et al. подчеркнули важность этого вмешательства, сравнив пять различных протоколов замораживания [6]. Протоколы, использующие пятиступенчатый подход к контролируемому замораживанию, компенсирующий тепло плавления, обеспечивают лучшую жизнеспособность после размораживания.
ДОЛГОВЕЧНОСТЬ
Фактическая долговечность, определяемая как время, в течение которого стволовые клетки могут сохраняться, все еще не ясна.Жизнеспособность стволовых клеток при криоконсервации подвергалась сомнению в различных исследованиях после 6 месяцев криоконсервации [10]. Дальнейшие исследования продемонстрировали длительное время замораживания при полном сохранении функции стволовых клеток.
Для оценки функциональной способности к восстановлению кроветворения сначала замороженных, а затем размороженных образцов используются несколько анализов на замену. В то время как BFU-E и CFU-GM, по-видимому, нарушаются раньше в ходе криоконсервации, восстановление ядерных клеток (NC) и клеток CD34 + и фактическое приживление у мышей NOD / SCID, по-видимому, сохраняются в течение более длительного периода времени [ 2,9,12,14 15,27,28].Эти наблюдения первоначально были сделаны в костном мозге и PBSC, аналогичные наблюдения были сделаны на стволовых клетках UBC [18,29–33]. Анализ на мышах NOD / SCID в настоящее время считается наиболее ценным анализом для оценки гематологического восстановления препаратов HSC [34–37], но обычно не является практичным. После Кобылки и др. [38] и Mugishima et al. [39] доказали надежность через 12 и 15 лет с помощью проточной цитометрии и клоногенного анализа соответственно, а Broxmeyer et al.[30] выполнили переоценку его длительно сохраняемых единиц CB, их долговечность до 15 лет была установлена с использованием гемопоэтического восстановления у мышей NOD / SCID. Клиническая валидность доклинических исследований была задокументирована в отдельных отчетах, когда успешное трехлинейное приживление было достигнуто с помощью BM, хранимого в течение 7 лет [26]. Систематический обзор, оценивающий совместный опыт Бригама и женской больницы и группы EBMT [11], показал, что HSC можно эффективно криоконсервировать на срок до 11 лет.Ретроспективное исследование, проведенное в Сиэтле, показало полное трехлинейное восстановление у пациентов, получавших HSC, которое сохранялось до 7,8 лет без стойких вредных эффектов [27].
КОНЦЕНТРАЦИЯ КЛЕТОК
Реинфузия криоконсервированных клеток была связана с различной токсичностью, которая частично объяснялась общим объемом и криоконсервантами в растворе [7,8,40]. В прошлом высказывались опасения, что высокая концентрация клеток в криоконсервате может привести к токсичности для клеток.Следовательно, первоначально предложенная концентрация криоконсервированных клеток не превышала 2 × 10 –7 / мл NC [11,41]. В результате объем криоконсервации составит около 7 л [10] на пациента. Необходимые места для хранения и трудозатраты для промывки трансплантата перед повторной инфузией будут огромными [4].
После того, как первоначальные мышиные модели были признаны безопасными, Rowley et al. установили, что высокие концентрации клеток (до 5,6 × 10 –8 клеток / мл) в криоконсервате хорошо переносятся, не связаны со значительным неблагоприятным воздействием на клетки и приводят к хорошим клиническим исходам [4].Подобные выводы были сделаны из последующих исследований Kawano et al. [42] и Cabezudo et al. [43]. Для практических целей кажется достижимой концентрация клеток 200 × 10 −6 / мл [4,44,45].
КРИОПРЕСЕРВАНТЫ
Криоконсерванты являются необходимыми добавками к концентратам стволовых клеток, поскольку они ингибируют образование внутри- и внеклеточных кристаллов и, следовательно, гибель клеток. Стандартный криопротектор — ДМСО, предотвращающий повреждение живых клеток от замерзания [46].Первоначально он был использован в медицине как противовоспалительный реагент и до сих пор иногда используется при аутоиммунных расстройствах [47, 48]. Обычно он используется в концентрации 10% в сочетании с физиологическим раствором и сывороточным альбумином [2,9,13,49]. Было установлено, что это безопасный и не токсичный агент для стволовых клеток [49]. Однако ДМСО связан с клинически значимым профилем побочных эффектов. Тошнота, рвота и спазмы в животе возникают примерно в половине случаев [50]. Другие побочные эффекты включают сердечно-сосудистые [7], респираторные [51,52], ЦНС [8,53–55], почечные, гемолитические [56] и гепатотоксические проявления.Сообщалось о смертельных случаях, связанных с токсичностью ДМСО [57].
Недавнее международное анкетирование, включающее данные из 97 центров трансплантации EBMT, показало, что токсичность, связанная с ДМСО, кроме тошноты и рвоты, наблюдается примерно в одной из 50 трансплантатов со средней частотой 2,2% от всех введенных единиц. Побочные эффекты со стороны сердечно-сосудистой системы были наиболее часто наблюдаемой группой нежелательных явлений в 27% участвующих центров. Респираторные нарушения наблюдались у 17%, токсичность ЦНС, включая судороги, у 5% и побочные эффекты со стороны почек у 5% [58].
На основании этих соображений токсичности были опробованы новые подходы. Было установлено, что более низкие дозы ДМСО, варьирующиеся от 2,2 до 6% [9,10,12,59,60], эффективны для костного мозга и PBSC, а также для UCB. Напротив, в югославском исследовании сравнивали 10% -ную концентрацию ДМСО с более низкими концентрациями при различных скоростях замораживания. В этом исследовании in vitro было доказано, что криоконсервация 10% ДМСО превосходит более низкие концентрации [6]. Для усиления эффекта криоконсерванта комбинация ДМСО и внеклеточного криопротектора гидроксиэтилкрахмала (HES) успешно использовалась в PBSC, трансплантатах костного мозга [12,13] и клетках UCB.
Альтернативными методами криоконсервации являются пропиленгликоль, комбинация альфа-токоферола, каталазы и аскорбиновой кислоты, а также димер глюкозы трегалоза в качестве внутри- и внеклеточного криопротектора [28,32,61].
Интересные доклинические данные из Германии позволяют предположить, что активация каспаз, особенно во время процесса оттаивания, может вызвать апоптоз и, следовательно, способствовать криовоздействию трансплантатов трансплантата. Добавление ингибитора каспаз zVAD-fmk в качестве криоконсерванта представляет интригующую перспективу на будущее [62].
РАЗМОРАЖИВАНИЕ
Было предложено несколько методов оттаивания. Стандартный метод — нагревание на водяной бане при 37 ° C до исчезновения всех кристаллов льда [13]. В немецком исследовании сравнивалось размораживание криоконсервированных единиц в теплой водяной бане с сухим теплом, прикладываемым гелевыми подушечками при 37 ° C. Жизнеспособность и клоногенный потенциал были сопоставимы с тенденцией к меньшему заразному заражению при сухом методе [63]. Различные исследования изучали сохранение функции при инкубации размороженных единиц при 0–37 ° C [13,31].Никаких существенных различий не было обнаружено в исследовании Yang et al. которые сравнили инкубацию размороженного блока при 0, 20 и 37 ° C в течение 20 минут [31]. Используемый криоконсервант оказался нетоксичным для стволовых клеток в процессе криоконсервации, как уже было установлено в предыдущих исследованиях [4,49]. Уменьшение содержания ДМСО при температуре оттаивания — интригующая концепция из-за профиля клинической токсичности этого криоконсерванта. Следовательно, эффект снижения содержания ДМСО в растворе для оттаивания посредством промывки или разбавления был исследован [59,64].Наблюдалось незначительное влияние на жизнеспособность стволовых клеток или его отсутствие. Автоматический метод вымывания криоконсерванта доказал свою применимость на доклинических моделях [65].
ПРОЦЕДУРА ПРОМЫВКИ
Для стволовых клеток пуповинного происхождения, периферической крови и костного мозга процесс вымывания криоконсерванта после оттаивания все еще можно считать стандартным [19,32], поскольку предполагается, что ДМСО обладает токсическим действием. на стволовые клетки. Это было поставлено под сомнение в нескольких более поздних отчетах, которые предполагали устойчивость стволовых клеток к воздействию ДМСО [13,49].Отмывка самого популярного криоконсерванта имеет очевидные преимущества для реципиента, т.е. снижает токсичность, поскольку степень токсичности ДМСО пропорциональна количеству ДМСО, содержащегося в инфузированном растворе стволовых клеток [66]. Было также высказано предположение, что отмывка от ДМСО может улучшить приживление [67]. Это оспаривается [68].
Текущий стандартный протокол промывки соответствует протоколу Нью-Йоркского центра крови [19], в котором двухэтапное разведение размороженной единицы стволовых клеток с 2.5% сывороточного альбумина человека и 5% декстрана 40 затем центрифугировали при 10 ° C в течение 10 мин. Затем удаляют супернатант и снова дважды добавляют раствор HSA и декстрана до конечной концентрации ДМСО менее 1,7%. Промытый раствор настаивается при первой возможности. Хотя было установлено, что эта процедура безопасна и связана с разумным восстановлением NC и анализами предшественников [69], она также очень трудоемка и не свободна от потери клеток [70,71]. Недавно были представлены новые автоматизированные устройства для промывки клеток с многообещающими результатами [50,65,72,73].
КОНТЕЙНЕРЫ ДЛЯ ХРАНЕНИЯ
Международное общество клеточной терапии (ISCT) описало на своем веб-сайте информации о поставщиках криоконтейнеров девять различных продуктов для криоконтейнеров. Шесть из них основаны на этинилвинилацетате (EVA) и обычно подвергаются гамма-облучению.
Товарные знаки:
Cryocyte / Baxter
CellFlex / Maco Pharma
Cell Freeze ™ Charter Medical
Pall Медицинский мешок для замораживания Cryoreome 905/05 Inc.
Thermogenesis Corp./ Мешок для замораживания 80346-0
Другие продукты, не основанные на этиленвинилацетате:
American Fluoroseal / FEP (тефлон)
Fresenius Hemocarelon
Teflon / HemofreezeOrigen Biomedical Inc./Permalife Bag, FEP / Polyimide
Были предприняты другие подходы. Чешская группа опубликовала свой успешный опыт использования контейнера для криоконсервации из нержавеющей стали, специально разработанного для PBSC [74].В США наиболее часто используемым криоконтейнером является мешок для замораживания из этиленвинилацетата (Yang, 2005 [75]), [76].
Использование специальных контейнеров, полиэтиленовых пакетов из ПВХ и полиолефина и полиэтиленовых флаконов для криоконсервации дало разные результаты в отношении жизнеспособности хранимых образцов. Пакеты из ПВХ и полиолефина показали удовлетворительные результаты, в то время как флаконы для криоконсервации из полиэтилена не показали этого в одном исследовании [2]. Группа из Бостона предположила, что криопакеты из полиолефина обладают более длительным сроком службы, чем пакеты из ПВХ.
ИНФЕКЦИОННЫЕ СООБРАЖЕНИЯ
Микробное заражение трансплантатов представляет значительную опасность для реципиента с тяжелой иммуносупрессией. По оценкам FDA, семи смертей, связанных с трансплантацией, в год можно избежать за счет устранения инфекции, связанной с инфузиями донорских клеток [77]. Общие продемонстрированные уровни микробиологического загрязнения составляют 0–4,5% [27,78–83].
Основные части культивируемых бактерий — это кожная флора и комменсальные бактерии. Остальная часть в основном состоит из кишечных бактерий.Следует отметить, что криогенные клетки, полученные из костного мозга, с гораздо большей вероятностью будут заражены патогенами, что объясняется процессом сбора. Уровни контаминации между PBSC и костным мозгом значительно различаются до шестнадцати раз (0,23% для PBSC и 3,8% для BM) [84].
отображает частоту, с которой различные патогены культивировались из донорских единиц в четырех различных исследованиях, посвященных бактериальному загрязнению продуктов стволовых клеток [78,82–84]:
ТАБЛИЦА I
Культивированные организмы / общая частота положительных культур
