Что такое фаза и ноль в электрике: назначение, отличие
К такому явлению как электричество уже давно все привыкли. Многие термины мы употребляем в обиходе, обладая лишь поверхностным пониманием. Между тем, путь пройденный электричеством от электростанции до вашей розетки непрост.
Существует множество факторов, влияющих на бесперебойную подачу электроэнергии к конечному потребителю. Все нюансы рассматривать в данной статье не будем, ограничимся лишь такими терминами как “ФАЗА” и “НОЛЬ”.
Итак, для чего нужны фаза и ноль в электрике, и что это вообще такое. Для более полного понимания вернемся опять к электростанции. Берем в качестве примера некую электростанцию, на которой происходит следующее:
- 1. Трехфазные генераторы переменного тока вырабатывают ток
- 2. По линиям электропередач ток поступает на трансформаторные подстанции
- 3. С трансформаторных подстанций ток поступает в дома и т.д.
Теперь немного подробнее.
Дело в том, что на электрощиток многоквартирного дома приходит три фазы, ноль и заземление. Далее, вводно-распределительные устройства (ВРУ) разделяют все три фазы, при этом каждый фазный провод получает свое заземление и свой ноль.
Понятное дело, что без подготовки эту информацию не усвоить, поэтому ниже мы остановимся и расскажем об этом более подробно.
Что представляет собой фаза и ноль в трехфазной сети
Как мы знаем из школьного курса физики – электрический ток движется только в замкнутом контуре. То есть по одному проводу он должен прийти, а по другому уйти. Чтобы не морочить голову, сразу даем определение:
- — Фаза – проводник, по которому к потребителю приходит ток;
- — Ноль – проводник, по которому ток уходит от потребителя.
Для правильной работы электрическому току всегда необходим замкнутый контур. Ток течет в одном направлении. Фазный провод – провод, по которому ток приходит к любой нагрузке, будь-то электрочайник или холодильник, неважно. Ноль – провод, по которому ток возвращается.
Кроме этого нулевой провод выполняет еще одну полезную функцию – выравнивает фазное напряжение. Заземление – провод, на котором нет напряжения. Он служит резервным проводом для того, чтобы в случае утечки тока защитить человека от удара.
Теперь возьмем трансформатор, который питает дом. Трансформатор – устройство, повышающее, либо понижающее напряжение в сети. Чтобы конечный потребитель получил питание, к обмоткам низкого напряжения подключаются четыре провода. К выводам трансформаторной обмотки подключаются три провода (это и есть наши фазы), а ноль (еще называют “общий”) берется из точки соединения трансформаторных обмоток.
Теперь рассмотрим еще два термина и сразу дадим им определения:
- 1.
 Линейное напряжение – напряжение, возникающее между фазными проводами в трехфазной электросети. Номинальное значение линейного напряжения – 380 вольт.
Линейное напряжение – напряжение, возникающее между фазными проводами в трехфазной электросети. Номинальное значение линейного напряжения – 380 вольт. - 2. Фазное напряжение – напряжение между одним фазным проводом и нулем. Номинальное значение такого напряжения – 220 вольт.
Существуют системы, в которых заземление присоединяют именно к нулевому проводу. Такая система носит название “глухозаземленная нейтраль”.
Делается это так: обмотки в трансформаторе соединяются по типу “звезда” (есть еще и соединение “треугольник”, а такде различные сочетания этих соединений, но об этом в другой раз). После этого нейтраль заземляют. Тогда наш ноль одновременно служит и заземлением (совмещенный нейтральный проводник, PEN).
Такой тип заземления практиковали в советское время при постройке жилых домов. Проще говоря, в таких домах электрощиток зануляют. Однако такой метод достаточно опасен, поскольку в некоторых случаях ток может пройти через ноль, возникнет отличный от нуля потенциал, результат варьируется от удара током до небольшого опасного фейерверка.
В наше время к жилым домам также подводят три фазы, но помимо трех фазных проводов, между трансформатором и домом также присутствуют отдельно нулевой провод отдельно провод заземления. На каждой подстанции имеется контур заземления: в случае утечки тока в электросистеме жилого дома — ток возвращается к заземлению на подстанции.
При монтаже такой сети необходимо учитывать, что в электрощите должны присутствовать отдельные шины для фаз, отдельная шина для нуля, отдельная шина для заземления. Внимание, при монтаже заземления не забудьте о том, что шина заземления должна быть соединена металлически с корпусом электрощитка.
На самом деле, аварийные ситуации, так или иначе связанные с отсутствием заземления или с совмещением нуля и заземления, в трехфазных сетях происходят периодически, поэтому заземление действительно необходимо. Немного отвлечемся и посмотрим, какие ситуации наиболее часто распространены.
Для правильной эксплуатации вся нагрузка должна быть равномерно распределена между фазами.
Из-за этого смещения между нулевым проводом и проводом заземления появляется разность потенциалов. Если же нулевой провод имеет сечение, которого недостаточно, то пресловутая разность потенциалов увеличивается.
А когда фазы теряют связь с нейтральным проводником, получаются две следующих ситуации:
- 1. Если фазы нагружены до предела, то напряжение падает до нуля;
- 2. Если фазы наоборот не нагружены, то напряжение растет до 380.
Как видите, такое напряжение явно уничтожит бытовую технику, рассчитанную на сети в 220 вольт. Помимо этого, в таких ситуациях металлические корпуса электрооборудования тоже будут под напряжением.
Отсюда следует, что использование раздельного варианта нуля и заземления более предпочтительно, так как позволяет обойтись без таких аварийных случаев.
Назначение фазы и нуля
Чтобы полностью понять, что же именно подразумевает словосочетание “фаза и ноль в электрике” обратимся к аналогии. Электрический ток наиболее удобно сравнивать с водой, а токонесущие провода – с трубами.
Итак, представим следующее. У нас имеется одна труба, по которой горячая вода из резервуара поступает в большую кастрюлю. Также имеется вторая труба, которая по мере наполнения кастрюли сбрасывает излишек поступающей горячей воды обратно в резервуар. Теперь расшифровка: первая труба – фаза, кастрюля – полезная нагрузка, вторая труба – ноль. Ток по фазе приходит к нагрузке, а по нулевому проводу уходит обратно. Вот и все.
Теперь представим что произойдет, если из-за неисправности второй трубы горячая вода из кастрюли не будет уходить обратно в резервуар. В этом случае кастрюля очень быстро наполнится, а кипяток начнет с нее выливаться и может нас ошпарить.
Чтобы этого избежать, подводим к кастрюле третью трубу.
Выше мы описали работу тока в однофазной сети, а также назначение фазы и нуля. В трехфазной происходит то же самое, только ток течет одновременно по трем проводам, а возвращается по четвертому.
Из примера становится понятно, что нельзя путать фазу с нулем, а также нельзя их соединять между собой. Для удобства все кабеля имеют свою цветовую маркировку, благодаря которой можно без всяких приборов определить принадлежность провода к фазе или нулю.
Внимание! Для пущей уверенности лучше перед началом работы все-таки прозвонить кабель, несмотря на цветовую маркировку. Очень часто в силу собственного незнания, неопытные электрики вообще не заморачиваются по поводу цвета проводов, и именно из-за этого существует опасность.
По поводу цветовой маркировки. В электричестве приняты следующие обозначения: фазный провод коричневого, черного либо белого цвета, нулевой – голубого или синего, а провод заземления имеет желто-зеленый цвет.
Имейте ввиду, цвета не всегда могут быть такими: не так давно мне в трехфазной сети попались три красных провода (фаза), а нулевой провод был черного цвета.
Способы определения фазы и нуля
Как вы уже поняли, фаза и ноль в электричестве отличаются с помощью цветовой маркировки, но этот способ может быть ошибочным из-за изначально неверного монтажа.
Для более точного определения фазного провода существует отвертка-индикатор. Просто прикоснитесь ею к проводам по очереди. На нулевой провод отвертка никак не отреагирует, но при прикосновении к фазному проводу индикатор загорится. Если же индикатор вообще не сработал, значит ваша электросеть вышла из строя, напряжение в сети отсутствует.
Если же индикатор отреагировал на оба провода, значит в нулевом проводе произошел обрыв.
«Фаза» в электрике обозначается латинской буквой «L» производная от «Line» (линия). Обычно это коричневый или белый провод. «Ноль» обозначается буквой «N» от английского — Neutral (нейтральный). Цвет нулевого провода, как правило, синий или белый но синими полосами по всей длине.
Заземляющий проводник в электрике маркируют как «PE» – Protective Earthing. Он имеет желто-зеленый цвет.
Фаза и ноль в электропроводке
Выше мы уже объяснили, что такое фаза и ноль в электрике, а также принцип их работы. В электропроводке фаза и ноль работают точно также. По фазному проводу производится подача тока, по нулевому – ток возвращается обратно.
Поэтому достаточно один раз понять принцип работы фазы и нуля, и тогда вас не смутит никакая электропроводка, а также вы сможете правильно объяснить соседу, что такое фаза и ноль в электропроводке.
Похожие материалы на сайте:
Понравилась статья — поделись с друзьями!
Что такое фаза ноль земля в электрике и зачем они нужны фото
Все знают, что электроэнергия производится на разнообразных электростанциях, благодаря генераторам переменного тока. После она, используя линии электропередач, идет к трансформаторным подстанциям, оттуда поступает к потребителю, то есть нам.
Так вот чтобы понять, что собой представляет фаза, ноль, а также заземление, необходимо на элементарном уровне понимать, каким образом электроэнергия поступает в подъезд или частный дом. Все мы за нее платим, измеряя киловаттами, но ведь это не вода, у которой можно перекрыть кран. Потому давайте рассмотрим ситуацию подробнее.
Ликбез
Давайте разберемся, чем являются ноль и фаза, а затем перейдем к заземлению.
Фаза – это линия непосредственной подачи тока. Следовательно, используя ноль, ток возвращается в обратном направлении, а именно к нулевому контуру. Кроме того он выравнивает фазное напряжения, выполняя стабилизационную роль в фазной проводке.
Кроме того он выравнивает фазное напряжения, выполняя стабилизационную роль в фазной проводке.
Земля (заземляющий провод) – не под напряжением в принципе. У него есть одна функция – защита потребителя. Если сказать грубо, то «земля» в случае утечки отведет остаточный ток, не дав ему поразить человека.
Хотелось бы думать, что столь простое объяснение несколько прояснило ситуацию, и теперь вы понимаете какая роль у каждого проводника из комплекта: фаза, ноль, земля. Если вы планируете работать с проводами самостоятельно, то дополнительно, рекомендуем изучить цветовую палитру, которой производители отмечают предназначение полупроводников внутри кабеля.
Детальное рассмотрение
Трансформаторная подстанция выполняет важнейшую работу, а именно делает возможным питание потребителей благодаря обмотке низкого напряжения, которая понижает напряжение от «электросетевого» до «потребительского».
От подстанции к потребителю ведет общий проводник от нейтрали (точка соединение обмоток), и еще 3 проводника, которые являются остальными выводами обмотки. Таким образом каждый из трех проводников – это фаза, а нейтраль – ноль.
Таким образом каждый из трех проводников – это фаза, а нейтраль – ноль.
Трехфазная энергетическая схема подразумевает возникновение линейного напряжения, с номинальным напряжением в 380 В. Между фазой и нулем возникает фазное напряжение, его то значение и равняется, привычным нам, 220 В.
Как упоминалось выше под названием «земля» скрывается заземление, так и будем его называть. Так вот большинство электрических систем глухозаземленные, это значит, что ноль прямо соединен с землей. Физическая суть такого подключения в том, что в трансформаторе обмотки соединены по принципу «звезды», а нейтраль заземлена.
В данном случае ноль является совмещенным нейтрально-защитным проводником (PEN). Подобное повсеместно встречается в постройках советского времени. Неизвестно с чем это было связано, то ли с экономией, то ли с введением сомнительных инноваций, но в жилых домах того периода повсеместно занулены щитки, а отдельных заземлительных кабелей не предусмотрено.
Главная проблема такой конструкции в невозможности ее преобразования. Народные умельцы пытаются подключить дополнительный защитный кабель прямо к щитку, но это, по крайней мере, небезопасно.
Подобная самодельная «инновация» может привести к тому, что земля начнет простреливать и как душ, так и туалет начнут сопровождаться периодическими разрядами у всех жильцов дома.
Дома построенные в более позднее время, имеют электросеть отличающуюся следующими аспектами:
- Вместо общего проводника к щитку идет два проводника, один из которых исполняет роль нейтрали, а второй земли.
- Щиток в подъезде имеет отдельную шину-разделитель, которую с корпусом соединяют посредствам металлической связи, она предназначена для подключения нуля, земли и фазы.
Преимуществом подключения с заземлением является то, что заранее неизвестно, сколько тока будет потреблять каждая квартира, а предыдущая схема предполагает близкое к равномерному распределение. В незаземленной схеме возможно возникновение ситуации, когда одна квартира потребляет много, а вторая ничего.
Разность нагрузок начинает смещать нейтраль. Создается ситуация, когда в фазе ток стремится к нулю, а на проводнике-нейтрали напротив растет до 380 В. Кроме того что оборудование при возникновении подобной аварии будет испорчено, его корпус будет находится под напряжением, создавая реальную опасность для людей.
Полезное видео
Дополнительную информацию по данному вопросу вы можете почерпнуть из видео ниже:
Заключение
Будем надеяться, теперь вы знаете значение каждого, из озвученных в названии статьи терминов и как важен проводник «земля». Берегите себя, устанавливая электросеть у себя дома, побеспокойтесь о ней.
что это такое, описание и характеристики
Профессиональные электрики хорошо разбираются в понятиях фаза и ноль. Разобраться в терминологии и уметь определять параметры электрических сетей будет полезно простым обывателям и новичкам профессий, так или иначе связанных с электромонтажными работами. Подобные знания позволят безопасно подключить бытовые приборы, оборудование, розетки или осветительную арматуру.
Подобные знания позволят безопасно подключить бытовые приборы, оборудование, розетки или осветительную арматуру.
Что такое фаза и ноль
Ток поступает в помещение от генераторов, установленных на подстанциях. Из агрегата выходят три фазы и один ноль. Движение электричества закольцовано. По фазовому проводу ток поступает к потребителям, а выходит обратно с помощью нулевого и возвращается в трансформатор. Если движение остановлено, то электроэнергия отсутствует.
Источник: avatars.mds.yandex.netПриборы с помощью розетки включаются в это движение. Возникает вопрос, почему нулевой провод, по которому тоже проходит электричество, не опасен. Все дело в потенциале. Ноль имеет нулевой потенциал. Чтобы разобраться в этом понятии, можно представить два резервуара, один из которых установлен на земле, а второй – зафиксирован на высоте. Если пробить дно второй емкости, то жидкость из нее польется под напором. Потенциал и есть сила течения воды в данном случае. При повреждении дна резервуара, стоящего на земле, жидкость не польется, то есть потенциал будет нулевым. Движение потока из верхней емкости в нижнюю объясняется разницей потенциалов. Применимо к электротехнике, отличие между потенциалами ноля и фазы равно 220 Вольт (для России).
Тело человека обладает нулевым потенциалом. Нулевой провод заземлен, его потенциал сбрасывается в землю. При отсутствии разницы в потенциалах движение электрического тока отсутствует. Таким образом, человек не получает удара. Опоры электропередач и подстанции конструируют таким образом, чтобы потенциал с ноля сбрасывался в землю.
Источник: avatars.mds.yandex.netФаза предназначена для движения электрического тока. Когда электроприбор подключается с помощью розетки, цепь замыкается. В случае, когда нулевой провод сбрасывает этот потенциал на ближайшей опоре, а человек касается оголенного ноля этой точки, потенциал будет сбрасываться через проводник по пути наименьшего сопротивления, то есть через тело.
По этой причине электрооборудование в обязательном порядке заземляется. В этом случае при повреждении проводки и протекания потенциала через корпус устройства, потенциал будет сбрасываться в землю, и не пройдет через человека при контакте. Фаза всегда обладает потенциалом, а нулевой провод только в том случае, когда есть соединение с фазовым кабелем через нагрузку, то есть подключенный потребитель, и до ближайшего места сброса этого потенциала в землю.
Варианты определения проводников «фаза»/«ноль»
Важно соблюдать технику безопасности для обозначения параметров электропроводки. Для этого необходимо использовать специальные приборы. Предварительно следует остановить движение тока, чтобы цепь не была замкнута нагрузкой. Ремонтируемый участок электропроводки отключается от общей цепи. Существует несколько простых способов отличить фазу и ноль в домашних условиях.
Ремонтируемый участок электропроводки отключается от общей цепи. Существует несколько простых способов отличить фазу и ноль в домашних условиях.
Как правило, провода обладают цветной маркировкой. Корректность выбора цвета определяется качеством работ и опытом специалиста. Поэтому доверять подобной индикации следует не всегда, лучше проверить самостоятельно фазу и ноль, либо поставить задачу опытному электрику.
Проверка с помощью электрической лампы
Способ достаточно прост для применения. Понадобиться стандартный патрон и лампочка. Два провода необходимо соединить со штатными местами подключения патрона. Один из проводников следует соединить с заземлением в розетке, а второй – подключить к любому силовому разъему. Если при подключении к разъему лампочка загорается, то найдена фаза.
Источник: rusenergetics.ruИндикаторная отвертка
С помощью бытового указателя напряжения можно быстро обнаружить фазный провод в электросети, напряжение в которой составляет 220-230 Вольт. Индикаторные отвертки представлены в богатом ассортименте и доступны в любом магазине с электротоварами.
Индикаторные отвертки представлены в богатом ассортименте и доступны в любом магазине с электротоварами.
При работе с любыми электроприборами необходимо соблюдать правила безопасности. Так как инструкция к индикаторной отвертке обычно отсутствует, следует руководствоваться полезными советами специалистов:
- Применять индикатор согласно его целевому назначению, то есть для электромонтажных работ.
- Перед тем как приступить к изысканиям, следует убедиться в целостности и надежности изоляционного материала, которым оснащены рукоять и жало инструмента.
- Убедиться в достоверности результатов измерений можно, если заранее испытать отвертку на электрических установках под напряжением.
Если пользователь сомневается в корректной работе индикаторной отвертки, не следует доверять показаниям прибора. В этом случае целесообразно использовать профессиональный инструмент.
Мультиметр
Бытовые мультиметры представляют собой простые в эксплуатации приборы. С их помощью можно определить, находится ли сеть под напряжением, и каково его значение. Это наиболее безопасный способ определить фазу и ноль. Щупы инструмента оснащены диэлектрической рукояткой. Принцип работы устройства заключается в подключении одного щупа к земле розетке, а второго – к одному из двух контактов розетки.
С их помощью можно определить, находится ли сеть под напряжением, и каково его значение. Это наиболее безопасный способ определить фазу и ноль. Щупы инструмента оснащены диэлектрической рукояткой. Принцип работы устройства заключается в подключении одного щупа к земле розетке, а второго – к одному из двух контактов розетки.
Фаза в электричестве, определение понятия, характеристика
Понятие фазного провода связано с определением напряжения. Данная величина обозначает, насколько напряжено электрическое поле в рамках данной точки или цепи. По-другому, это потенциал. Под действием такой силы электроны движутся по проводникам. Один из проводов, которые подключаются к потребителям, называется фазой. Именно этот проводник находится под напряжением. Фазу в понимании электротехники можно сравнить с плюсом в автотранспорте, то есть фазный провод представляет собой основное питание для электрической цепи.
Источник: rusenergetics. ru
ruЧто такое ноль в электричестве, определение
Нулевой провод отличается от фазы тем, что не находится под напряжением. Ноль не перегружается, когда происходит отбор мощности, но по проводнику также транспортируется электричество. Направление этого движения будет обратным фазному. Если в сети отсутствует напряжение, то ноль безопасен для человека и не способен поразить его электрическим током.
Зачем нужен ноль в электричестве
Нулевой провод необходим для замыкания электросети. С помощью ноля обеспечивается необходимая мощность для включения электрических приборов. При его отсутствии электричества будет отключено. По своей сути нулевой проводник представляет собой землю.
Основным назначением ноля является обеспечение электроснабжения объектов разного назначения. Нулевой провод замыкает электрическую цепь, таким образом, создается электрический ток, и работают электроприборы. Электричество появляется из-за разности потенциалов, которая возникает между двумя проводами.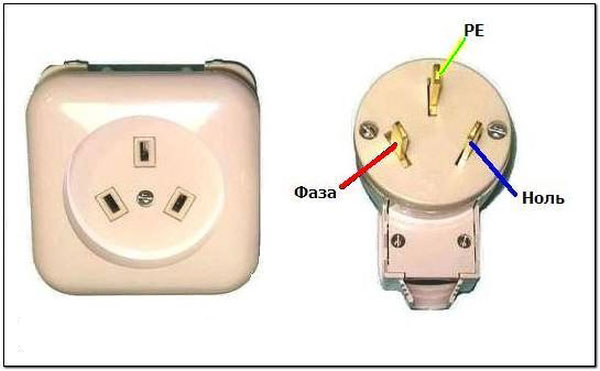 Ноль характеризуется нулевым потенциалом. Поэтому напряжение в цепи определяется, как 220 – 230 Вольт.
Ноль характеризуется нулевым потенциалом. Поэтому напряжение в цепи определяется, как 220 – 230 Вольт.
Что представляет собой петля «ноль/земля»
Нулевой провод выходит из трансформатора, который соединяется с помощью нулевой шины с заземлением, выполненным в виде контура. Вначале цепи именно земля представляет собой нулевой потенциал, что служит причиной путаницы при определении земли и ноля. Конструкция воздушной линии электропередачи, выходящей из комплектной трансформаторной подстанции, включает три фазных проводника и один ноль. Нулевой провод на выходе подсоединяется к нулевому контакту трансформатора. Повторное заземление выполняется на каждой второй опоре, по которым проложена воздушная линия электропередачи. С его помощью производится дополнительное соединение ноля с землей. Такое решение является гарантией полноценной связи цепи «фаза – ноль», что обеспечивает потребителя электричеством с напряжением не менее 220 Вольт.
Источник: rusenergetics.Элементарные знания электротехники необходимы не только для профессиональной деятельности, но и полезны для обывателя. Электричество питает разнообразные потребительские товары. Обеспечить бесперебойное электроснабжение можно, если правильно определять фазу и ноль при подключении инженерных коммуникаций. Подобная информация будет полезна также студентам политехнических вузов.
Если в процессе обучения возникают проблемы, всегда можно обратиться к специалистам сервиса Феникс.Хелп.
Вольтметр ВРТ-М03 с функцией мониторинга тока короткого замыкания и сопротивления цепи фаза-ноль сети и сравнения с током срабатывания вводного автомата
При включении прибор ВРТ-М03 показывает текущее напряжение сети. Через 1 минуту после включения производится автоматическое измерение тока КЗ и сравнение с запрограммированным значением автоматического выключателя. Если измеренное значение меньше допустимого (достаточного для мгновенного срабатывания) — включается звуковой сигнал и загорается светодиод «КЗ». Выключить звуковой сигнал можно нажатием кнопки, светодиод будет гореть до устранения неисправности. Автоматическое измерение тока КЗ производится каждые 24 часа. Запуск измерения тока КЗ вручную возможен не ранее 30 секунд после предыдущего измерения.
Выключить звуковой сигнал можно нажатием кнопки, светодиод будет гореть до устранения неисправности. Автоматическое измерение тока КЗ производится каждые 24 часа. Запуск измерения тока КЗ вручную возможен не ранее 30 секунд после предыдущего измерения.
Просмотр параметров:
1-е нажатие — индикация максимального напряжения с момента последнего сброса.
2-е нажатие — индикация минимального напряжения с момента последнего сброса.
3-е нажатие — индикация количества включений (пропаданий сетевого напряжения) с момента последнего сброса.
4-е нажатие — индикация усреднённого тока КЗ с момента последнего сброса (сопровождается миганием светодиода «КЗ»).
5-е нажатие — индикация запрограммированного значения тока и характеристики автомата защиты.
6-е нажатие — напряжение PE (сопровождается миганием светодиода «РЕ»). При напряжении PE более 100В — индикация Err. Если при работе выбран режим PE0, то будут прочерки.
7-е нажатие — возврат в начало (режим индикации напряжения)
Без нажатия кнопки через 10с выход в режим индикации напряжения.
Программирование прибора:
Длительное нажатие кнопки (5 секунд) — сброс всей накопленной информации.
Задание порога срабатывания защиты осуществляется кнопкой. Удерживать кнопку 10с. На 5-й секунде произойдёт сброс накопленной информации. На 10-й — появится установленное значение автомата (по умолчанию С16).
Последующими нажатиями (см таблицу ниже), установить и двойным кликом выбрать характеристику (B, C или D), затем одинарными кликами установить и двойным кликом выбрать ток автомата (через 10 секунд запоминание и выход в рабочий режим).
Чем отличается ноль от фазы? — Советы электрика!
Нередко при выполнении ремонта или монтажа электропроводки в доме жильцы, не имеющие опыта обращения с электричеством, путают нулевой и фазный провод. В результате при подаче напряжения происходит короткое замыкание в сети, способное вызвать серьёзные неисправности не только в квартире или доме, но и на трансформаторных подстанциях. Чтобы избежать таких последствий, нужно помнить, что ни в коем случае нельзя соединять между собой нулевой и фазный провод накоротко без нагрузки. Для этого надо уметь различать и разделять их друг от друга.
В результате при подаче напряжения происходит короткое замыкание в сети, способное вызвать серьёзные неисправности не только в квартире или доме, но и на трансформаторных подстанциях. Чтобы избежать таких последствий, нужно помнить, что ни в коем случае нельзя соединять между собой нулевой и фазный провод накоротко без нагрузки. Для этого надо уметь различать и разделять их друг от друга.
Как отличить ноль от фазы
Если строители при возведении дома строго следовали всем требованиям стандартов, то отличить нулевой провод от фазного можно по цвету изолятора. Согласно ГОСТ Р 50462-92 для цветовой маркировки нулевого провода применяется голубой цвет. Таким образом, для однофазной схемы электроснабжения здания, когда используются только два провода для питания электропотребителей, голубой провод будет нулевым, а провод другого цвета (чёрный, коричневый, жёлтый и т.д.) будет фазным.
В современных новостройках однофазная схема электропитания предусматривает использование трёх проводов, один из которых используется для передачи фазного напряжения, второй для нулевого напряжения, а третий в качестве заземляющего защитного провода. В этом случае голубой провод будет нулевым, заземляющий провод должен иметь жёлто-зелёную маркировку, фазный провод в большинстве случаев имеет чёрный цвет изоляции.
Однако не всегда используемая проводка может иметь разноцветную маркировку жил. Например, широко используемый плоский провод марки ППВ имеет однослойную общую изоляцию одного цвета. При этом в трёхжильном проводе средняя жила используется в качестве защитного заземляющего проводника, а две крайние жилы в качестве фазного и нулевого проводов. Нулевая жила в таком случае может маркироваться голубой или другой отличительной краской.
Доверяй, но проверяй
Даже при наличии цветовой маркировки проводов следует перед выполнением соединений проверять правильность их определения путём проверки с помощью индикатора напряжения или тестера. Ведь неизвестно, как строго монтажник следовал требованиям стандартов, не проводился ли ремонт или изменение схемы прокладки. Цвет изоляции вследствие большой нагрузки может со временем измениться и т. д.
д.
Проверку двужильной проводки можно выполнить с простым индикатором фазы в виде неоновой лампы, имеющейся в отвёртках-пробниках электрика. Для этого нужно, при включённых АЗС (автоматах защиты сети) в электрощите прикоснуться поочерёдно к оголённым концам проводников рабочим концом отвёртки-пробника. Загорание лампочки сигнализирует наличие фазного напряжения в проводнике. При прикосновении ко второму (нулевому) проводнику лампочка не должна загораться. Если она загорается, это говорит о неисправности в проводке или наличии включённого в сеть потребителя.
При проверке трёхжильного провода фазный провод можно найти указанным выше способом, но отличить нулевой провод от защитной жилы пробником невозможно. Для этого потребуется тестер (омметр) и дополнительный длинный провод, один конец которого нужно подключить к клемме заземления на электрощите, а второй конец к выходу тестера.
Помните, что «прозвонку» нужно выполнять только при отключенных АЗС на электрощите!
Затем вторым концом тестера следует «прозвонить» поочерёдно предполагаемые нулевой и защитный провода. При прикосновении к защитному проводу показания прибора должны быть близки к нулю.
При прикосновении к защитному проводу показания прибора должны быть близки к нулю.
Фаза 0 / подходы к микродозированию: время для массового применения при разработке лекарств?
FDA. Инновации или застой: вызовы и возможности на критическом пути к новым медицинским продуктам. http://www.fda.gov/oc/initiatives/criticalpath/whitepaper.html (2004 г.).
Paul, S. M. et al. Как повысить продуктивность НИОКР: грандиозная задача фармацевтической отрасли. Нац. Rev. Drug Discov. 9 , 203–214 (2010).
CAS PubMed Google ученый
Сканнелл, Дж. У., Бланкли, А., Болдон, Х. и Уоррингтон, Б. Диагностика снижения эффективности фармацевтических исследований и разработок. Нац. Rev. Drug Discov. 11 , 191–200 (2012).
CAS PubMed Google ученый
Morgan, P. et al. Влияние пятимерной структуры на производительность НИОКР в AstraZeneca. Нац. Rev. Drug Discov. 17 , 167–181 (2018).
Нац. Rev. Drug Discov. 17 , 167–181 (2018).
CAS PubMed Google ученый
ДиМази, Дж. А., Фельдман, Л., Секлер, А. и Уилсон, А. Тенденции рисков, связанных с разработкой новых лекарств: показатели успеха исследуемых лекарств. Clin. Pharmacol. Ther. 87 , 272–277 (2010).
CAS PubMed Google ученый
Суинни Д. К. и Энтони Дж. Как были открыты новые лекарства? Нац. Rev. Drug Discov. 10 , 507–519 (2011).
CAS PubMed PubMed Central Google ученый
Берт, Т., Баттон, К. С., Том, Х., Новек, Р. Дж. И Мунафо, М. Р. Бремя «ложноотрицательных результатов» в клинической разработке: анализ текущих и альтернативных сценариев и корректирующие меры. Clin. Пер. Sci. 10 , 470–479 (2017).
CAS PubMed PubMed Central Google ученый

Button, K. S. et al. Сбой питания: почему небольшой размер выборки подрывает надежность нейробиологии. Нац. Rev. Neurosci. 14 , 365–376 (2013).
CAS PubMed Google ученый
Bauer, M. et al. Исследование микродозирования с помощью позитронно-эмиссионной томографии потенциального антиамилоидного препарата у здоровых добровольцев и пациентов с болезнью Альцгеймера. Clin. Pharmacol. Ther. 80 , 216–227 (2006).
CAS PubMed Google ученый
Byun, B.H. et al. Прямое сравнение 11 C-PiB и 18 F-FC119S для визуализации Abeta у здоровых субъектов, пациентов с легкими когнитивными нарушениями и пациентов с болезнью Альцгеймера. Медицина 96 , e6441 (2017).
PubMed PubMed Central Google ученый
Kusuhara, H. et al. Сравнение фармакокинетики недавно открытых ингибиторов ароматазы методом кассетного микродозирования у здоровых японцев. Drug Metab. Фармакокинет. 32 , 293–300 (2017).
et al. Сравнение фармакокинетики недавно открытых ингибиторов ароматазы методом кассетного микродозирования у здоровых японцев. Drug Metab. Фармакокинет. 32 , 293–300 (2017).
CAS PubMed Google ученый
Xiao, H. et al. Разработка подхода к кассетному микродозированию для увеличения пропускной способности скрининга агентов ПЭТ-визуализации. J. Pharm. Биомед. Анальный. 154 , 48–56 (2018).
CAS PubMed Google ученый
Окур, М.и другие. Исследование микродоз на людях антималярийного препарата GSK31
на здоровых добровольцах. руб. J. Clin. Pharmacol. https://doi.org/10.1111/bcp.13476 (2017).
Артикул PubMed PubMed Central Google ученый
Cahn, A. et al. Безопасность, переносимость, фармакокинетика и фармакодинамика GSK2239633, антагониста CC-хемокинового рецептора 4, у здоровых мужчин: результаты открытого и рандомизированного исследования. BMC Pharmacol. Toxicol. 14 , 14 (2013).
CAS PubMed PubMed Central Google ученый
Эл Идрус, A. Presage подписывают свою 3-ю сделку по исследованиям фазы 0 — и еще больше впереди. FierceBiotech https://www.fiercebiotech.com/biotech/presage-inks-its-third-deal-around-phase-0-studies-more-to-come (2019).
Jonas, O. et al. Имплантируемое микроустройство для проведения высокопроизводительных тестов in vivo на лекарственную чувствительность опухолей. Sci. Пер. Med. 7 , 284ра257 (2015).
Google ученый
Sjogren, E., Halldin, M. M., Stalberg, O. & Sundgren-Andersson, A.K. Доклиническая характеристика трех временных антагонистов рецепторного потенциала ваниллоидного рецептора 1 для раннего использования в исследованиях внутрикожных микродоз анальгетиков на людях. евро. Дж. Пейн https://doi. org/10.1002/ejp.1175 (2018).
org/10.1002/ejp.1175 (2018).
Артикул PubMed Google ученый
Gundle, K. R. et al. Мультиплексная оценка микродозированных противоопухолевых агентов in situ в микроокружении опухоли пациентов с саркомой мягких тканей. Clin. Cancer Res. https://doi.org/10.1158/1078-0432.Ccr-20-0614 (2020).
Артикул PubMed Google ученый
Лаппин, Г. и Гарнер, Р. К. Большая физика, малые дозы: использование AMS и ПЭТ в микродозировании разрабатываемых лекарственных препаратов для человека. Нац.Rev. Drug Discov. 2 , 233–240 (2003).
CAS PubMed Google ученый
Combes, R.D. et al. Ранние исследования микродоз лекарств на людях-добровольцах могут свести к минимуму испытания на животных: материалы семинара, организованного волонтерами для исследования и тестирования. евро. J. Pharm. Sci. 19 , 1–11 (2003).
CAS PubMed Google ученый
Bergstrom, M., Grahnen, A. & Langstrom, B. Микродозирование с помощью позитронно-эмиссионной томографии: новая концепция, применяемая при разработке индикаторов и ранних клинических лекарств. евро. J. Clin. Pharmacol. 59 , 357–366 (2003).
PubMed Google ученый
MHLW. Руководство: Клинические исследования микродоз (изд. Министерства труда и социального обеспечения, Бюро фармацевтической и медицинской безопасности) (MHLW, 2008).
FDA. Руководство для промышленности, исследователей и рецензентов Исследовательских исследований IND. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM078933.pdf (2006 г.).
EMEA. Документ с изложением позиции CPMP / SWP / 2599 (2004).
ICH. Руководство по доклиническим исследованиям безопасности для проведения клинических испытаний на людях и разрешения на продажу фармацевтических препаратов M3 (R2) 8–16 (Секретариат ICH, 2009).
Бертино, Дж. С. Младший, Гринберг, Х. Э. и Рид, М. Д. Заявление позиции Американского колледжа клинической фармакологии по использованию микродозирования в процессе разработки лекарств. J. Clin. Pharmacol. 47 , 418–422 (2007).
CAS PubMed Google ученый
Роуленд М. Комментарий к изложению позиции ACCP по использованию микродозирования в процессе разработки лекарств. Дж.Clin. Pharmacol. 47 , 1595–1596 (2007). ответ автора 1597-1598.
PubMed Google ученый
Burt, T. et al. Внутрицелевое микродозирование (ITM): новый подход к разработке лекарств, направленный на обеспечение более безопасного и раннего перевода биологических идей в испытания на людях. Clin. Пер. Sci . 1–14, https://doi.org/10.1111/cts.12464 (2017).
Босгра, С., Вламинг, М.L. & Vaes, W.H. Применять микродозирование или нет? Рекомендации по выделению соединений с нелинейной фармакокинетикой. Clin. Фармакокинет. 55 , 1–15 (2016).
CAS PubMed Google ученый
Лаппин, Г., Новек, Р. и Берт, Т. Микродозирование и разработка лекарств: прошлое, настоящее и будущее. Мнение эксперта. Drug Metab. Toxicol. 9 , 817–834 (2013).
CAS PubMed PubMed Central Google ученый
Сугияма Ю. и Ямасита С. Влияние клинического исследования микродозирования — почему это необходимо и насколько полезно? Adv. Препарат Делив. Ред. 63 , 494–502 (2011).
CAS PubMed Google ученый
Роуленд, М. Микродозирование: критическая оценка человеческих данных. J. Pharm. Sci. 101 , 4067–4074 (2012).
CAS PubMed Google ученый
Burt, T. et al. Микродозирование и другие клинические испытания фазы 0: содействие развитию лекарств. Clin. Пер. Sci. 9 , 74–88 (2016).
CAS PubMed PubMed Central Google ученый
Хендерсон, П. Т. и Пан, С. X. Микродозирование человека для прогнозирования реакции пациента. Биоанализ 2 , 373–376 (2010).
CAS PubMed PubMed Central Google ученый
Vlaming, M. et al. Микродозирование меченного углеродом-14 белка у здоровых добровольцев точно предсказывает его фармакокинетику при терапевтических дозах. Clin. Pharmacol. Ther. 98 , 196–204 (2015).
CAS PubMed Google ученый
ван Нуланд, М., Розинг, Х., Хайтема, А. Д. Р. и Бейнен, Дж. Х. Прогностическое значение фармакокинетики микродоз. Clin. Фармакокинет. 58 , 1221–1236 (2019).
PubMed Google ученый
Malfatti, M. A., Lao, V., Ramos, C. L., Ong, V. S. и Turteltaub, K. W. Использование микродозирования и масс-спектрометрии ускорителя для оценки фармакокинетической линейности нового трициклического ингибитора GyrB / ParE у крыс. Антимикробный. Агенты Chemother. 58 , 6477–6483 (2014).
PubMed PubMed Central Google ученый
Sandhu, P. et al. Оценка стратегий микродозирования для исследований в доклинической разработке лекарств: демонстрация линейной фармакокинетики у собак аналога нуклеозида в 50-кратном диапазоне доз. Drug Metab. Dispos. 32 , 1254–1259 (2004).
CAS PubMed Google ученый
Snoeys, J., Beumont, M., Monshouwer, M. & Ouwerkerk-Mahadevan, S. Механистическое понимание нелинейной фармакокинетики и межпредметной изменчивости симепревира: подход к разработке лекарств на основе PBPK. Clin. Pharmacol. Ther. 99 , 224–234 (2016).
CAS PubMed Google ученый
Pierrillas, P. B. et al. Прогнозирование нелинейной фармакокинетики человека нового ингибитора Bcl-2 с использованием моделирования PBPK и стратегии межвидовой экстраполяции. Drug Metab. Dispos. 47 , 648–656 (2019).
CAS PubMed Google ученый
Lappin, G. et al. Использование микродозирования для прогнозирования фармакокинетики в терапевтической дозе: опыт применения 5 препаратов. Clin. Pharmacol. Ther. 80 , 203–215 (2006).
CAS PubMed Google ученый
Hah, S. S., Sumbad, R. A., de Vere White, R. W., Turteltaub, K. W. & Henderson, P. T. Характеристика образования аддукта оксалиплатин-ДНК в ДНК и дифференциация лекарственной чувствительности раковых клеток при микродозах. Chem. Res. Toxicol. 20 , 1745–1751 (2007).
CAS PubMed Google ученый
Yamane, N. et al. Клинические испытания микродоз: количественное определение никардипина и прогнозирование метаболитов в плазме крови человека. Drug Metab. Фармакокинет. 24 , 389–403 (2009).
CAS PubMed Google ученый
Lappin, G. et al. Фармакокинетика фексофенадина: оценка микродозы и оценка абсолютной биодоступности при приеме внутрь. евро. J. Pharm. Sci. 40 , 125–131 (2010).
CAS PubMed Google ученый
Ni, J. et al. Оценка чувствительности и пропорциональности метаболитов от микродозы до высокой дозы у крыс с использованием LC-MS / MS. Биоанализ 2 , 407–419 (2010).
CAS PubMed Google ученый
Prueksaritanont, T. et al. Валидация микродозового коктейля лекарств для клинической оценки лекарственного взаимодействия для переносчиков лекарств и CYP3A. Clin. Pharmacol. Ther. 101 , 519–530 (2017).
CAS PubMed Google ученый
Wagner, C.C. et al. Комбинированное исследование микродоз на человека с масс-спектрометрией и позитронно-эмиссионной томографией на ускорителе с использованием верапамила, меченного 14 C и 11 C. Clin. Фармакокинет. 50 , 111–120 (2010).
Google ученый
Yamazaki, A. et al. Исследование микродоз субстрата Р-гликопротеина, фексофенадина, с использованием препарата, не меченного радиоизотопами, и ЖХ / МС / МС. J. Clin. Pharm. Ther. 35 , 169–175 (2010).
CAS PubMed Google ученый
Хендерсон, П.T. et al. Подход микродозирования для характеристики образования и восстановления моноаддуктов карбоплатин-ДНК и химиорезистентности. Внутр. J. Cancer 129 , 1425–1434 (2011).
CAS PubMed PubMed Central Google ученый
Ieiri, I. et al. Клиническое исследование микродозирования: фармакокинетический, фармакогеномный (SLCO2B1) и взаимодействия (грейпфрутовый сок) профили целипролола после пероральной микродозы и терапевтической дозы. J. Clin. Pharmacol. 52 , 1078–1089 (2011).
PubMed Google ученый
Ieiri, I. et al. Фармакокинетические и фармакогеномные профили телмисартана после пероральной микродозы и терапевтической дозы. Pharmacogenet. Геномика 21 , 495–505 (2011).
CAS PubMed Google ученый
Кусухара, Х.и другие. Влияние ингибитора белка MATE, пириметамина, на выведение метформина почками при пероральных микродозах и терапевтических дозах у здоровых людей. Clin. Pharmacol. Ther. 89 , 837–844 (2011).
CAS PubMed Google ученый
Lappin, G. et al. Сравнительная фармакокинетика микродозы и терапевтической дозы кларитромицина, суматриптана, пропафенона, парацетамола (ацетаминофена) и фенобарбитала у людей-добровольцев. евро. J. Pharm. Sci. 43 , 141–150 (2011).
CAS PubMed Google ученый
Maeda, K. et al. Идентификация определяющего скорость процесса печеночного клиренса аторвастатина в клиническом исследовании микродозирования кассет. Clin. Pharmacol. Ther. 90 , 575–581 (2011).
CAS PubMed Google ученый
Маэда, К. и Сугияма, Ю. Новые стратегии для исследований микродоз с использованием соединений без радиоактивной метки. Adv. Препарат Делив. Ред. 63 , 532–538 (2011).
CAS PubMed Google ученый
Maeda, K. et al. Нелинейная фармакокинетика перорального хинидина и верапамила у здоровых субъектов: клиническое исследование микродозирования. Clin. Pharmacol. Ther. 90 , 263–270 (2011).
CAS PubMed Google ученый
Minamide, Y., Osawa, Y., Nishida, H., Igarashi, H. & Kudoh, S. Высокочувствительный метод ЖХ-МС / МС, позволяющий одновременно количественно определять целипролол и атенолол в плазме человека для кассетного холодного микродозирования. учиться. J. Separ. Sci. 34 , 1590–1598 (2011).
CAS Google ученый
Yamane, N. et al. Клиническая значимость тандемной масс-спектрометрии с жидкостной хроматографией как аналитического метода в клинических исследованиях микродоз. Pharm. Res. 28 , 1963–1972 (2011).
CAS PubMed Google ученый
Chen, J. et al. Двухфазное устранение дифосфата тенофовира и нелинейная фармакокинетика зидовудинтрифосфата в исследовании микродозирования. J. Acquir. Иммунодефицит. Syndr. 61 , 593–599 (2012).
CAS PubMed PubMed Central Google ученый
Крофт, М., Кили, Б., Моррис, И., Танн, Л. и Лаппин, Дж. Прогнозирование потенциальных жертв взаимодействия лекарств с лекарствами с помощью микродозирования. Clin. Фармакокинет. 51 , 237–246 (2012).
CAS PubMed Google ученый
Ieiri, I. et al. Фармакогеномная / фармакокинетическая оценка коктейля из четырех зондов для CYP и OATP после перорального микродозирования. Внутр. J. Clin. Pharmacol. Ther. 50 , 689–700 (2012).
CAS PubMed Google ученый
Cho, DY, Bae, SH, Shon, JH & Bae, SK Высокочувствительный метод ЖХ-МС / МС для одновременного определения мироденафила и его основного метаболита SK-3541 в плазме крови человека: применение к микродозам клинических испытаний мироденафила. J. Separ. Sci. 36 , 840–848 (2013).
CAS Google ученый
Ikeda, T. et al. Фармакогенетическое исследование микродоз 14 C-толбутамида на здоровых людях с помощью ускорительной масс-спектрометрии для изучения влияния CYP2C9 * 3 на его фармакокинетику и метаболизм. евро. J. Pharm. Sci. 49 , 642–648 (2013).
CAS PubMed Google ученый
Ламерс, Р. Дж., Де Йонг, А. Ф., Лопес-Гутьеррес, Дж. М. и Гомес-Гусман, Дж. Микродозирование йода-129 для разработки белковых и пептидных лекарств: эритропоэтин в качестве примера. Биоанализ 5 , 53–63 (2013).
CAS PubMed Google ученый
Schou, M. et al. Радиоактивное мечение агониста каннабиноидных рецепторов AZD1940 с использованием микродозирования углеродом-11 и ПЭТ у нечеловеческих приматов. Nucl. Med. Биол. 40 , 410–414 (2013).
CAS PubMed Google ученый
Burt, T. et al.Внутриартериальное микродозирование: новый подход к разработке лекарств, испытание концепции ПЭТ на крысах. J. Nucl. Med. 56 , 1793–1799 (2015).
CAS PubMed PubMed Central Google ученый
Fujita, K. et al. Клиническое фармакокинетическое исследование микродозирования доцетаксела у японских больных раком. Рак химиотерапия. Pharmacol. 76 , 793–801 (2015).
CAS PubMed Google ученый
Yamashita, S. et al. Оценка пероральной биодоступности трех блокаторов Са-каналов с использованием кассетно-микродозового исследования: новая стратегия оптимизации разработки пероральных лекарств. J. Pharm. Sci. 104 , 3154–3161 (2015).
CAS PubMed Google ученый
Madeen, E. P. et al. Микродозирование человека канцерогенными полициклическими ароматическими углеводородами: фармакокинетика дибензо [def, p] хризена и метаболитов in vivo с помощью масс-спектрометрии с ускорителем UPLC. Chem. Res. Toxicol. 29 , 1641–1650 (2016).
CAS PubMed PubMed Central Google ученый
Burt, T. et al. Внутрицелевое микродозирование — новый подход к разработке лекарств: доказательство концепции, безопасность и технико-экономическое обоснование на людях. Clin. Пер. Sci. https://doi.org/10.1111/cts.12477 (2017).
Артикул PubMed PubMed Central Google ученый
Park, G.J. et al. Лекарственное взаимодействие микродоз и обычных доз омепразола с ингибитором и индуктором CYP2C19. Drug Des. Devel. Ther. 11 , 1043–1053 (2017).
CAS PubMed PubMed Central Google ученый
van Nuland, M. et al. Сверхчувствительный метод LC-MS / MS для количественного определения гемцитабина и его метаболита 2 ’, 2’-дифтордезоксиуридина в плазме крови человека для клинического испытания микродоз. J. Pharm. Биомед. Анальный. 151 , 25–31 (2017).
PubMed Google ученый
Wang, S. S. et al. Подход к диагностическому микродозированию для исследования чувствительности к платине при немелкоклеточном раке легкого. Внутр. J. Cancer 141 , 604–613 (2017).
CAS PubMed PubMed Central Google ученый
Циммерманн, М.и другие. Индуцированные микродозами аддукты лекарственного средства и ДНК как биомаркеры устойчивости к химиотерапии у людей и мышей. Мол. Рак Тер. 16 , 376–387 (2017).
CAS PubMed Google ученый
Hohmann, N. et al. Одновременное фенотипирование CYP2E1 и CYP3A с помощью пероральных микродоз хлорзоксазона и мидазолама. руб. J. Clin. Pharmacol. https://doi.org/10.1111/bcp.14040 (2019).
Артикул PubMed PubMed Central Google ученый
van Groen, B.D. et al. Дозозависимость фармакокинетики внутривенной микродозы [ 14 C] мидазолама у детей. руб. J. Clin. Pharmacol. https://doi.org/10.1111/bcp.14047 (2019).
Артикул PubMed PubMed Central Google ученый
Takashima, T. et al. Оценка гепатобилиарного транспорта у людей с (15R) -11C-TIC-Me на основе ПЭТ. J. Nucl. Med. 53 , 741–748 (2012).
PubMed Google ученый
Hohmann, N., Halama, B., Siller, N., Mikus, G. & Haefeli, WE Ответ на вопрос «Можно ли оценить активность CYP3A для взаимодействия с лекарствами с использованием нанограммовой дозы исследуемого лекарственного средства?»: оценка активности CYP3A с помощью микродоз мидазолама. Clin. Pharmacol. Ther. 95 , 490–491 (2014).
CAS PubMed Google ученый
Halama, B. et al. Нанограммовая доза мидазолама, субстрата зонда CYP3A, для оценки лекарственного взаимодействия. Clin. Pharmacol. Ther. 93 , 564–571 (2013).
CAS PubMed Google ученый
Burhenne, J. et al. Количественная оценка фемтомолярных концентраций мидазолама, субстрата CYP3A и его основного метаболита, 1’-гидроксимидазолама, в плазме крови человека с использованием сверхэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. Анал. Биоанал. Chem. 402 , 2439–2450 (2012).
CAS PubMed Google ученый
Hohmann, N. et al. Микродозы мидазолама для определения системной и пресистемной метаболической активности CYP3A у людей. руб. J. Clin. Pharmacol. 79 , 278–285 (2015).
CAS PubMed PubMed Central Google ученый
Schou, M. et al. Значительные различия в воздействии на мозг эталонных препаратов для ЦНС: исследование ПЭТ на нечеловеческих приматах. Внутр. J. Neuropsychopharmacol . 18 , https://doi.org/10.1093/ijnp/pyv036 (2015).
Madeen, E. et al. Фармакокинетика человеческого in vivo [ 14 C] дибензо [def, p] хризена с помощью ускорительной масс-спектрометрии после перорального микродозирования. Chem. Res. Toxicol. https://doi.org/10.1021/tx5003996 (2014).
Артикул PubMed PubMed Central Google ученый
Saleem, A. et al. Доступ лапатиниба к нормальному мозгу и метастазам в головном мозге у пациентов со сверхэкспрессией рака молочной железы Her-2. EJNMMI Res. 5 , 30 (2015).
PubMed PubMed Central Google ученый
Saleem, A., Aboagye, E.O., Matthews, J. C. & Price, P.M. Фармакокинетическая оценка плазмы цитотоксических агентов, меченных радиоизотопами, испускающими позитроны. Рак химиотерапия.Pharmacol. 61 , 865–873 (2008).
CAS PubMed Google ученый
Saleem, A. et al. Фармакокинетическая оценка N- [2- (диметиламино) этил] акридин-4-карбоксамида у пациентов с помощью позитронно-эмиссионной томографии. J. Clin. Онкол. 19 , 1421–1429 (2001).
CAS PubMed Google ученый
Иейри, И.и другие. Механизмы фармакокинетического усиления ритонавира и саквинавира; тесты на микро / малую дозировку с использованием мидазолама (CYP3A4), фексофенадина (p-гликопротеин) и правастатина (OATP1B1) в качестве зондирующих препаратов. J. Clin. Pharmacol. 53 , 654–661 (2013).
CAS PubMed Google ученый
van der Veldt, A. A., Smit, E. F. & Lammertsma, A. A. Позитронно-эмиссионная томография как метод измерения доставки лекарств в опухоли in vivo: пример [ 11 C] доцетаксела. Фронт. Онкол. 3 , 208 (2013).
PubMed PubMed Central Google ученый
Shin, K. H. et al. Исследование микродозирования сертралина с помощью позитронно-эмиссионной томографии у здоровых добровольцев. Внутр. J. Clin. Pharmacol. Ther. 50 , 224–232 (2012).
CAS PubMed Google ученый
Вуонг, Л. Т.и другие. Использование ускорительной масс-спектрометрии для измерения фармакокинетики и концентрации зидовудина в мононуклеарных клетках периферической крови. J. Pharm. Sci. 97 , 2833–2843 (2008).
CAS Google ученый
Cunningham, V.J. et al. Метод изучения фармакокинетики у человека при пикомолярных концентрациях препарата. руб. J. Clin. Pharmacol. 32 , 167–172 (1991).
CAS PubMed PubMed Central Google ученый
Liu, L. et al. Модуляция Р-гликопротеина на гематоэнцефалическом барьере человека с помощью лечения хинидином или рифампицином: исследование с помощью позитронно-эмиссионной томографии. Drug Metab. Dispos. 43 , 1795–1804 (2015).
CAS PubMed PubMed Central Google ученый
Van Nuland, M. et al. Пилотное исследование для прогнозирования фармакокинетики терапевтической дозы гемцитабина на основе микродозы. Clin. Pharmacol.Drug Dev. https://doi.org/10.1002/cpdd.774 (2020).
Артикул PubMed Google ученый
Ordonez, A. A. et al. Динамическая визуализация у больных туберкулезом выявляет неоднородное воздействие лекарств в легочные поражения. Нац. Med. 26 , 529–534 (2020).
CAS PubMed Google ученый
Zimmermann, M. et al.Аддукты оксалиплатин-ДНК как прогностические биомаркеры FOLFOX-ответа при колоректальном раке: потенциальная стратегия оптимизации лечения. Мол. Рак Тер. 19 , 1070–1079 (2020).
CAS PubMed PubMed Central Google ученый
Mikus, G. et al. Применение микродозового коктейля из 3 пероральных ингибиторов фактора Ха для изучения лекарственного взаимодействия с различными лекарственными средствами-преступниками. руб.J. Clin. Pharmacol. https://doi.org/10.1111/bcp.14277 (2020).
Артикул PubMed PubMed Central Google ученый
Madan, A. et al. Фармакокинетическая оценка пяти антагонистов H2 после перорального и внутривенного введения микродозам людям. руб. J. Clin. Pharmacol. 67 , 288–298 (2008).
Google ученый
Heuveling, D. A. et al. Исследование ПЭТ с микродозированием фазы 0 с использованием человеческого мини-антитела F16SIP у пациентов с раком головы и шеи. J. Nucl. Med. 54 , 397–401 (2013).
CAS PubMed Google ученый
Kummar, S. et al. Первое испытание фазы 0 на людях перорального применения 5-йод-2-пиримидинон-2’-дезоксирибозы у пациентов с запущенными злокачественными новообразованиями. Clin. Cancer Res. 19 , 1852–1857 (2013).
CAS PubMed PubMed Central Google ученый
Карпентер, А.П. мл., Понтекорво, М.Дж., Хефти, Ф.Ф. и Сковронски, Д.М. Использование исследовательского IND в оценке и разработке радиофармпрепаратов 18F-ПЭТ для визуализации амилоида в головном мозге: обзор одного опыт компании. Q. J. Nucl. Med. Мол. Imaging 53 , 387–393 (2009).
PubMed Google ученый
Zhou, X. J., Garner, R.C, Nicholson, S., Kissling, C.J. & Mayers, D. Фармакокинетика микродоз IDX899 и IDX989, ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1, после перорального и внутривенного введения здоровым субъектам мужского пола. J. Clin. Pharmacol. 49 , 1408–1416 (2009).
CAS PubMed Google ученый
Wang, J. L. et al. Новый класс селективных ингибиторов циклооксигеназы-2 бензопиранов.Часть III: три кандидата на микродозы. Bioorg Med. Chem. Lett. 20 , 7164–7168 (2010).
CAS PubMed Google ученый
Sun, L. et al. Методики сверхчувствительной жидкостной хроматографии и тандемной масс-спектрометрии для количественного определения пяти ингибиторов интегразы ВИЧ-1 в плазме для клинических испытаний микродоз. Анал. Chem. 84 , 8614–8621 (2012).
CAS PubMed Google ученый
Джонс, Х. М. и др. Клинические исследования микродоз для изучения фармакокинетики человека четырех селективных ингибиторов потенциал-зависимых натриевых каналов Nav1.7 человека. Clin. Фармакокинет. 55 , 875–887 (2016).
CAS PubMed Google ученый
Ostenfeld, T., Beaumont, C., Bullman, J., Beaumont, M. & Jeffrey, P. Оценка микродоз у человека нового антагониста рецептора EP1 GSK269984A. руб. J. Clin. Pharmacol. 74 , 1033–1044 (2012).
CAS PubMed PubMed Central Google ученый
Harrison, A. et al. Тематические исследования, посвященные фармакокинетической неопределенности человека, с использованием комбинации фармакокинетического моделирования и альтернативы в первую очередь в человеческих парадигмах. Xenobiotica 42 , 57–74 (2012).
CAS PubMed Google ученый
Парк, W.-S. и другие. Данные микродозирования человека и ксенотрансплантата мышей AGM-130 применялись для оценки эффективных доз у пациентов. Рак химиотерапия. Pharmacol. 80 , 363–369 (2017).
CAS PubMed Google ученый
Rajagopalan, R. et al. Доклиническая характеристика и фармакокинетика микродоз для человека ITMN-8187, немакроциклического ингибитора протеазы NS3 вируса гепатита С. Антимикробный.Агенты Chemother . 61 , https://doi.org/10.1128/aac.01569-16 (2017).
Sanai, N. et al. Фаза 0 исследования AZD1775 у пациентов с первым рецидивом глиобластомы. Clin. Cancer Res. https://doi.org/10.1158/1078-0432.ccr-17-3348 (2018).
Артикул PubMed PubMed Central Google ученый
Lappin, G. et al. Исследование микродоз 14 C-AR-709 у здоровых мужчин: фармакокинетика, абсолютная биодоступность и концентрации в ключевых отделах легких. евро. J. Clin. Pharmacol. 69 , 1673–1682, https://doi.org/10.1007/s00228-013-1528-2 (2013).
CAS Статья PubMed Google ученый
Bal, C. et al. Фармакокинетическое, дозиметрическое и токсическое исследование 177 Lu-EDTMP у пациентов: исследование фазы 0 / I. Curr. Радиофарм. 9 , 71–84 (2016).
CAS PubMed Google ученый
Reid, J. M. et al. Фаза 0 клинических испытаний химиопрофилактики ингибитора Akt SR13668. Рак Пред. Res. 4 , 347–353 (2011).
CAS Google ученый
Kummar, S. et al. Фаза 0 клинических испытаний ингибитора поли (АДФ-рибозы) полимеразы ABT-888 у пациентов с запущенными злокачественными новообразованиями. J. Clin. Онкол. 27 , 2705–2711 (2009).
CAS PubMed PubMed Central Google ученый
Каплан Н., Гарнер С. и Хафкин Б. Исследования абсорбции и фармакокинетики AFN-1252 in vitro после микродозирования у здоровых субъектов. евро. J. Pharm. Sci. 50 , 440–446 (2013).
CAS PubMed Google ученый
Johnstrom, P. et al. Разработка быстрого многоступенчатого радиосинтеза углерода-11 ингибитора миелопероксидазы AZD3241 для оценки воздействия на мозг микродозированием ПЭТ. Nucl.Med. Биол. 42 , 555–560 (2015).
PubMed Google ученый
Mooij, M. G. et al. Детское исследование микродоз [ 14 C] парацетамола для изучения метаболизма лекарств с использованием ускоренной масс-спектрометрии: подтверждение концепции. Clin. Фармакокинет. 53 , 1045–1051 (2014).
CAS PubMed PubMed Central Google ученый
Barthel, H. et al. Индивидуальная количественная оценка бета-амилоидной нагрузки в головном мозге: результаты исследования ПЭТ флорбетабена фазы 0 доказательства механизма у пациентов с болезнью Альцгеймера и здоровых людей из контрольной группы. евро. J. Nucl. Med. Мол. Imaging 38 , 1702–1714 (2011).
CAS PubMed Google ученый
Moschos, S.J. et al. Фармакодинамическое (фаза 0) исследование с использованием этарацизумаба при запущенной меланоме. J. Immunother. 33 , 316–325 (2010).
CAS PubMed Google ученый
Park, M. H. et al. Валидация метода жидкостной хроматографии-тройной квадрупольной масс-спектрометрии для определения 5-нитро-5’-гидроксииндирубин-3’-оксима (AGM-130) в плазме крови человека и его применение в клинических испытаниях микродоз. Биомед. Chromatogr. https://doi.org/10.1002/bmc.3551 (2015).
Артикул PubMed Google ученый
Elliott, J. T. et al. Микродозовая флуоресцентная визуализация ABY-029 на операционном микроскопе, адаптированном под специальные модули освещения и визуализации. Биомед. Опт. Экспресс 7 , 3280–3288 (2016).
PubMed PubMed Central Google ученый
Lamberts, L.E. et al. Опухоль-специфическое поглощение флуоресцентного микродозирования бевацизумаба-IRDye800CW у пациентов с первичным раком молочной железы: исследование осуществимости фазы I. Clin. Cancer Res. 23 , 2730–2741 (2017).
CAS PubMed Google ученый
de Souza, A. L. et al. Флуоресцентная молекула аффибоди, вводимая in vivo на уровне микродоз, маркирует EGFR, экспрессирующие области опухоли глиомы. Мол. Imaging Biol. 19 , 41–48 (2017).
PubMed Google ученый
Йонас, О.и другие. Параллельная оценка фенотипов лекарств in vivo в различные моменты времени во время системного ингибирования BRAF выявляет адаптацию опухоли и измененную уязвимость к лечению. Clin. Cancer Res. 22 , 6031–6038 (2016).
CAS PubMed PubMed Central Google ученый
Garner, C. R. et al. Наблюдательное исследование фармакокинетических микродоз / терапевтических доз [ 14 C] -парацетамола младенцев с использованием ускорительного масс-спектрометрического биоанализа. руб. J. Clin. Pharmacol. 80 , 157–167 (2015).
CAS PubMed PubMed Central Google ученый
Mooij, M. G. et al. Успешное использование микродозирования [ 14 C] парацетамола для выяснения изменений метаболизма лекарств в процессе развития. Clin. Фармакокинет. https://doi.org/10.1007/s40262-017-0508-6 (2017).
Артикул PubMed PubMed Central Google ученый
Бьюн, Б. Х., К., Б. и Лим, И. Х. Количественная оценка отложения амилоида-b с использованием ПЭТ 18 F-FC119S в мозге человека: исследование фазы 0-1. евро. J. Nucl. Med. Мол. Imaging https://doi.org/10.1007/s00259-015-3198-z (2015).
Артикул Google ученый
Keat, N. et al. Исследование безопасности, иммуногенности, биораспределения и дозиметрии излучения с помощью ПЭТ с микродозами 18 F-FB-A20FMDV2 для визуализации интегрина alphavbeta6. J. Nucl. Med. Technol. 46 , 136–143 (2018).
PubMed Google ученый
Gordi, T. et al. Фармакокинетический анализ 14 C-урсодиола у новорожденных с использованием ускорительной масс-спектрометрии. J. Clin. Pharmacol. 54 , 1031–1037 (2014).
CAS PubMed Google ученый
Леше Р.и другие. Доклиническая оценка BAY 1075553, нового F-меченного ингибитора простатоспецифического мембранного антигена для ПЭТ-визуализации рака простаты. евро. J. Nucl. Med. Мол. Imaging https://doi.org/10.1007/s00259-013-2527-3 (2013).
Артикул PubMed Google ученый
Bauer, M. et al. Pgp-опосредованное взаимодействие между (R) — [ 11 C] верапамилом и таривикаром на гематоэнцефалическом барьере человека: сравнение с данными на крысах. Clin. Pharmacol. Ther. 91 , 227–233 (2012).
CAS PubMed Google ученый
Вэй, X., Чжан, З., Се, Y. и Ван, Y. [Фаза 0 клинических испытаний и постмаркетинговая переоценка клинической безопасности инъекций традиционной китайской медицины]. Чжунго Чжун Яо За Чжи 36 , 2874–2876 (2011).
PubMed Google ученый
Kuwano, K. et al. 2- [4 — [(5,6-дифенилпиразин-2-ил) (изопропил) амино] бутокси] -N- (метилсульфонил) ацетамид (NS-304), перорально доступное пролекарство-агонист простациклиновых рецепторов длительного действия. J. Pharmacol. Exp. Ther. 322 , 1181–1188 (2007).
CAS PubMed Google ученый
Jacobs, B.A. et al. Фаза 0 клинических испытаний новых кандидатных форм капецитабина с пролонгированным высвобождением. Рак химиотерапия. Pharmacol. 77 , 1201–1207 (2016).
CAS PubMed Google ученый
Kurdziel, K. A. et al. Первое исследование фазы 0 на людях 111 трастузумаба In-CHX-A ”-DTPA для визуализации опухоли HER2. J. Transl. Sci . 5 , https://doi.org/10.15761/jts.1000269 (2019).
Wang, S. J. et al. Исследование фазы 0 фармакокинетики, биораспределения и дозиметрии 188 Re-липосом у пациентов с метастатическими опухолями. EJNMMI Res. 9 , 46 (2019).
PubMed PubMed Central Google ученый
Kaneko, K. et al. Клиническая количественная оценка гепатобилиарного транспорта [ 11 C] дегидроправастатина у людей с использованием позитронно-эмиссионной томографии. Drug Metab. Dispos. 46 , 719–728 (2018).
CAS PubMed Google ученый
Tien, A.C. et al. Фаза 0 испытания рибоциклиба у пациентов с рецидивирующей глиобластомой, включающая когорту распространения опухоли, управляемую фармакодинамикой и фармакокинетикой. Clin. Cancer Res. 25 , 5777–5786 (2019).
CAS PubMed PubMed Central Google ученый
Burt, T. et al. Фаза 0, включая подходы к микродозированию: применение трех принципов и повышение эффективности разработки лекарственных препаратов для человека. Альтерн. Лаборатория. Anim. 46 , 335–346 (2018).
PubMed Google ученый
Берт, Т., Джон, С.С., Ракл, Дж. Л. и Вуонг, Л. Т. Исследования фазы 0 / микродозирования с использованием ПЭТ, АМС и ЖХ-МС / МС: ряд методологий исследования и рекомендации по проведению. Ускорение разработки новых фармацевтических препаратов посредством безопасных испытаний на людях — практическое руководство. Мнение эксперта. Препарат Делив . 1–16, https: // doi.org / 10.1080 / 17425247.2016.1227786 (2016).
Рот-Клайн М. и Нельсон Р. М. Исследования микродозирования у детей: перспективы регулирования в США. Clin. Pharmacol. Ther. 98 , 232–233 (2015).
CAS PubMed Google ученый
Burt, T., Combes, RD в The History of Alternative Test Methods in Toxicology (eds Combes, RD, Balls, M. & Worth, A.) 229–240 (Elsevier / Academic Press, 2018).
Курихара, К. Этические, правовые и социальные последствия (ELSI) клинических испытаний микродоз. Adv. Препарат Делив. Ред. 63 , 503–510 (2011).
CAS PubMed Google ученый
Киммельман Дж. Этика на этапе 0: прояснение проблем. J. Law Med. Этика 35 , 514 (2007).
Google ученый
Маккарт, А. Д., Огнибене, Т. Дж., Бенч, Г. и Туртелтауб, К. В. Количественное определение углерода-14 для биологии с помощью спектроскопии типа «кольцо вниз». Анал. Chem. 88 , 8714–8719 (2016).
CAS PubMed PubMed Central Google ученый
Чжан Ю. и Фокс Г. Б. ПЭТ-визуализация для определения занятости рецепторов: размышления о расчетах и упрощении. J. Biomed. Res. 26 , 69–76 (2012).
PubMed PubMed Central Google ученый
Вагнер К. и Лангер О. Подходы с использованием технологии молекулярной визуализации — использование ПЭТ в клинических исследованиях микродоз. Adv. Препарат Делив. Ред. 63 , 539–546 (2011).
CAS PubMed Google ученый
Сугияма, Ю. Эффективное использование исследований микродозирования и позитронно-эмиссионной томографии (ПЭТ) при открытии и разработке новых лекарств. Drug Metab. Фармакокинет. 24 , 127–129 (2009).
CAS PubMed Google ученый
Pogue, B. W. et al. Видение 20/20: хирургическая онкология под молекулярным контролем, основанная на метаболизме опухоли или иммунологическом фенотипе: технологические пути для визуализации и вмешательства в местах оказания медицинской помощи. Med. Phys. 43 , 3143–3156 (2016).
PubMed PubMed Central Google ученый
Dueker, S. R., Vuong le, T., Lohstroh, P. N., Giacomo, J. A. & Vogel, J. S. Количественная оценка исследуемых соединений с низкой дозой у людей с AMS. Adv. Препарат Делив. Ред. 63 , 518–531 (2011).
CAS PubMed Google ученый
Dueker, S. R. et al. Ранний человеческий ADME с использованием микродоз и микротрейсеров: биоаналитические соображения. Биоанализ 2 , 441–454 (2010).
CAS PubMed Google ученый
Роуленд, М., Бенет, Л. З. и Лид, П. К. Комментарий: прогнозирование фармакокинетики человека. J. Pharm. Sci. 100 , 4047–4049 (2011).
CAS PubMed Google ученый
Takano, J., Maeda, K., Bolger, MB & Sugiyama, Y. Прогнозирование относительной важности CYP3A / P-гликопротеина для нелинейной кишечной абсорбции лекарств с помощью расширенной модели компартментальной абсорбции и транзита. . Drug Metab. Dispos. 44 , 1808–1818 (2016).
CAS PubMed Google ученый
Ито, К., Ивацубо, Т., Канамицу, С., Накадзима, Ю. и Сугияма, Ю. Количественное прогнозирование клиренса лекарств in vivo и взаимодействия лекарств на основе данных о метаболизме in vitro вместе со связыванием и транспорт. Annu. Rev. Pharmacol. Toxicol. 38 , 461–499 (1998).
CAS PubMed Google ученый
Чиба М., Исии Ю. и Сугияма Ю. Прогнозирование печеночного клиренса у человека на основе данных in vitro для успешной разработки лекарств. AAPS J. 11 , 262–276 (2009).
CAS PubMed PubMed Central Google ученый
van Waterschoot, R. A. B. et al. Влияние целевых взаимодействий на распределение низкомолекулярных лекарств: упущенная область. Нац. Rev. Drug Discov. 17 , 299 (2018).
PubMed Google ученый
Smith, D. A. et al. Важность опосредованного мишенью распределения лекарств для малых молекул. Drug Discov. Сегодня 23 , 2023–2030 (2018).
CAS PubMed Google ученый
An, G. Низкомолекулярные соединения, демонстрирующие опосредованное мишенью распределение лекарств (TMDD): мини-обзор. J. Clin. Pharmacol. 57 , 137–150 (2017).
CAS PubMed Google ученый
Леви Г. Фармакологическая утилизация лекарств, опосредованная мишенью. Clin. Pharmacol. Ther. 56 , 248–252 (1994).
CAS PubMed Google ученый
Магер, Д. Э. и Юско, У. Дж. Общая фармакокинетическая модель для лекарств, демонстрирующих опосредованное мишенью расположение лекарств. J. Pharmacokinet. Pharmacodyn. 28 , 507–532 (2001).
CAS PubMed Google ученый
Yamane, N. et al. Анализ экономической эффективности клинических испытаний микродоз при разработке лекарств. Drug Metab. Фармакокинет. 28 , 187–195 (2013).
CAS PubMed Google ученый
Sugiyama, Y.& Kurihara, C. Клинические испытания микродозирования (Jiho, 2007).
Rowland, M. в Microdosing and the 3Rs (Национальный центр по замене, уточнению и сокращению количества животных в исследованиях (NC3Rs), 2006).
Owens, P. K. et al. Десятилетие инноваций в фармацевтических исследованиях и разработках: модель Chorus. Нац. Rev. Drug Discov. 14 , 17–28 (2015).
CAS PubMed Google ученый
Lendrem, D. W. et al. Предвзятое отношение к прогрессу и рациональный оптимизм в исследованиях и разработках. Нац. Rev. Drug Discov. 14 , 219–221 (2015).
CAS PubMed Google ученый
Пек, Р. У., Лендрем, Д. У., Грант, И., Лендрем, Б. К. и Айзекс, Дж. Д. Почему трудно прекратить неудачные проекты в области фармацевтических исследований и разработок? Нац. Rev. Drug Discov. 14 , 663–664 (2015).
CAS PubMed Google ученый
Вонг, К. Х., Сиа, К. В. и Ло, А. В. Оценка показателей успешности клинических испытаний и связанных параметров. Биостатистика 20 , 273–286 (2019).
PubMed Google ученый
Паммолли Ф., Магаццини Л. и Риккабони М. Кризис производительности в фармацевтических исследованиях и разработках. Нац.Rev. Drug Discov. 10 , 428–438 (2011).
CAS PubMed Google ученый
Pammolli, F. et al. Бесконечная граница? Недавнее увеличение производительности НИОКР в фармацевтике. J. Transl. Med. 18 , 162 (2020).
PubMed PubMed Central Google ученый
Морган, С., Гроотендорст, П., Lexchin, J., Cunningham, C. & Greyson, D. Стоимость разработки лекарств: систематический обзор. Политика здравоохранения 100 , 4–17 (2011).
PubMed Google ученый
Чжоу, Х., Тонг, З. и МакЛеод, Дж. Ф. «Коктейльные» подходы и стратегии в разработке лекарств: ценный инструмент или ошибочная наука? J. Clin. Pharmacol. 44 , 120–134 (2004).
CAS PubMed Google ученый
Манитписиткул, П. и Уайт, Р. Э. Что случилось с фармакокинетикой кассетного дозирования? Drug Discov. Сегодня 9 , 652–658 (2004).
CAS PubMed Google ученый
Микус, Г. Зонды и коктейли для оценки лекарственного взаимодействия: будущее за микродозированием? Clin. Pharmacol. Ther . (2019).
Чавес-Энг, К. М., Лутц, Р. В., Гойхман, Д. и Бейтман, К.P. Разработка микродозирующего коктейля для исследований лекарственного взаимодействия. J. Pharm. Sci. 107 , 1973–1986 (2018).
CAS PubMed Google ученый
Zhang, L. & Sparreboom, A. Прогнозирование лекарственных взаимодействий, опосредованных переносчиками: Комментарий к: «Фармакокинетическая оценка коктейля переносчиков лекарственных средств, состоящего из дигоксина, фуросемида, метформина и розувастатина» и «Валидация микродозового зонда. лекарственный коктейль для клинической оценки лекарственного взаимодействия для переносчиков наркотиков и CYP3A ». Clin. Pharmacol. Ther. 101 , 447–449 (2017).
CAS PubMed Google ученый
Роуленд, М., Бенет, Л. З. и Грэм, Г. Г. Концепции разрешения в фармакокинетике. J. Pharmacokinet. Биофарм. 1 , 123–136 (1973).
CAS PubMed Google ученый
Вальдман, С. А., Терзич, А.Улучшение процесса для достижения максимального терапевтического результата инноваций. Clin. Pharmacol. Ther. 103 , 8–12 (2018).
CAS PubMed PubMed Central Google ученый
Gunn, R. N. et al. Сочетание анализов биораспределения ПЭТ и равновесного диализа для оценки свободной концентрации в головном мозге и транспорта ГЭБ препаратов для ЦНС. J. Cereb. Кровоток. Метаб. 32 , 874–883 (2012).
CAS PubMed PubMed Central Google ученый
Рот-Клайн М. и Нельсон Р. М. Этические соображения при проведении педиатрических и неонатальных исследований в клинической фармакологии. Curr. Pharm. Des. 21 , 5619–5635 (2015).
CAS PubMed Google ученый
Turner, M. A. et al. Педиатрические исследования микродоз и микротрейсеров с использованием 14 C в Европе. Clin. Pharmacol. Ther. 98 , 234–237 (2015).
CAS PubMed Google ученый
Bellis, J. R. et al. Побочные реакции на лекарственные препараты, а также лекарственные средства, не указанные по назначению, и нелицензированные лекарства у детей: вложенное исследование «случай – контроль» у стационарных пациентов в педиатрической больнице. BMC Med. 11 , 238 (2013).
PubMed PubMed Central Google ученый
Dunne, J. et al. Экстраполяция данных о взрослых и других данных в программах разработки лекарственных препаратов для детей. Педиатрия 128 , e1242 – e1249 (2011).
PubMed Google ученый
Yackey, K. & Stanley, R. Количество выписываемых детям лекарств не по назначению остается высоким: необходимость в приоритетных исследованиях. Педиатрия https://doi.org/10.1542/peds.2019-1571 (2019).
Артикул PubMed Google ученый
ЕС. Исследование использования лекарственных средств не по назначению в Европейском Союзе https://doi.org/10.2875/464022 (ЕС, 2017).
Вуонг, Л. Т., Блад, А. Б., Фогель, Дж. С., Андерсон, М. Э. и Гольдштейн, Б. Применение ускорителей МС в педиатрической оценке лекарств. Биоанализ 4 , 1871–1882 (2012).
CAS PubMed Google ученый
FDA. Общие рекомендации по клинической фармакологии для неонатальных исследований лекарственных и биологических продуктов Руководство для промышленности (FDA, 2019).
Tozuka, Z. et al. Исследование микродоз 14 C-ацетаминофена с помощью масс-спектрометрии с ускорителем для изучения фармакокинетики исходного лекарственного средства и метаболитов у здоровых субъектов. Clin. Pharmacol. Ther. 88 , 824–830 (2010).
CAS PubMed Google ученый
Лаппин, Г. и Гарнер, Р. К. в Справочник по аналитическим разделениям ,. Vol. 4. Биоаналитические разделения 331–349 (Elsevier, 2003).
FDA. Тестирование безопасности метаболитов лекарственных средств (FDA, 016).
Morgan, P. et al. Можно ли улучшить поток лекарств? Основные фармакокинетические и фармакологические принципы повышения выживаемости в фазе II. Drug Discov. Сегодня 17 , 419–424 (2012).
CAS PubMed Google ученый
Ли, К. М. и Фарде, Л. Использование позитронно-эмиссионной томографии для облегчения разработки лекарств для ЦНС. Trends Pharmacol. Sci. 27 , 310–316 (2006).
CAS PubMed Google ученый
ДиМази, Дж. А., Грабовски, Х. Г. и Хансен, Р. В. Инновации в фармацевтической промышленности: новые оценки затрат на исследования и разработки. J. Health Econ. 47 , 20–33 (2016).
PubMed Google ученый
DiMasi, J. A., Грабовски, Х. Г. и Хансен, Р. В. Стоимость разработки лекарств. N. Engl. J. Med. 372 , 1972 (2015).
PubMed Google ученый
ДиМази, Дж. А., Хансен, Р. В. и Грабовски, Х. Г. Цена инноваций: новые оценки затрат на разработку лекарств. J. Health Econ. 22 , 151–185 (2003).
PubMed Google ученый
Munos, B. Уроки 60 лет фармацевтических инноваций. Нац. Rev. Drug Discov. 8 , 959–968 (2009).
CAS PubMed Google ученый
Коллер Б. С. и Калифф Р. М. Путешествие по долине смерти: руководство по оценке перспектив успеха перевода. Sci. Пер. Med. 1 , 10см19 (2009 г.).
Google ученый
Даль К., Халлдин К. и Скоу М. Новые методики приготовления радиофармпрепаратов, меченных углеродом-11. Clin. Пер. Imaging 5 , 275–289 (2017).
PubMed PubMed Central Google ученый
Ли З. и Конти П. С. Радиофармацевтическая химия для позитронно-эмиссионной томографии. Adv. Препарат Делив. Ред. 62 , 1031–1051 (2010).
CAS PubMed Google ученый
Cook, D. et al. Уроки, извлеченные из судьбы фармацевтического конвейера AstraZeneca: пятимерная структура. Нац. Rev. Drug Discov. 13 , 419–431 (2014).
CAS PubMed Google ученый
Samkoe, K. S. et al. Токсичность и фармакокинетический профиль однократной инъекции ABY-029: флуоресцентной синтетической аффитной молекулы против EGFR для использования человеком. Мол. Imaging Biol. 19 , 512–521 (2017).
CAS PubMed PubMed Central Google ученый
Du, B. et al. Оценка физических и химических изменений в фармацевтических препаратах, используемых в космических полетах. AAPS J. 13 , 299–308 (2011).
CAS PubMed PubMed Central Google ученый
Stenstrom, K., Sydoff, M. & Mattsson, S. Микродозирование для ранних биокинетических исследований на людях. Radiat. Prot. Дозиметрия 139 , 348–352 (2010).
CAS PubMed Google ученый
Эял, С. Как изменяется фармакокинетика лекарств у космонавтов в космосе? Мнение эксперта. Drug Metab. Toxicol. https://doi.org/10.1080/17425255.2020.1746763 (2020).
Артикул PubMed Google ученый
Эяль, С.И Дерендорф, Х. Лекарства в космосе: в поисках путеводителя по галактике для фармаколога. Pharm. Res. 36 , 148 (2019).
PubMed Google ученый
Ивацубо Т., Сузуки Х. и Сугияма Ю. Прогнозирование видовых различий (крысы, собаки, люди) в метаболическом клиренсе YM796 in vivo печенью на основе данных in vitro. J. Pharmacol. Exp. Ther. 283 , 462–469 (1997).
CAS PubMed Google ученый
Ивацубо, Т., Хирота, Н., Оои, Т., Судзуки, Х. и Сугияма, Ю. Прогнозирование распределения лекарств in vivo на основе данных in vitro на основе физиологической фармакокинетики. Биофарм. Утилизация лекарств. 17 , 273–310 (1996).
CAS PubMed Google ученый
Chen, M. et al. Сверхчувствительный метод LC-MS / MS для определения уровней мидазолама в плазме крови человека: разработка, проверка и применение в клинических исследованиях. Биоанализ 9 , 297–312 (2017).
CAS PubMed Google ученый
Гарнер, Р. К. Практический опыт использования микродозирования человека с анализом AMS для получения данных о раннем метаболизме лекарственных средств и PK. Биоанализ 2 , 429–440 (2010).
CAS PubMed Google ученый
Янг, Г., Эллис, В., Айртон, Дж., Хасси, Э. и Адамкевич, Б. Ускорительная масс-спектрометрия (AMS): недавний опыт ее использования в клинических исследованиях и потенциальное будущее этого метода. Xenobiotica 31 , 619–632 (2001).
CAS PubMed Google ученый
Turteltaub, K. W. & Dingley, K. H. Применение ускоренной масс-спектрометрии (AMS) для количественной оценки и идентификации аддуктов ДНК. Toxicol.Lett. 102–103 , 435–439 (1998).
PubMed Google ученый
Бергстром, М. Использование микродозирования в разработке небольших органических и белковых терапевтических средств. J. Nucl. Med. 58 , 1188–1195 (2017).
CAS PubMed Google ученый
Wagner, C.C., Muller, M., Lappin, G. & Langer, O. Позитронно-эмиссионная томография для использования в исследованиях микродозирования. Curr. Opin. Drug Discov. Devel. 11 , 104–110 (2008).
CAS PubMed Google ученый
Бауэр, М., Вагнер, К. и Лангер, О. Исследования микродозирования у людей: роль позитронно-эмиссионной томографии. Лекарственные средства РД 9 , 73–81 (2008).
CAS Google ученый
Shebley, M. et al. Квалификация физиологически обоснованной фармакокинетической модели и процедуры отчетности для нормативных документов: перспектива консорциума. Clin. Pharmacol. Ther. 104 , 88–110 (2018).
PubMed PubMed Central Google ученый
Thorneloe, K. S. et al. Биораспределение и клиренс AlbudAb, новой платформы для биофармацевтической медицины, оценивали с помощью ПЭТ-изображений на людях. EJNMMI Res. 9 , 45 (2019).
PubMed PubMed Central Google ученый
Клинические испытания фазы 0: концепции и заблуждения
Cancer J.Авторская рукопись; доступно в PMC 2020 27 апреля.
Опубликован в окончательной редакции как:
PMCID: PMC7185299
NIHMSID: NIHMS1575547
, MD, * , PhD, † , PhD, ‡ , PhD ‡ , MD, * , MD, MS, FACP, † , PhD, ‡ , PhD, † , MBA, PhD, † , PhD, ‡ , DVM, PhD, † , MD, PhD, † , MD, * , PhD, * , PhD, † , PhD, † и, MD * †Shivaani Kummar
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Ларри Рубинштейн
† Отдел лечения и диагностики рака, Национальный институт рака, Бетезда, Мэриленд 20892;
Роберт Киндерс
‡ Лаборатория токсикологии и фармакологии человека, SAIC-Frederick, Inc., NCI-Frederick, Frederick, Maryland 21702.
Ralph E. Parchment
‡ Лаборатория токсикологии и фармакологии человека, SAIC-Frederick, Inc., NCI-Frederick, Frederick, Maryland 21702.
Martin E. Gutierrez
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Энтони Дж. Мурго
† Отдел лечения и диагностики рака, Национальный институт рака, Бетезда, Мэриленд 20892;
Джей Джи
‡ Лаборатория токсикологии и фармакологии человека, SAIC-Frederick, Inc., NCI-Frederick, Frederick, Maryland 21702.
Barbara Mroczkowski
† Отдел лечения и диагностики рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Оксана К. Пикерал
† Отдел лечения и диагностики рака, Национальный институт рака, Бетезда, Мэриленд 20892;
Мел Симпсон
‡ Лаборатория токсикологии и фармакологии человека, SAIC-Frederick, Inc., NCI-Frederick, Frederick, Maryland 21702.
Мелинда Холлингсхед
† Отдел лечения и диагностики рака, Национальный институт рака, Бетезда, Мэриленд 20892;
Шерри X. Ян
† Отдел лечения и диагностики рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Ли Хелман
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Роберт Уилтроут
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Джерри Коллинз
† Отдел лечения и диагностики рака, Национальный институт рака, Бетесда, Мэриленд 20892;
Джозеф Э.Tomaszewski
† Отдел лечения и диагностики рака, Национальный институт рака, Бетезда, Мэриленд 20892;
Джеймс Х. Дорошоу
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
† Отдел лечения и диагностики рака, Национальный институт рака, Бетесда, Мэриленд 20892;
* Центр исследований рака, Национальный институт рака, Бетесда, Мэриленд 20892;
† Отдел лечения и диагностики рака, Национальный институт рака, Бетесда, Мэриленд 20892;
‡ Лаборатория токсикологии и фармакологии человека, SAIC-Frederick, Inc., NCI-Frederick, Frederick, Maryland 21702.
Окончательная отредактированная версия этой статьи издателя доступна на сайте Cancer J См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Клинические испытания фазы 0, разработанные в ответ на недавнее руководство Управления США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по исследованию новых лекарственных средств (IND), предназначены для ускорения клинической оценки новых молекулярных образований. Исследовательский IND поддерживает проведение первых испытаний новых исследуемых агентов на людях в субтерапевтических дозах, основанных на сниженных производственных и токсикологических требованиях, что позволяет продемонстрировать целевые эффекты лекарственного средства и оценить фармакокинетико-фармакодинамические отношения у людей на ранних этапах клинической разработки.Цели клинического исследования рака фазы 0 заключаются в том, чтобы как можно раньше — до того, как большое количество пациентов будет набрано и подвергнется потенциальной токсичности, связанной с лекарственными препаратами, — установить, модулирует ли агент свою мишень в опухоли и, следовательно, будет ли дальнейшее клиническое исследование развитие оправдано. Мы рассматриваем здесь фундаментальные требования клинических исследований, проводимых в рамках исследовательского IND, и устраняем некоторые распространенные заблуждения относительно онкологических исследований фазы 0.
РУКОВОДСТВО ПО ЭКСПЛУАТАЦИОННОМУ ИССЛЕДОВАНИЮ НОВОГО ЛЕКАРСТВА
Разработка нового противоракового препарата — это дорогостоящее, долгосрочное и рискованное мероприятие с частотой неудач более 90%.Более половины новых лекарств в онкологии не работают на более поздних стадиях клинической разработки, что увеличивает затраты и время, необходимые для того, чтобы сделать эффективные методы лечения доступными для пациентов. 1,2 Чтобы ускорить открытие и разработку новых молекулярных образований, FDA выпустило в 2006 году руководство по исследованию новых лекарственных средств (IND) для поддержки клинической оценки перед исследованиями повышения дозы, безопасности и переносимости, связанными с традиционными IND. 3 Цели и конечные точки исследований фазы 0 (или предварительной фазы I), проводимых в рамках исследовательского IND, могут включать оценку модуляции предполагаемой мишени лекарственного средства у людей; оптимизация методологии целевого анализа с использованием образцов человека; предоставление фармакокинетических (ФК) данных; оценка взаимосвязи PK / фармакодинамики (PD); и выбор наиболее многообещающего ведущего агента из нескольких химических соединений или составов. 4
Основное различие между испытаниями фазы 0 и испытаниями, проводимыми в рамках традиционного IND, состоит в том, что испытания фазы 0 не имеют терапевтического назначения. Участникам исследования, которые могут быть как пациентами, так и здоровыми добровольцами, вводят субтерапевтические, но фармакологически активные дозы препарата. Воздействие агента на участников ограничено, но допускается повышение дозы при условии, что конечной точкой не является установление профиля безопасности / токсичности. Поскольку дозы и воздействие лекарств низкие, серьезных нежелательных явлений, связанных с лекарствами, не ожидается, и FDA позволяет использовать более ограниченные (однократные или краткосрочные) доклинические токсикологические исследования для установления запаса безопасности, а не ограничения дозы. токсичность.Кроме того, из-за небольшого количества исследуемого препарата, необходимого для проведения испытания фазы 0, полномасштабное коммерческое производство клинического уровня надлежащей производственной практики не требуется до начала испытания. Таким образом, испытания фазы 0 могут быть начаты раньше, чем традиционные исследования фазы I, что дает ценную возможность изучить целевые эффекты фармакокинетики и лекарств у людей намного раньше в клинической разработке агента. Данные, полученные в результате таких пилотных испытаний с участием небольшого числа пациентов, могут помочь в принятии решений относительно дальнейшей клинической разработки и лучше информировать дизайн последующих испытаний ().Данные ФК и ФД у человека помогут ускорить последующие испытания, такие как ускоренные (т. Е. С ограниченным уровнем дозы) исследования фазы I, испытания фазы I, сочетающие таргетные агенты с цитотоксическими препаратами, или испытания фазы I / II. На всех этих последующих этапах необходимо подать традиционную заявку IND для продолжения клинической оценки. В 2007 году авторами была проведена первая фаза 0 клинических испытаний терапевтического агента в онкологии для оценки ABT-888, ингибитора фермента репарации ДНК поли-АДФ-рибозо-полимеразы у пациентов с запущенными злокачественными новообразованиями. 5–7 Потенциальная ценность исследовательского IND для ускорения традиционного пути разработки лекарств была также признана благодаря его растущему использованию в фармацевтической промышленности. 8 Это особенно полезно при расстановке приоритетов для потенциальных агентов для дальнейшего изучения на очень ранних этапах процесса клинической разработки.
Сокращение сроков клинической разработки с помощью руководства по исследованию новых лекарственных средств (IND). Проведение исследования фазы 0 в рамках исследовательского IND может сократить время клинической разработки новых агентов и предоставить информацию для принятия дальнейших клинических решений.A. Испытания фазы I в рамках традиционного IND требуют существенных доклинических токсикологических исследований и полномасштабного производства исследуемого агента перед клиническим введением в соответствии с надлежащей производственной практикой. Фармакодинамические (PD) исследования обычно не проводят до начала испытаний фазы II. B, Фаза 0 исследования визуализации / биораспределения вводит субфармакологические дозы нового агента пациентам или здоровым добровольцам. Результаты этих испытаний могут быть достаточными для подтверждения принципа, и дальнейшие исследования фазы I повышения дозы могут не потребоваться.Эти визуализационные исследования могут быть использованы в качестве корреляционных исследований в последующих испытаниях терапевтических агентов фазы II / III. C, исследования фазы 0 с конечной точкой PD должны иметь утвержденный анализ PD до включения в клинические испытания. Решение о продолжении дальнейшей клинической разработки и проведении ускоренных испытаний комбинации фазы I / фазы I или фазы I / II может быть принято в зависимости от того, была ли достигнута цель PD в исследовании фазы 0.
Руководство FDAs по исследованию IND предоставляет 3 общих примера ранних клинических испытаний, которые касаются (1) ФК или визуализации, (2) фармакологически релевантных доз и (3) оценки механизма действия агента.В первом примере, предоставленном FDA, исследования предназначены для получения данных PK, но с использованием доз лекарств, которые не имеют фармакологических эффектов; этот пример вводит понятие «микродозирование». Микродозы определяются в руководстве как менее 1/100 от рассчитанного в доклинических токсикологических исследованиях на животных фармакологического эффекта до предела 100 мг (или не более 30 нмоль для белковых продуктов). На практике доклинические токсикологические исследования, проведенные в поддержку исследовательского IND, должны продемонстрировать, что доза, в 100 раз превышающая предложенную клиническую дозу, не вызывает нежелательных явлений.Для сравнения, начальная доза для первого онкологического исследования на людях, проводимого в рамках традиционного IND, может составлять 1/10 той дозы, которая привела к тяжелой токсичности или смерти у 10% протестированных грызунов. 9 Исследования микродозирования, также называемые следовыми дозами абсорбции, распределения, метаболизма и экскреции человека, включают введение разовой субфармакологической дозы изотопно меченного препарата для анализа с помощью «сверхчувствительной» ускорительной масс-спектрометрии или позитронно-эмиссионной томографии.Одна из основных проблем, связанных с исследованиями микродоз, заключается в том, что экстраполяция до терапевтических доз может быть затруднена из-за наличия нелинейной ФК; в таких обстоятельствах PK, определенная при исследовании микродоз, не позволяет прогнозировать PK агента при клинических уровнях доз. 10–12
Важно различать исследования, в которых вводят микродозы, от исследований, в которых вводят фармакологически активные, но субтерапевтические дозы. В первых исследованиях измеряли фармакокинетические параметры лекарственного средства, такие как сродство связывания и абсорбция, распределение, метаболизм и выведение.Последний, рассмотренный во втором и третьем примерах руководства FDA, оценивает конкретные, заранее определенные конечные точки PK и PD, представляющие особый интерес для разработки онкологических препаратов. Например, во втором примере руководства FDA исследования фазы 0 фармакологически релевантных доз могут установить параметры PK (такие как пероральная биодоступность) одного или нескольких исследуемых агентов, оценивая пригодность для дальнейшей разработки в дозах, несущих минимальный риск токсичности, связанной с лекарством. . Начальная доза определяется как 1/50 от уровня отсутствия наблюдаемых побочных эффектов, определенного в 2-недельном токсикологическом исследовании на грызунах.Если негрызуны являются наиболее чувствительными видами, агент-кандидат должен быть исключен из исследовательского IND. Повышение дозы для желаемого воздействия лекарственного средства или целевой модуляции разрешено, но ограничено в руководстве несколькими критериями максимальной дозы, например, дозой, при которой сначала измеряется фармакологический эффект или целевое модуляция, или клинически эквивалентной 1/4 дозы. отсутствие наблюдаемого уровня побочных эффектов в 2-недельном токсикологическом исследовании на грызунах или 1/2 площади под кривой для наиболее чувствительных видов, в зависимости от того, что ниже.
Третий пример руководства FDA охватывает исследования фазы 0 для оценки механизма действия агента. Эти исследования включают конечную точку PD, которая отражает активность лекарственного средства, такую как ингибирование целевого фермента в суррогатных образцах или образцах опухолевой ткани. Начальная доза для этих исследований согласуется с дозами для исследований, измеряющих конечные точки PK и PD, и основана на эффективности на моделях на животных. Руководство обеспечивает значительную гибкость в дизайне исследования; в недавнем обзоре описывается, как FDA разрешило фармацевтической компании провести испытание фазы 0 с более длительным периодом дозирования, чем максимальные 7 дней, описанные в руководстве. 8
Поскольку упор в исследованиях фазы 0 делается на доказательство концепции, а не на определение дозы, которую необходимо принять для тестирования фазы II на основе токсичности, количество необходимых участников меньше, чем для исследования фазы I, как правило только от 10 до 15. Таким образом, планы исследований фазы 0 должны учитывать статистические ограничения клинических исследований небольшого размера выборки, аналитические характеристики используемого анализа PD, вариабельность внутри пациента, а также молекулярную и гистологическую гетерогенность между пациентами при измерении эффектов PK / PD как первичные конечные точки.Проблема вариабельности внутри пациента вызывает особую озабоченность, когда первичная конечная точка получается из инвазивных биопсий опухоли, которые по своей природе не позволяют частый забор образцов ткани. В этом случае эффекты после лечения должны измеряться относительно вариабельности конечной точки до лечения, которую можно исследовать у разных пациентов, а не у отдельного пациента, что значительно затрудняет достижение статистической значимости, поскольку вариабельность конечных точек между пациентами, по определению, больше (часто намного больше), чем вариабельность внутри пациента.
Приемлемость пациентов к участию в онкологических испытаниях фазы 0 и фазы I схожа в том, что опухоли пациентов, вероятно, не поддаются лечению, одобренному FDA; однако исследования фазы 0 из-за их ограниченной продолжительности могут также включать пациентов с вялотекущими заболеваниями, такими как хронический лимфолейкоз или фолликулярные лимфомы, для которых стандартная терапия может не быть показана. Выбор участия в фазе 0, а не в первом исследовании с участием людей в фазе I, требует от пациента понимания того, что в случае исследования фазы 0 нет возможности получения терапевтического эффекта.
МОЛЕКУЛЯРНЫЕ ЦЕЛИ И ФАРМАКОДИНАМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Решение оценить новый исследуемый агент в рамках исследовательского, а не традиционного IND зависит от нескольких факторов. Для агента эти факторы включают низкую токсичность и широкий терапевтический индекс на животных моделях, позволяющий продемонстрировать модуляцию мишени при отсутствии значительных побочных эффектов. 4 Для испытаний фазы 0, оценивающих механизм действия, требуется значительная уже существующая информация о молекулярной фармакологии препарата, а также наличие теста PD, который может надежно измерить действие лекарственного средства на мишень, либо непосредственно в опухоли, либо в суррогате. ткань.Следовательно, одним из препятствий для проведения испытания фазы 0 является доступность ресурсов для разработки анализа, который был бы достаточно чувствительным, надежным и надежным для получения значимых результатов от небольшой популяции исследования. 13 Анализ также должен быть клинически осуществимым, поскольку исследуемый целевой эффект может наблюдаться в доступной ткани. Стандартные рабочие процедуры для обработки и обработки клинических образцов также необходимо оптимизировать в доклинических моделях до начала исследования. 14 Короче говоря, клиническая квалификация используемого метода PD имеет важное значение; анализ должен обеспечивать высокую степень уверенности в том, что действие лекарственного средства на намеченную цель может быть точно измерено, и должна быть возможность использовать результаты анализа для надежной поддержки решений о клинической разработке.
Некоторые из дополнительных проблем, связанных с использованием конечной точки PD в качестве основной цели в испытании фазы 0, включают небольшое количество вовлеченных пациентов, вариабельность выборки опухолей внутри и между пациентами и суррогатной ткани, различную гистологию опухоли в образце клинического испытания. и молекулярная гетерогенность в пределах типа опухоли, все из которых может ограничивать возможность демонстрации статистически значимого эффекта PD в опухоли-мишени или суррогатной ткани. 14,15
ЭТИЧЕСКИЕ ВОПРОСЫ
Обычно испытания фазы 0 критикуют за то, что они представляют собой эксперименты на людях, в частности, на пациентах с неизлечимыми формами рака, неэтичными, поскольку они не дают прямой терапевтической пользы. В онкологические исследования фазы I и фазы 0 набирают пациентов с запущенными злокачественными новообразованиями, которые не поддаются стандартным методам лечения. Этические вопросы, связанные с испытаниями фазы I, включая уместность и добровольный характер полученного информированного согласия, научную обоснованность исследования, восприятие и оценку риска / пользы, были предметом значительных дискуссий. 16–19 Испытания фазы 0 еще не подверглись такому же тщательному изучению, но присущее им отсутствие терапевтического намерения является очевидной этической проблемой. 20–22
Как и во всех исследованиях с участием людей, потенциальные риски должны быть тщательно оценены до получения одобрения протокола от экспертного совета учреждения, а безопасность пациентов имеет первостепенное значение. Совет по институциональной проверке должен гарантировать, что, помимо минимизации рисков, «риски для субъектов являются разумными по сравнению с ожидаемыми выгодами, если таковые имеются, и важностью знаний, которые можно разумно ожидать в результате» (45CFR.46.111). 23 Таким образом, оценка соотношения потенциальных рисков и потенциальных выгод при отсутствии прямой пользы для пациентов является сложной задачей. Даже при низких дозах и ограниченном графике дозирования риски не являются незначительными и включают риски, связанные с процедурами биопсии. По нашему опыту, во время разработки протокола и документа о согласии полезно обсудить с биоэтиками исследование и связанные с ним риски. В документе о согласии должно быть четко указано отсутствие терапевтического намерения, а также необходимость и связанный с этим риск биопсии опухоли.Кроме того, перед подписанием документа о согласии пациентов следует заставить устно выразить свое понимание этих элементов. Однако стоит отметить, что пациенты с неизлечимыми заболеваниями ценят информацию как о рисках, связанных с исследованием, так и о ценности знаний, которые можно получить в результате их участия. 24 По опыту авторов, большинство пациентов принимали участие в нескольких клинических испытаниях, прежде чем рассматривать исследование фазы 0, и, таким образом, знакомы с концепциями клинических исследований и исследовательских биопсий.Недавний анализ участников фазы I онкологического исследования не выявил когнитивных, медицинских или демографических факторов, связанных со сниженной способностью принимать обоснованные решения. 25 Кроме того, в отличие от этических проблем, связанных с получением исследовательских биопсий в исследованиях фазы I и II, решение пациента участвовать и предоставить образцы биопсии для исследовательских целей в рамках исследования фазы 0 не омрачено никаким восприятием прямой медицинской пользы. . 26,27 Испытание, основной целью которого является предоставление доказательств воздействия лекарственного средства на намеченную цель, не может достичь этой цели без анализа, способного измерить эти эффекты.Поэтому важно убедиться, что существует надежный анализ PD, который может помочь ответить на научный вопрос с высокой степенью уверенности, прежде чем просить пациентов пройти процедуры инвазивной биопсии, которые имеют известные риски. 26–28
Готовность пациентов участвовать в исследовании, предназначенном исключительно для получения обобщаемых знаний, примечательна и проистекает из желания помочь будущим больным раком. Поэтому важно постоянно информировать пациентов о результатах исследования и о том, как они повлияли на дальнейшую разработку агента.Также важно гарантировать, что участие в исследовании фазы 0 не откладывает и не исключает пациентов из участия в других клинических исследованиях, которые действительно предлагают возможность получения прямой выгоды. Это может быть достигнуто путем ограничения периода вымывания из предшествующей терапии (например, не более 2 недель) как для включения в исследование фазы 0, так и после завершения исследования перед включением в другое исследование. Кроме того, участие в исследовании фазы 0 не должно исключать пациентов из участия в последующих, более поздних стадиях исследования этого агента; в настоящее время существует общий язык в нескольких протоколах фазы I и II NCI, специально посвященных этой проблеме.Мы надеемся, что этот язык будет широко принят другими центрами исследования рака.
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Испытания фазы 0 могут помочь решить некоторые из наиболее сложных проблем при разработке новых лекарств в онкологии, помогая расставить приоритеты в потенциальных агентах для будущих исследований, сократить сроки разработки и продемонстрировать ингибирование целевых показателей с доказательством правильности концепции. . Например, результатов визуализационного исследования фазы 0 может быть достаточно для подтверждения принципа и устранения необходимости в испытании фазы I повышения дозы; Вместо этого визуализацию можно включить в качестве коррелятивного исследования в последующие оценки терапевтических агентов фазы II / III.Исследование фазы 0 с конечной точкой PD, соответствующей его цели, может поддержать решение перейти к ускоренным испытаниям фазы I, комбинации фазы I или фазы I / II. Важно подчеркнуть, что испытания фазы 0 не заменят испытания фазы I, проводимые в рамках традиционного IND, чтобы установить максимальную переносимую дозу и профиль токсичности лекарства. Не все исследуемые агенты подходят для оценки фазы 0. Для разработки подходящих анализов частичного разряда и процедур обработки образцов требуются значительные затраты времени и ресурсов.Кроме того, исследователям может быть сложно разработать ресурсы для исследований фазы 0, поскольку нетерапевтические клинические испытания не покрываются большинством сторонних плательщиков. Этические соображения, необходимые для проведения испытания фазы 0, не являются второстепенными, но откровенное и открытое обсуждение с участниками до, во время и после испытания будет взаимовыгодным.
Испытания фазы 0 действительно предлагают возможность оценить ФК и подтвердить действие агента на его предполагаемую молекулярную мишень в образцах человека на гораздо более ранних этапах клинической разработки.На сегодняшний день опыт исследований, проводимых в рамках поисковых IND, ограничен, но положителен. 8 Если действие лекарственного средства на цель можно оценить на более раннем этапе цикла разработки лекарственного средства и для этого требуется меньше пациентов, чем для традиционного IND, из этого следует, что клинические испытания будут меньше, а сроки разработки могут быть сокращены.
БЛАГОДАРНОСТИ
Авторы благодарят доктора Гилио Драетта за вдохновение и г-жу Джину Уленбраук, SAIC-Frederick, Inc., за помощь редактора в подготовке этой рукописи.
Этот проект полностью или частично финансируется за счет федеральных средств Национального института рака, Национальных институтов здравоохранения по контракту N01-CO-12400.
Сноски
Содержание данной публикации не обязательно отражает взгляды или политику Министерства здравоохранения и социальных служб, а упоминание торговых наименований, коммерческих продуктов или организаций не подразумевает одобрения со стороны правительства США.
СПИСОК ЛИТЕРАТУРЫ
1. Kola I, Landis J.Может ли фармацевтическая промышленность снизить уровень отсева? Nat Rev Drug Discov. 2004; 3: 711–715. [PubMed] [Google Scholar] 3. Министерство здравоохранения и социальных служб США, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Руководство для промышленности, исследователей и рецензентов: исследовательские исследования IND. Январь 2006 г. Доступно по адресу: http://www.fda.gov/cder/guidance/7086fnl.pdf. Доступно 21 февраля 2008 г. 4. Куммар С., Киндерс Р., Рубинштейн Л. и др. Сокращение сроков разработки лекарств в онкологии с использованием испытаний фазы «0». Нат Рев Рак.2007. 7: 131–139. [PubMed] [Google Scholar] 5. Куммар С., Киндерс Р., Гутьеррес М. и др. Ингибирование поли (АДФ-рибоза) полимеразы (PARP) с помощью ABT-888 у пациентов с запущенными злокачественными новообразованиями: результаты исследования фазы 0 [аннотация]. J Clin Oncol. 2007; 25: 3518. [Google Scholar] 6. Donawho CK, Luo Y, Luo Y и др. ABT-888, перорально активный ингибитор полимеразы поли (АДФ-рибозы), который усиливает действие агентов, повреждающих ДНК, на доклинических моделях опухолей. Clin Cancer Res. 2007. 13: 2728–2737. [PubMed] [Google Scholar] 7. Ratnam K, Low JA.Современные разработки клинических ингибиторов поли (АДФ-рибозы) полимеразы в онкологии. Clin Cancer Res. 2007. 13: 1383–1388. [PubMed] [Google Scholar] 8. Робинсон В.Т. Инновационные подходы к регулированию раннего развития: expIND, expCTA, микродозирование. Clin Pharmacol Ther. 2008; 83: 358–360. [PubMed] [Google Scholar] 9. ДеДжордж Дж. Дж., Ан Ч., Эндрюс П. А. и др. Нормативные аспекты доклинической разработки противоопухолевых препаратов. Cancer Chemother Pharmacol. 1998. 41: 173–185. [PubMed] [Google Scholar] 10.Лаппин Дж., Гарнер Р.С. Большая физика, малые дозы: использование АМС и ПЭТ в микродозировании разрабатываемых препаратов для человека. Nat Rev Drug Discov. 2003; 2: 233–240. [PubMed] [Google Scholar] 11. Лаппин Г., Кунц В., Йохемсен Р. и др. Использование микродозирования для прогнозирования фармакокинетики в терапевтической дозе: опыт применения 5 препаратов. Clin Pharmacol Ther. 2006; 80: 203–215. [PubMed] [Google Scholar] 12. Бойд Р.А., Лалонд Р.Л. Нетрадиционные подходы к исследованиям на людях для повышения эффективности разработки лекарств: окажут ли исследования микродоз значительный эффект? Clin Pharmacol Ther.2007; 81: 24–26. [PubMed] [Google Scholar] 14. Киндерс Р.Дж., Холлингсхед М., Пергамент Р.Э. и др. Доклиническое моделирование протокола клинического исследования фазы 0 [аннотация]. J Clin Oncol. 2007; 25: 14058. [Google Scholar] 15. Бетенский Р.А., Луис Д.Н., Кэрнкросс Дж. Г. и др. Влияние нераспознанной молекулярной гетерогенности на рандомизированные клинические испытания. J Clin Oncol. 2002; 20: 2495–2499. [PubMed] [Google Scholar] 16. Эмануэль Э.Дж., Вендлер Д., Грэди С. Что делает клинические исследования этичными? ДЖАМА. 2000. 283: 2701–2711. [PubMed] [Google Scholar] 17.Agrawal M, Emanuel EJ. Этика онкологических исследований фазы I: пересмотр аргументов и данных. ДЖАМА. 2003; 290: 1075–1082. [PubMed] [Google Scholar] 18. Иоффе С., Миллер Ф.Г. Переосмысление оценки риска и пользы для исследований рака I фазы. J Clin Oncol. 2006; 24: 2987–2990. [PubMed] [Google Scholar] 19. Койфман С.А., Агравал М., Гарретт-Майер Э. и др. Риски и преимущества, связанные с новыми дизайнами онкологических исследований фазы 1. Рак. 2007; 110: 1115–1124. [PubMed] [Google Scholar] 20. Киммельман Дж. Этика на этапе 0: прояснение вопросов.Этика J Law Med. 2007. 35: 727–733. [PubMed] [Google Scholar] 21. Hill TP. Испытания фазы 0: противоречат ли они этическим нормам? Clin Cancer Res. 2007; 13: 783–784. [PubMed] [Google Scholar] 22. Маркетти С., Schellens JHM. Влияние руководств FDA и EMEA на разработку лекарств в отношении испытаний фазы 0. Br J Рак. 2007; 97: 577–581. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Министерство здравоохранения и социальных служб США. Свод федеральных нормативных актов, раздел 45 — Общественное благосостояние, Министерство здравоохранения и социальных служб, часть 46: Защита прав человека.Пересмотрено июнь 23, 2005. Доступно по адресу: http://www.hhs.gov/ohrp/humansubjects/guidance/45cfr46.htm. Доступно 21 февраля 2008 г. 24. Agrawal M Добровольность клинических исследований в конце жизни. J Управление симптомами боли. 2003; 25: S25 – S32. [PubMed] [Google Scholar] 25. Зайденфельд Дж., Хорстманн Э., Эмануэль Э. Дж. И др. Участники онкологических исследований фазы 1: уязвимы ли они? Arch Intern Med. 2008; 168: 16–20. [PubMed] [Google Scholar] 26. Агульник М., Оза А.М., Пруд Г.Р. и др. Влияние и восприятие обязательной биопсии опухоли для корреляционных исследований в клинических испытаниях новых противораковых агентов.J Clin Oncol. 2006; 24: 4801–4807. [PubMed] [Google Scholar] 27. Helft PR, Догерти СК. Мы берем, не отдавая взамен? Этика биопсий, связанных с исследованиями, и преимущества участия в клинических испытаниях. J Clin Oncol. 2006; 24: 4793–4795. [PubMed] [Google Scholar] 28. Штадлер ВМ, Рэтэйн МДж. Разработка целевых противоопухолевых средств. Инвестируйте в новые лекарства. 2000. 18: 7–16. [PubMed] [Google Scholar]Директива о повторном открытии: часто задаваемые вопросы
Следующее руководство применимо ко всем этапам.
Жильцов необходимо проверять еженедельно до тех пор, пока не будут выполнены все указанные ниже критерии:
- Новых случаев заболевания COVID-19 среди жителей учреждения и положительных случаев среди персонала не выявлено (за исключением пациентов с известной инфекцией COVID-19 при поступлении в учреждение)
- Прошло не менее 14 дней с момента последнего положительного результата
- В течение этого 14-дневного периода было проведено не менее двух еженедельных тестов со всеми людьми с отрицательным результатом
Жители, у которых был подтвержден положительный результат, должны проходить повторное тестирование по мере необходимости в соответствии с рекомендациями CDS и CDC.
Персональное тестирование: плановое тестирование должно основываться на масштабах распространения вируса в сообществе, поэтому учреждения должны использовать региональный показатель положительности, указанный в Еженедельном отчете индекса уровня активности COVID-19 (CALI): https: //www.nj. gov / health / cd / statistics / covid / за предыдущую неделю в качестве триггера для частоты тестирования персонала следующим образом:
Региональный уровень CALI | Региональный процент положительных результатов за последнюю неделю | Минимальная частота тестирования |
Низкая | <3% | Один раз в неделю * |
Умеренная | 3–10% | Один раз в неделю * |
Высокий / Очень высокий | > 10% | Дважды в неделю ** |
Персонал с подтвержденным положительным результатом должен проходить повторное тестирование по мере необходимости в соответствии с рекомендациями CDC и NJDOH.
Любой резидент или персонал, у которых появились новые симптомы, соответствующие COVID-19, должны быть повторно обследованы при появлении симптомов, независимо от интервала между самым последним отрицательным тестом и появлением симптомов.
При средних и высоких показателях CALI учреждения могут запрашивать, но не требовать, чтобы посетители проходили тестирование самостоятельно до прибытия в учреждение (например, в течение 2–3 дней) с подтверждением отрицательных результатов теста и датой тестирования; посетитель может предоставить доказательство отрицательного результата одобренного или авторизованного FDA теста на месте оказания помощи, полученного и проведенного за последние 24 часа, или теста ПЦР, полученного и проведенного не более чем за 3 дня до визита.
Учреждениям, имеющим доступ к POC-тестированию, рекомендуется использовать его как часть процесса проверки посетителей, в частности, при высоких / очень высоких показателях CALI в регионе.
Фаза 0 исследование по изучению внутриопухолевой концентрации и активности сорафениба при нейрофиброматозе 2 типа
Введение
Шванномы, менингиомы и эпендимомы — это опухоли нервной системы, которые возникают спорадически или как часть наследственного заболевания нейрофиброматоза 2 типа (NF2).Мутации в гене нейрофибромина 2 / NF2 вызывают все шванномы, менингиомы и эпендимомы, связанные с NF2, 77% спорадических шванном, 60% спорадических менингиом и 30% спорадических эпендимом.1 Шванномы являются отличительной чертой NF2 и развиваются у всех пациентов с NF2. Современные методы лечения опухолей, связанных с NF2, — это хирургия или радиохирургия. Радиация может вызвать дополнительные мутации и образование вторичных опухолей в NF2, тогда как хирургия имеет ограниченное применение у пациентов с высокой опухолевой нагрузкой или опухолями, расположенными в местах, где резекция может вызвать неврологические осложнения.2 Авастин эффективен, но только у части пациентов. 2 Опубликованные согласованные рекомендации предполагают, что разработка эффективных методов лечения NF2 является неотложной задачей с большим потенциалом для клинического прогресса.
Рецептор тромбоцитарного фактора роста β (PDGFRβ) сверхэкспрессируется и активируется в клетках первичной шванномы человека, что приводит к усилению пролиферации. , это было успешно ингибировано in vitro.3
Здесь мы сообщаем об открытом исследовании моноагентного препарата фазы 0 (EudraCT: 2011-001789-16, REC: 11 / LO / 0771) по тестированию сорафениба у пациентов с NF2 с целью определить, происходит ли ингибирование молекулярных мишеней. с пероральным сорафенибом у пациентов с NF2 и может ли ингибирование мишени в плазме с пероральным сорафенибом у пациентов с NF2 действовать в качестве биомаркера.
Методы
Минимальная цель набора в соответствии с протоколом в зависимости от скорости фармакодинамического (PD) ответа составляла трех пациентов (два из трех или три из пяти с ответом на PD 60%).4 Здесь пять взрослых пациентов с NF2 и периферическими шванномами (PS), диагностированными в соответствии с критериями диагностики NF Национального института здоровья (NIH), получали сорафениб, вводимый перорально в максимально переносимой дозе (MTD) 400 мг, два раза в сутки. день, на 10…
Первый пациент прошел лечение в Центре опухолей мозга Плюща, этап 0
Феникс, Аризона, 10 марта 2021 г. (GLOBE NEWSWIRE) — Центр опухолей мозга Айви при Неврологическом институте Барроу объявил, что первый пациент прошел лечение в рамках фазы 0 клинического исследования памипариба при недавно диагностированной глиобластоме (nGBM) и рецидивирующей глиобластоме. (rGBM).Это первое клиническое исследование фазы 0, открытое для пациентов с впервые диагностированной глиобластомой. Памипариб — это исследуемый низкомолекулярный ингибитор PARP от BeiGene, Ltd. PARP — это белок, который играет важную роль в реакции выживания клеток на повреждение ДНК.
Девять из 10 человек с диагнозом глиобластома, наиболее агрессивная и распространенная первичная опухоль головного мозга, не проживут более пяти лет. Текущий стандарт лечения состоит из максимальной хирургической резекции с последующим облучением и химиотерапией темозоломидом (TMZ).Этот режим лечения увеличивает среднюю выживаемость до 15 месяцев, а сорок процентов пациентов с глиобластомой вообще не реагируют на TMZ.
«Радиация — единственный метод, который доказал свою пользу для выживаемости всех пациентов с глиобластомой. Мы рады изучить памипариб в этом исследовании фазы 0 в рамках наших усилий по выявлению лекарств, которые могут быть использованы для повышения эффективности лучевой терапии глиобластомы », — сказал Шветал Мехта, доктор философии, главный операционный директор и заместитель директора Центр опухолей мозга плюща.
Центр плюща зарегистрирует 12 пациентов с nGBM и 18 пациентов с rGBM в это инициированное исследователем клиническое исследование фазы 0. Зарегистрированные пациенты будут принимать исследуемый препарат в течение четырех дней до запланированной операции по удалению опухоли. В течение нескольких дней после операции команда Центра плюща определит, проникло ли лекарство в опухоль. Пациенты с положительными результатами могут перейти к расширенной фазе исследования, в которой терапевтическое дозирование памипариба сочетается с фракционированной лучевой терапией.Если памипариб не показывает доказательств достаточного проникновения в опухоль, пациенты могут перейти к другой терапии или клиническому испытанию, не теряя времени или получая неэффективное лечение.
«За более чем 15 лет финансирования исследований рака мозга я никогда не видела клинических испытаний, которые были бы более срочными и сфокусированными на пациенте, чем подход фазы 0 Центра плюща», — сказала Кэтрин Айви, основательница и президент правления Ben & Фонд Кэтрин Айви.
«Отчасти причина того, что новые лекарства от глиобластомы не появлялись на протяжении более трех десятилетий, заключается в том, что подавляющее большинство из них не способно преодолеть гематоэнцефалический барьер и добраться до опухоли.Каждое новое исследование фазы 0 в Центре плюща дает еще одну надежду на определение терапии, которая увеличит продолжительность жизни от глиобластомы и будет способствовать излечению », — сказал Надер Санаи, доктор медицины, директор Центра опухолей мозга плюща.
«Это испытание имеет большое значение как потому, что оно открыто для пациентов с недавно диагностированной глиобластомой (nGBM), так и потому, что это шанс лучше понять способность памипариба преодолевать гематоэнцефалический барьер», — сказал Йонг (Бен) Бен, доктор медицинских наук, Главный врач отделения иммуноонкологии BeiGene.«Центр опухолей мозга плюща собрал невероятную команду для выполнения этого исследования. Они преданы своим пациентам, пока работают над тем, чтобы добиться столь необходимого прогресса в поиске новых вариантов лечения. Мы очень рады работать с ними над этим историческим клиническим испытанием ».
Чтобы узнать больше об этом клиническом исследовании фазы 0, включая критерии отбора, посетите: https://clinicaltrials.gov/ct2/show/NCT04614909.
Click to Tweet:. @ IvyBrainTumCtr пролечил своего первого пациента в рамках первого в истории клинического испытания # Phase0 по поводу недавно диагностированной # глиобластомы для оценки памипариба @ BeiGeneUSA в сочетании с фракционированной лучевой терапией.
###
О Центре опухолей мозга Плюща
Центр опухолей мозга Плюща при Неврологическом институте Барроу в Фениксе, штат Аризона, — это некоммерческая программа трансляционных исследований, в которой используется смелая стратегия раннего этапа клинических испытаний для выявления новых лечение агрессивных опухолей головного мозга, в том числе глиобластомы. Программа клинических испытаний фазы 0 Центра плюща является крупнейшей в мире и обеспечивает индивидуальный уход за небольшую часть времени и затрат, связанных с разработкой традиционных лекарств.В отличие от обычных клинических испытаний, посвященных отдельным препаратам, в программе ускоренных испытаний проверяются терапевтические комбинации, подходящие для отдельных пациентов. Узнайте больше на IvyBrainTumorCenter.org. Следите за Центром опухолей мозга плюща в Facebook, Instagram, Twitter и LinkedIn.
О памипарибе
Памипариб — исследуемый ингибитор PARP1 и PARP2, который продемонстрировал фармакологические свойства, такие как проникновение в мозг и захват комплекса PARP-ДНК, на доклинических моделях.Обнаруженный учеными BeiGene, памипариб в настоящее время проходит глобальную клиническую разработку в качестве монотерапии или в комбинации с другими агентами для лечения различных злокачественных опухолей солидных опухолей. Клинические испытания памипариба также включают исследование фазы 1b / 2 (NCT03150862) в сочетании с лучевой терапией и / или темозоломидом у пациентов с глиобластомой первой линии или рецидивирующей / рефрактерной глиобластомой. На сегодняшний день более 1500 пациентов приняли участие в клинических испытаниях памипариба.
Новая заявка на лекарственный препарат (NDA) на памипариб для пациентов с раком яичников была принята и получила приоритетное рассмотрение Центром оценки лекарственных средств (CDE) Китайского национального управления по медицинским изделиям (NMPA) для лечения пациентов с опасным или подозреваемым заболеванием. вредоносная зародышевая линия с мутацией BRCA, распространенный рак яичников, маточной трубы или первичный рак брюшины, который лечился двумя или более линиями химиотерапии.
Начать с фазы 0/00 | Вайоминг Инициатива SBIR / STTR
WSSI
Что такое фаза 0/00
Этап 0/00 — это награда Вайоминга за микро-семена, которую можно использовать для общения и поездок в целевые федеральные агентства, консультантов и наставников для подготовки предложения фазы I / II, подготовки и рассмотрения предложения, общения с потенциальными клиентами. , анализы для поддержки подготовки данных испытаний, сбор данных испытаний для включения в предложение фазы I / II и другие мероприятия, связанные с подготовкой отмеченных наградами предложений фазы I / II.
Программа фазы 0
Малые предприятия штата Вайоминг или частные лица, планирующие подать Фазу I в любое из одиннадцати участвующих федеральных агентств, имеют право подать заявку на Фазу 0.
Предложения принимаются до 17:00 первого числа каждого месяца . Как правило, награды объявляются через две недели после даты подачи заявки.
Клиенты, получившие Фазу 0, выбирают опытного наставника Фазы 0 Вайоминга, успешного главного исследователя (PI) SBIR или STTR, чтобы помочь им с процессом подачи заявки и предоставить два полных обзора своего предложения Фазы I.
Ссылки на шаблон этапа 0 и запрос на этап 0.
Руководство победителя фазы 0
Руководство, подготовленное признанным на национальном уровне экспертом SBIR Марком Генри для победителей этапа 0 штата Вайоминг, первоначально было предоставлено только участникам этапа 0. WSSI поняла, что информация в руководстве поможет всем компаниям штата Вайоминг до того, как они начнут процесс фазы 0, об их инновациях, оценить процесс, решить, подходит ли программа, и подготовиться к написанию .Малые предприятия и PI, серьезно относящиеся к борьбе за федеральные деньги на НИОКР, должны начать с Руководства для победителей этапа 0.
Фаза 00 Программа
Подобно программе Фазы 0, Фаза 00 представляет собой конкурентный контракт, доступный для малых предприятий или частных лиц Вайоминга. Клиенты, выигравшие федеральный контракт или грант Фазы I, имеют право подать заявку на Фазу 00, чтобы помочь им с подготовкой предложения Фазы II. Предложения этапа 00 подлежат оплате до 17:00 первого числа каждого месяца. Награды обычно объявляются через две недели после крайнего срока подачи заявок. Свяжитесь с Келли Хейглер Корниш, менеджером программы WSSI, чтобы получить копию заявки этапа 00, [email protected]
Фаза 0 Определение | Law Insider
Относится к
Этап 0Этап 1 означает, что часть разрешенной разработки должна быть завершена, чтобы облегчить перемещение 6.5 миллионов тонн полигалита в год, включая в целом —
Этап 2 означает, что часть разрешенной разработки, которая должна быть завершена, чтобы облегчить перемещение 13 миллионов тонн полигалита в год, включая в целом
Этап III означает клиническое испытание Лицензионного продукта на людях на достаточном количестве субъектов в указанной популяции пациентов, которое проспективно предназначено для подтверждения того, что mAb2 или Лицензионный продукт безопасны и эффективны для предполагаемого использования, а также для определения соотношения польза / риск. , предупреждения, меры предосторожности и побочные реакции, связанные с таким продуктом в диапазоне доз, который должен быть прописан, и это испытание предназначено для подтверждения маркетингового утверждения такого mAb2 или Лицензионного продукта, включая все тесты и исследования, которые время от времени требуются FDA. в срок, в соответствии с Применимым законодательством или иным образом, включая судебные процессы, указанные в 21 C.F.R. §312.21 (c) с поправками.
Этап разработки означает период до утверждения типа транспортного средства.
Фаза I Исследование означает клиническое испытание на людях в любой стране, которое удовлетворяет требованиям 21 C.F.R. § 312.21 (a) (FDCA), с поправками, которые время от времени вносятся, и его иностранный эквивалент.
Участок под застройку означает любой земельный участок или участок, который существует или предназначен для застройки, кроме следующих:
Фаза II означает вторую часть программы поощрения за обучение, которая обеспечивает помощь в третьем и четвертом год 4-летних программ обучения.
Завершение проекта означает первую дату, на которую среднегодовое производство готовой продукции за предшествующий 90-дневный период на производственном объекте, управляемом правомочным предприятием в зоне экономического развития, составляет не менее 50 процентов от первоначальной проектной мощности. эксплуатации объекта. Соответствующий бизнес должен проинформировать отдел доходов в письменной форме на формах, утвержденных отделом доходов, в течение двух недель после завершения проекта.Для существующих объектов завершение проекта означает дату завершения всех улучшений, входящих в зону экономического развития.
Услуги на этапе строительства означает координацию, выполнение и выполнение Работ, требуемых настоящим Соглашением, которые дополнительно определены в Статье 8.
Клиническое исследование фазы I означает, в отношении конкретного Лицензионного продукта, исследование такой продукт для людей разработан в соответствии с требованиями 21 CFR § 312.21 (а), с поправками, время от времени вносимыми, или соответствующие нормативные акты в юрисдикциях, отличных от США.
Разработка означает улучшение.
Исследование воздействия на систему означает исследование, проведенное в соответствии с Разделом 22.8 Приложения P OATT, в котором оценивается влияние предлагаемого проекта передачи на безопасность и надежность системы передачи данных штата Нью-Йорк и, если применимо, на Затронутую систему. , чтобы определить, какие средства модернизации сети необходимы для предлагаемого проекта передачи данных для надежного подключения к системе передачи данных штата Нью-Йорк в соответствии со Стандартом соединения передачи данных NYISO, описанным в OATT, Раздел 22.6.4 Приложения P.
Технико-экономическое обоснование присоединения означает предварительную оценку воздействия на систему и стоимости присоединения большого генерирующего объекта к системе электропередачи штата Нью-Йорк, объем которой описан в Разделе 30.6 Стандартного крупного объекта. Процедуры подключения.
Испытание фазы I означает клиническое испытание Лицензионного продукта на людях, обозначенное как испытание фазы I и проводимое в первую очередь с целью определения безопасности и / или метаболизма и фармакологического действия Лицензионного продукта на людях, как описано в 21 CFR § 312.21 (а) (с изменениями и дополнениями в дальнейшем) и любой из его зарубежных эквивалентов. Для целей этого определения из исследования фазы I следует отдельно исключать испытания на здоровых добровольцах.
Клиническое испытание фазы I означает клиническое испытание на людях, которое предназначено для первоначальной оценки безопасности и / или фармакологического эффекта Продукта у субъектов или которое иным образом удовлетворяет требованиям 21 C.F.R. 312.21 (а) или его иностранный эквивалент.
Фаза или «Фазы» в отношении Проекта означают, что компоненты Проекта вводятся в эксплуатацию в течение более одного года в течение Инвестиционного периода, и слово «Фаза», таким образом, относится к применимой части Проект введен в эксплуатацию в конкретном году в течение инвестиционного периода.
Phase II Study означает клиническое испытание на людях, первичные конечные точки которого включают определение диапазонов доз и / или предварительное определение эффективности у пациентов, изучаемых, как описано в 21 C.F.R. § 312.21 (b) (FDCA), с поправками, которые время от времени вносятся, и его иностранный эквивалент.
Фаза 2 клинических испытаний означает клиническое испытание продукта на человеке в любой стране, которое удовлетворяет требованиям 21 C.F.R. 312.21 (b) и предназначена для изучения различных доз, доза-ответ и продолжительности эффекта, а также для получения первоначальных доказательств клинической безопасности и активности в целевой популяции пациентов или аналогичного клинического исследования, предписанного соответствующими регулирующими органами в страна, отличная от США.
Фаза 4 клинических испытаний означает клиническое испытание продукта в поддержку продукта, которое начинается после получения одобрения MAA в стране, где проводится такое испытание. Фаза 4 клинических испытаний может включать эпидемиологические исследования, моделирование и фармакоэкономические исследования, а также исследования постмаркетингового наблюдения.
Фаза I означает первую часть программы поощрительной помощи за обучение, определяемую как академический период в 80 семестров или 120 семестровых кредитов или меньше, ведущий к получению степени младшего специалиста или сертификата.
Испытание фазы 1 означает клиническое испытание продукта на человеке в любой стране, которое удовлетворяет требованиям 21 C.F.R. § 312.21 (a) или его зарубежный эквивалент.
Фаза II Клиническое исследование означает, в отношении конкретного Лицензионного продукта для конкретного показания, контролируемое и законное исследование на людях безопасности, диапазона доз и эффективности такого Лицензионного продукта для такого показания, которое в перспективе предназначено для получения достаточные данные (в случае успеха) для начала клинических испытаний фазы III такого Лицензионного продукта по такому показанию.
Фаза II клинических испытаний означает те испытания на достаточном количестве пациентов, которые предназначены для установления безопасности и оценки биологической активности лекарственного средства для его предполагаемого использования, а также для определения предупреждений, мер предосторожности и побочных реакций, связанных с лекарственным средством. в назначенном диапазоне доз.
Проект развития означает Инвестиции, прямо или косвенно, (а) в любые совместные предприятия или неограниченные дочерние компании, в которых Заемщик или любая из его Ограниченных дочерних компаний, прямо или косвенно, имеет контроль или с которыми у него есть управление, разработка или подобное договор и, в случае Совместного предприятия, в котором Заемщик или любое из его Ограниченных дочерних предприятий владеет (прямо или косвенно) не менее 25% Доли в капитале такого Совместного предприятия, или (b) в, или расходы в отношении , казино и «racinos» или Лица, владеющие казино или «racinos» (включая казино и «racinos», находящиеся в стадии разработки или строительства, которые в настоящее время не открыты или не работают, в отношении которых Заемщик или любая из его дочерних компаний с ограниченным доступом имеет (прямо или косвенно через Дочерние компании) заключили договор на управление, разработку или аналогичный договор, и такой договор остается в полной силе на момент такой Инвестиции), в каждом случае, используется для финансирования, или сделано с целью разрешить такому совместному предприятию, неограниченному дочернему предприятию, казино или «рацино», в зависимости от обстоятельств, финансировать покупку или иное приобретение любых основных или капитальных активов или реконструкцию существующих активов или строящуюся недвижимость, добавляет или значительно улучшает собственность такого совместного предприятия, неограниченного дочернего предприятия, казино или «рацино» и вспомогательные или связанные с ними активы (включая, помимо прочего, отели, рестораны и другие подобные проекты), или строительство и развитие казино, «Racino» или вспомогательные или связанные с ними активы (включая, помимо прочего, отели, рестораны и другие подобные проекты), включая расходы на подготовку к открытию в отношении такого совместного предприятия, неограниченного дочернего предприятия, казино или «racino».
