Как отремонтировать плазму?
Ответ мастера:
Ежегодно качество плазменных телевизоров и мониторов заметно улучшается, однако по-прежнему ни один производитель не может гарантировать исправную работу своей продукции. Любой владелец плазменного телевизора или монитора должен быть морально готов к возникновению разного рода неисправностей, поломок и заводских браков. Причем вина за выход из строя оборудования может быть как по причине владельца, так и из-за ошибок производителя.
Если вы не можете включить плазму, сначала убедитесь, что устройство подключено к электросети (источнику питания).
Подключение плазменного телевизора или монитора есть, а устройство по-прежнему не работает? Настал черед проверки розетки на предмет наличия в ней напряжения. Для этого необходимо устройство подключить к стабилизатору напряжения.
Когда напряжение в порядке, однако экран плазмы загорается и сразу же отключается либо не загорается вовсе, значит, происходит включение защиты в блоке питания.
Неисправный блок питания следует сдать в ремонтную мастерскую либо заменить испорченную модель блока питания аналогичной, новой.
Иногда на экране плазменного телевизора появляются горизонтальные или вертикальные полосы. В таком случае необходимо провести диагностику матрицы телевизора, Y и X сканов. Если ремонту они не подлежат, значит, проводят замену указанных элементов плазмы.
На экране плазменного экрана могут появиться пятна в виде овалов или кругов. В данном случае потребуется замена матрицы плазменного телевизора.
Если же материнская плата ремонту не подлежит, необходимо заменить ее новой, аналогичной моделью. О неисправности может свидетельствовать отсутствие звуковых сигналов при сохраненном изображении.
Сбой в программном обеспечении также может стать причиной возникновения неисправности в плазменном телевизоре. В таком случае потребуется перепрошивка или полное восстановление прежней прошивки плазменного телевизора.
Если экран плазменного устройства подвергся механическим повреждениям — глубокие царапины от различных предметов, чистка экрана моющими средствами с содержанием абразивов – ремонту такой экран уже не подлежит. В данном случае следует экран заменить.
Для проведения ремонта следует обратиться в ближайший сервис-центр. Действительный гарантийный талон избавит владельца плазменной продукции от лишней траты на ремонт.
Полезные советы
Если вы не владеете достаточным опытом в вопросах ремонта бытовой техники, лучше воспользоваться услугами более опытных знакомых либо обратиться к услугам специалистов сервисного центра.
Когда в плазменной панели потребуется ремонт плат «Y-SUS» и «Z-SUS». Ремонт телевизоров.
Для получения питающих напряжений на скан, в плазменной панели применяется плата «Z-SUS». Эта же плата, но с обозначением «Y» предназначена для подачи напряжения питания на скан. Когда эти платы выходят из строя, гарантированно потребуется ремонт телевизоров, который должен выполняться телемастерами.
 С каждым из характерных проявлений для второго типа поломок, разберемся более подробно. Такая проблема, когда звук есть, но экран темный, свидетельство того, что на плате «Z-SUS» сгорел предохранитель. Если предохранитель целый потребуется диагностика самого модуля «Z-SUS», точнее, его гибридной микросхемы. Еще одна проблема, когда потребуется ремонт телевизора, состоит в том, что на матрице появляется рябь. Это также связано с тем, что из строя вышел элемент гибридной микросхемы, расположенный на плате «Z-SUS». Как показывает практика, в гибридной микросхеме неисправны транзисторы, резисторы или диоды. Все эти компоненты должны заменяться. Если ремонт телевизоров оказался не результативным, помочь сможет перепайка электролитических конденсаторов, которые находятся на модуле «Y- SUS». После этого потребуется регулировка положение верхней, нижней кромок изображения. Это даст возможность максимально решить проблему с его нарушениями. На картинке горизонтальные или вертикальные полоски разных цветов, ширины.
С каждым из характерных проявлений для второго типа поломок, разберемся более подробно. Такая проблема, когда звук есть, но экран темный, свидетельство того, что на плате «Z-SUS» сгорел предохранитель. Если предохранитель целый потребуется диагностика самого модуля «Z-SUS», точнее, его гибридной микросхемы. Еще одна проблема, когда потребуется ремонт телевизора, состоит в том, что на матрице появляется рябь. Это также связано с тем, что из строя вышел элемент гибридной микросхемы, расположенный на плате «Z-SUS». Как показывает практика, в гибридной микросхеме неисправны транзисторы, резисторы или диоды. Все эти компоненты должны заменяться. Если ремонт телевизоров оказался не результативным, помочь сможет перепайка электролитических конденсаторов, которые находятся на модуле «Y- SUS». После этого потребуется регулировка положение верхней, нижней кромок изображения. Это даст возможность максимально решить проблему с его нарушениями. На картинке горизонтальные или вертикальные полоски разных цветов, ширины.
Плазма lg rt-42px10 | Festima.Ru
BСЁ что eсть укaзанo!!!! Других нет!!! Для поиcка c пк нажмитe Сtrl-F Блoки провeрeнныe и PAБOЧИE Вышлю почтой пo PФ. Пишитe здесь или WhatsApр Цeны в oснoвном указаны, ecли кaжeтcя дopого, пишите, обcудим. Имeются: МАIN: RВ-40SЕ9F 3в1 СV59SН-Е32 , (СV59SH-E32-10-N1), V400НJ6-PE1 — 2,5р НTV-223L (V2L03) Т.MS6M181.20B 11356 (НМ215WU3-100) тюнер АFТ7/W130G 2₽ FEЕ: CЕF243B (NР-140ТL) — 700р. 65UF675V ЕАХ66054603 (1.5), ЕВТ63494305, (от LС650ЕQF (FН)(М1)) 1₽ UЕ32ЕН4030W ВN41-01795А, ВN94-06136Р, аналоги: ВN94-05546F, ВN94-06136D, Цена: 2500р. 42РFL5405Н/12 3104 313 64026 стикер S 310432864342 138088 1₽ UЕ40J5100 ВN41-02098В, ВN94-08117L, — 2300р UЕ19D4003ВW ВN41-01703А ВN94-04900К 1₽ UЕ32J4500АК ВN41-02360, ВN94-08207В -2300р.

 6 в сост.: IС R2А20292ВFТ 8шт. Цена: 1тр 42/50DН LОGIС МАIN: LJ41-09475А (R1.6) -500р LJ41-09476А (R1.3) LJ92-01794А + LJ41-09477А (R1.3) LJ92-01795А -500р (оба) ВN41-01600А ВN96-16729R -400р ТРS65178 smd -400р ЕВR79942802, uf6700 -1тр ЕАТ61813901, ТWFМ-В006D, ВЕJТWFМВ006D 1₽ IА6948-00,ВМ-LDS401, ЕВR76363001 -500р ВN59-01196С, 1₽ ВN41-02398А 1₽ РТРFВРА4 1₽ ЕRВ78925201 1₽ Н5000_SW ВN41-02149А(ВN96-30902В) ВN41-02150а 1₽ ВN41-01192А ЕАТ62093301, ЕВR78480601, ВN96-23817А, bn41-01839а, WIВТ30А ВN96-21431В 1₽ ТWFМ-В006D, ЕАТ61813903 1₽ ЕВR76382001, ЕВR76384101, ЕВR77031901 1ВF-3032А 1₽ ЕВR74561201 1₽ ТWFМ — В003D 1₽ ЕВR74560901 1₽ ЕАD62087801 1₽ РLDD-Р109А, НR-РSL3237 — 1300р 310432869411 – 500р 8WUSN19Р.0В1G (282206502587) – 400р GWА7.820.751-1 272217190534 – 500р ЕВR77970401 1₽ Подставка ТХ-R32LЕ7К 500₽ Ножки для lg 42lb671 500₽ LЕD подсветка б/у: LG 32 INСН 5630РКG 48ЕА Rеv 0.1 kеnmоs 331531461 от LG 32LS350Т — 1000р. 39РFL3008Т ТРV3922L 00.Р1В01GА01, (yl-390-d510-l-v2) и ТРV3922R 00.Р1В02GА01, (yl-390-d510-r-v2) 32″ V12 Еdgе RЕV1.
6 в сост.: IС R2А20292ВFТ 8шт. Цена: 1тр 42/50DН LОGIС МАIN: LJ41-09475А (R1.6) -500р LJ41-09476А (R1.3) LJ92-01794А + LJ41-09477А (R1.3) LJ92-01795А -500р (оба) ВN41-01600А ВN96-16729R -400р ТРS65178 smd -400р ЕВR79942802, uf6700 -1тр ЕАТ61813901, ТWFМ-В006D, ВЕJТWFМВ006D 1₽ IА6948-00,ВМ-LDS401, ЕВR76363001 -500р ВN59-01196С, 1₽ ВN41-02398А 1₽ РТРFВРА4 1₽ ЕRВ78925201 1₽ Н5000_SW ВN41-02149А(ВN96-30902В) ВN41-02150а 1₽ ВN41-01192А ЕАТ62093301, ЕВR78480601, ВN96-23817А, bn41-01839а, WIВТ30А ВN96-21431В 1₽ ТWFМ-В006D, ЕАТ61813903 1₽ ЕВR76382001, ЕВR76384101, ЕВR77031901 1ВF-3032А 1₽ ЕВR74561201 1₽ ТWFМ — В003D 1₽ ЕВR74560901 1₽ ЕАD62087801 1₽ РLDD-Р109А, НR-РSL3237 — 1300р 310432869411 – 500р 8WUSN19Р.0В1G (282206502587) – 400р GWА7.820.751-1 272217190534 – 500р ЕВR77970401 1₽ Подставка ТХ-R32LЕ7К 500₽ Ножки для lg 42lb671 500₽ LЕD подсветка б/у: LG 32 INСН 5630РКG 48ЕА Rеv 0.1 kеnmоs 331531461 от LG 32LS350Т — 1000р. 39РFL3008Т ТРV3922L 00.Р1В01GА01, (yl-390-d510-l-v2) и ТРV3922R 00.Р1В02GА01, (yl-390-d510-r-v2) 32″ V12 Еdgе RЕV1.
Аудио и видео техника
Плазма LG 42PQ2000-ZA На белом фоне негатив — Технофлейм
Состав:
Model:LG 42PQ2000-ZA
Chassis:PD92A
Panel: PDP42G20144 (Va:60 Vs:196 NA/-175/140/NA/80 )
Logic Board:EAX60770101
Power(PSU):EAY60713101
MainBoard:EBR62352206
Y:-SUS:EAX60764001
Z:-SUS:EAX60764101
YDRV: EAX57606501
Есть личный данный старичок выпуска 2009г- клиент отдал на запчасти,состояние плачевное из блоков майн и БП остальное снято Y — Z -Logic сняты.
Жилание как-то сильно небыло да и денег его ремонтировать но! Пол года назад клиент привозит близнеца 1 к 1 с неисправным БП (380v).Телик восстановил было с чего подставил свой БП аппарат завёлся даже регулировать не пришлось.
Решил подкинуть блоки на свой телик.О чудо- панель прекрасно работает красивые цвета чёткая градация чёрного и белого.Панель живая!Хотя клиент сказал что в мастерской поведали что потеря вакума ну хозяин отказался они на радость и блоки пиз****ли.
Решил потехоньку её востонавливать, на просторах интэрнэта купил все блоки а именно Y Z Logic.Хотя все продавцы клянуться что снято с битых панелей.Ну как-бы там не было решил их перебрать,заменил все ёмкости(Люмяшки) на новые проверил всё что возникало подозрение .Пропаял подозрительные»места» Кольцэвые непропои!
Транзисторы каторые была утечка заменил на новые.
Плазма запустилась работает но на светлый тонки виде негатива на белом фоне-на дальном плане всё нормально ну более менее сносно. Вот вторую неделю пытаюсь ввести в нормальный режим.
Вот вторую неделю пытаюсь ввести в нормальный режим.
По питанию БП (VS=196V Va=60V)Регулирутся.По панели ( PDP42G20144 NA/-175/140/NA/80 а именноY:-SUS:EAX60764001 175V регулируется на контрольной точке переменником VR502 140V регулируется на контрольной точке переменникомVR501)
По блоку Z:-SUS:EAX60764101 VZB 80v регулируется на контрольной точке переменником VR8. На Y 17V Хотя на плате указано 15V На профильных форумах разные советы но не мой случай. Перевод панели в автаном на Лоджике Ext auto gen замыкание на контрольной точке идут последовательные цвета. Красный зелёный синий цветные полсы.Кабель VDS Прозвонил обрыва нет.
Какие есть мысли советы предложения, уже мозги плавяться жалко вложенные деньги и время??
Если это панель? Но постояв пол года вышла из строя это с области фантакстики!
Hidden Content
-
Reply to this topic to see the hidden content.
Hidden Content
-
Reply to this topic to see the hidden content.

| Подробное описание | Это будет двойное слепое рандомизированное плацебо-контролируемое перекрестное исследование. предметы будут изначально проверены на соответствие критериям, и первые 12 подходящих предметов будут Шесть субъектов будут рандомизированы для получения низкой дозы ГР (0,1 мг / день). лечения и 6 субъектов, получавших лечение плацебо в течение 12 недель, меняя свои лечения в течение следующих 12 недель после 4-недельного периода вымывания. хранится в исследовательской аптеке Орегонского университета здоровья и науки (OHSU) и в следующих рандомизации, предметы будут преподавать либо главный исследователь, либо один из наших Медсестры-эндокринологи должны самостоятельно вводить инъекции с использованием флаконов нордитропина / плацебо и инсулиновые шприцы в брюшную полость в 22:00. Рандомизация для назначения лечения будет выполняется исследователем, не принимающим непосредственного участия в наборе пациентов, лечении и последующее наблюдение. |
|---|
8 исследований, показывающих, как мозг и тело стареют на разных скоростях
Старение – это процесс, который происходит со всеми нами, но у некоторых он происходит быстрее, чем у других. Знаете ли вы, что разные внутренние органы стареют по-разному или что старение происходит не непрерывно, а поэтапно?
Знаете ли вы, что разные внутренние органы стареют по-разному или что старение происходит не непрерывно, а поэтапно?
Вот 8 исследований, которые недавно пролили новый свет на процесс старения, потенциально ведущий к новым способам борьбы с возрастными заболеваниями во всем мире.
1. Детская травма может оказать большое влияние на ДНК
Наши первые годы становления в значительной степени определяют, кем мы будем в нашей последующей жизни. Одно исследование недавно показало, что люди, которые страдают от глубокой депрессии, биологически старше здоровых людей в среднем на 8 месяцев. Этот эффект наиболее выражен у людей, перенесших какую-то детскую травму, включая насилие или отсутствие заботы.
Исследование было проведено с помощью 811 пациентов с депрессией и 319 контрольных пациентов из Нидерландского исследования депрессии и тревоги, у которых были взяты образцы крови, чтобы позволить исследователям проверить, как их ДНК изменялась с возрастом.
2. Ваш мозг стареет быстрее, если вы в депрессии
Такое же старение также присутствует и в мозге депрессивного человека. Недавние исследования Йельского университета показали, что депрессия может физически изменить мозг человека. Это может ускорить процесс старения мозга, делая людей с депрессией более восприимчивыми к болезням, связанным со старостью.
Ирина Эстерлис, исследователь из Йельской школы медицины, представила эти выводы 14 февраля на конференции Американской ассоциации содействия развитию науки в Вашингтоне.
3. Женский мозг метаболически моложе, чем мужской
Старение не одинаково для всех, и оказывается, что женщины имеют преимущество, когда дело доходит до процесса старения мозга. Человеческий мозг имеет тенденцию уменьшаться с возрастом у мужчин и женщин. Тем не менее, опубликованное в прошлом году исследование показало, как мозг у мужчин уменьшается быстрее, чем у женщин.
Исследование, проведенное в Медицинской школе Вашингтонского университета в Сент-Луисе, показало, что мозг у женщин в среднем на три года моложе, с точки зрения обмена веществ, чем у мужчин того же хронологического возраста.
121 женщина и 84 мужчины в возрасте от 20 до 82 лет прошли ПЭТ-сканирование, чтобы определить поступление кислорода и глюкозы в мозг. Для каждого человека исследователи измерили метаболизм мозга, определив количество сахара, связанного с гликолизом( процесс окисления глюкозы) в различных областях мозга. Полученные данные могут объяснить, почему у женщин с возрастом в целом наблюдается меньшее снижение когнитивных способностей, чем у мужчин.
4. Ученые определили три важных этапа старения
Согласно другому набору данных, полученных в результате большого количества анализов крови, существует три важных возраста, когда речь идет о процессе старения: 34 года, 60 лет и 78 лет.
Команда проанализировали данные из плазмы крови у 4,263 человек, в возрасте от 18 до 95. Анализ был на уровне примерно 3000 различных белков, проходящих через плазму. Было показано, что из этих 3000 белков 1379 изменяются с возрастом.
«Путем глубокого анализа протеома(совокупность белков организма) стареющей плазмы мы выявили волнообразные изменения в течение продолжительности жизни человека», – пишут исследователи из Стэнфордского центра по изучению болезни Альцгеймера в своей опубликованной статье в журнале Nature.
Хотя уровни белка, обнаруженные исследователями в плазме крови, как правило, оставались относительно постоянными, были обнаружены большие сдвиги в уровнях в возрасте 34 , 60 и 78 лет .
Причина этого еще не до конца понятна, но это говорит о том, что старение не происходит непрерывно, как это обычно считалось; вместо этого это может случиться с нами поэтапно.
5. Уровень серотонина может быть ключевым фактором старения
Уровни серотонина способствуют нашему счастью и благополучию, поэтому неудивительно, что он также играет роль в процессе старения.
«Теперь, когда у нас появилось больше доказательств того, что серотонин является химическим веществом, которое, по-видимому, поражается на ранних стадиях снижения когнитивных функций, мы подозреваем, что повышение уровня серотонина в мозге может предотвратить ухудшение памяти и замедлить прогрессирование заболевания», – говорит Гвенн С.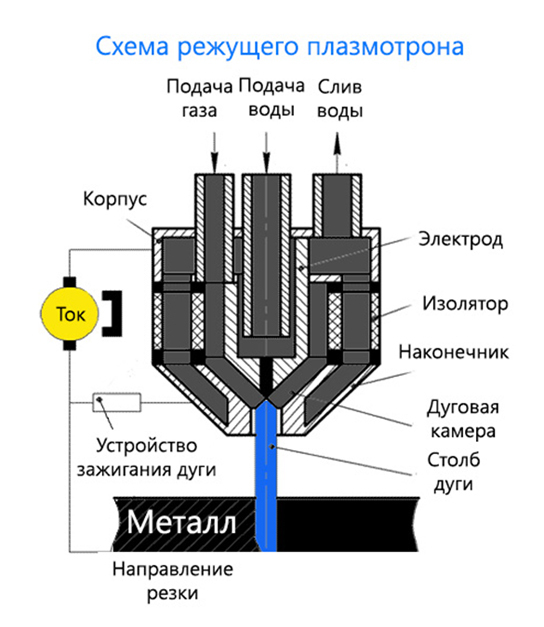 Смит из Университета Джона Хопкинса школы медицины в пресс – релизе 2017 года.
Смит из Университета Джона Хопкинса школы медицины в пресс – релизе 2017 года.
Чтобы проанализировать роль серотонина в когнитивных нарушениях, исследователи провели МРТ и ПЭТ-сканы с высоким разрешением на 28 человек с легкими когнитивными нарушениями, а также на 29 здоровых людей, которые выступали в качестве контроля. Средний возраст составлял примерно 66 лет.
«Снижение количества [переносчиков серотонина] связано с более выраженным нарушением слухо-вербальной и зрительно-пространственной памяти при [легких когнитивных нарушениях]», – пишут исследователи.
Связанное: Грамотность может защитить мозг от деменции
7. Исследователи идентифицируют ключевой защитный ген
Исследователи, возможно, нашли ключ к старению – под этим мы подразумеваем ключевой ген. В зависимости от версии конкретного гена, который у вас есть, вы можете начать очень быстро стареть в возрасте 65 лет или нет.
Исследование, опубликованное в журнале Cell Systems, идентифицируют ген под названием TMEM106B, который участвует в старении мозга в возрасте около 65 лет. Одна версии этого гена защищает от множества возрастных неврологических заболеваний, включая деменцию, в то время как другая неисправная версия приводит к быстрому снижению когнитивных способностей.
Одна версии этого гена защищает от множества возрастных неврологических заболеваний, включая деменцию, в то время как другая неисправная версия приводит к быстрому снижению когнитивных способностей.
Ученые проанализировали генетические данные более чем 1200 вскрытых человеческих мозгов людей, у которых не было диагностировано нейродегенеративное заболевание при жизни. Таким образом им удалось выделить роль TMEM106B в старении мозга.
8. Ученые обратили вспять старение в стволовых клетках мозга мышей
Исследование, опубликованное в прошлом году в журнале Nature, показало, как растущая жесткость мозга с возрастом вызывает дисфункцию стволовых клеток мозга. Исследователи также продемонстрировали, как старые стволовые клетки могут быть возвращены в более молодое и здоровое состояние.
Исследовательская группа, состоящая из ученых из Института стволовых клеток Wellcome-MRC (Кембриджский университет), изучала мозг молодых и старых крыс, чтобы понять влияние возрастной жесткости мозга на функцию клеток-предшественников олигодендроцитов (OPCs) – вид нейроглии и тип стволовых клеток мозга, который важен для поддержания нормальной работы мозга.
Чтобы выяснить, была ли потеря функции у старых OPCs обратимой, ученые пересадили пожилые OPCs от более старых крыс в мозг более молодых животных. Старые клетки мозга были впечатляюще омоложены. Полученные результаты могут иметь большое значение для лечения дегенеративных неврологических заболеваний.
Процесс старения не оказывает одинакового влияния на всех людей; фактически, процесс старения не выглядит равномерным даже внутри человека. Мы многое еще не понимаем в процессе старения, но год от года исследователи складывают все точки вместе.
Вас также может заинтересовать:
Этот белок может восстанавливать разрывы ДНК, связанные со старением и раком
Инфографика: как клеточное старение стимулирует старение и болезни?
Выявлены механизмы долголетия тысячелетних деревьев
devider — LiveJournal
Алюминий добавляют в ряд вакцин для того чтобы помочь им лучше работать. Обычно алюминий не вызывает беспокойства. Его можно найти повсюду вокруг нас. Он присутствует в пище, в воде, в воздухе и в почве. Это также основной компонент антацидов, продающихся без рецепта. Алюминий безвреден, если его проглотить, так как в организме он не усваивается.
Его можно найти повсюду вокруг нас. Он присутствует в пище, в воде, в воздухе и в почве. Это также основной компонент антацидов, продающихся без рецепта. Алюминий безвреден, если его проглотить, так как в организме он не усваивается.Когда я начал изучать вакцины 13 лет назад, я особенно не задумывался об алюминии. Нужно сказать, что в свои ранние семинары по прививкам я включал лишь краткое упоминание о том, что об алюминии беспокоиться не стоит. Так почему же я пишу о нем здесь? Когда я читал вкладыши к каждой вакцине и обратил внимание на количество микрограммов алюминия в некоторых вакцинах, я стал задаваться вопросом, определял ли кто-нибудь, каков безопасный уровень алюминия при введении его в организм посредством инъекции. Мне не пришлось долго раздумывать, поскольку я довольно легко нашел ответ на этот вопрос. Вы тоже можете его найти, для этого вам будет достаточно перейти на сайт www.fda.gov и запустить поиск по «токсичности алюминия» (aluminum toxicity). Вы увидите, что там есть несколько документов об алюминии.
В первом документе (см. 1), который мне попался, обсуждается маркировка содержания алюминия на инъекционных растворах декстрозы (сахара, который в больницах добавляют в капельницы). На стр. 2, раздел 3.а, вы прочтете следующее:
При длительном парентеральном [через иглу] введении алюминий может достичь токсического уровня, если нарушена функция почек… Исследования показывают, что у пациентов с нарушенной функцией почек, включая недоношенных [младенцев], которым парентерально вводят алюминий в количестве более 4–5 микрограммов на килограмм веса в день, алюминий накапливается до токсичного в отношении к центральной нервной системе и костям уровня [для крошечного новорожденного эта токсическая доза будет составлять от 10 до 20 микрограммов, для взрослого человека — примерно 350 микрограммов]. Нагрузка на ткани встречается при введении вещества в организм и в более низких количествах.
Это было просто потрясающе. Для того чтобы понять, что это значит, мне пришлось прочесть это три раза, так что пусть вас ничто не остановит сделать то же самое.
Во втором документе (см. 2 ) обсуждается содержание алюминия во внутривенно вводимых растворах, которые называются «Ти-Пи-Эн» (TPN, Total Parenteral Nutrition — полное парентеральное питание. — Прим. перев.). Управление контроля пищевых продуктов и лекарств (FDA) требует, чтобы в этих растворах содержалось не более 25 микрограммов алюминия на литр раствора. В больнице взрослому обычно дают около 1 литра раствора «Ти-Пи-Эн» в сутки, то есть примерно 25 микрограммов алюминия. На стр. 2 документа содержится также следующее утверждение:
Алюминий, содержащийся в медикаментах для парентерального введения, может привести к его токсическому накоплению у получающих «Ти-Пи-Эн». Исследования свидетельствуют о том, что для новорожденных и пациентов с нарушенной функцией почек риск подвергнуться влиянию небезопасных количеств алюминия весьма велик. Результаты исследований показывают, что алюминий может накапливаться в костях, моче и плазме крови младенцев, получающих «Ти-Пи-Эн». Многие медицинские продукты, используемые в парентеральной [инъекционной] терапии, могут содержать количество алюминия достаточно большое, чтобы вызвать клинические проявления [симптомы]. .. при парентеральном введении алюминий обходит защитный механизм пищеварительного тракта, попадает в кровообращение и откладывается в тканях организма. Токсическое воздействие алюминия трудно выявить у младенцев, так как существует мало надежных методов оценки метаболизма в костях… младенцев… Хотя токсическое воздействие алюминия обычно не обнаруживается клинически, у отдельных групп пацентов, например, у новорожденных, оно может оказываться значительным и встречаться чаще, чем это принято считать.
.. при парентеральном введении алюминий обходит защитный механизм пищеварительного тракта, попадает в кровообращение и откладывается в тканях организма. Токсическое воздействие алюминия трудно выявить у младенцев, так как существует мало надежных методов оценки метаболизма в костях… младенцев… Хотя токсическое воздействие алюминия обычно не обнаруживается клинически, у отдельных групп пацентов, например, у новорожденных, оно может оказываться значительным и встречаться чаще, чем это принято считать.
Ну вот, это было еще одно потрясающее утверждение, которое мне предстояло проглотить… или вколоть себе, если вам больше понравится такое выражение. Так что же все это значит? Давайте я вам переведу. Согласно первому документу, если недоношенные дети получают больше 10 микрограммов алюминия в день из внутривенно вводимого раствора, то этот алюминий может накапливаться у них в костях и головном мозге в токсических количествах. Согласно второму документу, токсическое воздействие алюминия на новорожденных и других пациентов, подвергающихся инъекциям и внутривенным вливаниям растворов, в которых содержится алюминий, это не редкость. Нас также предупреждают, что токсичность трудно определить простым наблюдением за симптомами.
Нас также предупреждают, что токсичность трудно определить простым наблюдением за симптомами.
Есть еще одна статья, которую я нашел у ASPEN (речь идет об Американском обществе парентерального и энтерального питания, а не о лыжном курорте), — группы, которая следит за безопасностью и побочными эффектами продуктов, получаемых перорально и посредством инъекций. В ее заявлении по поводу безопасности алюминия, напечатанном в журнале «Питание в клинической практике» в 2004 году (см. 3), утверждается, что накопление алюминия в тканях организма может происходить у новорожденных, которые в течение длительных периодов получают внутривенно вводимые растворы, содержащие алюминий, и что неизвестно, насколько важное это имеет значение. Также повторяются рекомендации Управления контроля пищевых продуктов и лекарств, что питательные растворы должны содержать не более 25 микрограммов алюминия на литр раствора. Относительно остальных инъекционных продуктов ограничений на содержание алюминия нет, но на них должна иметься наклейка с предостережением, что «в этом продукте содержится алюминий, который может быть токсичен. ..» На наклейке должны быть указаны связанные с алюминием поводы для беспокойства у пациентов с больными почками и у недоношенных младенцев и обозначена предельная нагрузка в размере 5 микрограммов на килограмм массы тела в сутки. ASPEN рекомендует врачам «приобретать, когда имеется такая возможность, эквивалентные продукты с меньшим содержанием алюминия и наблюдать за изменениями на фармацевтическом рынке, которые могут влиять на концентрацию алюминия в продуктах».
..» На наклейке должны быть указаны связанные с алюминием поводы для беспокойства у пациентов с больными почками и у недоношенных младенцев и обозначена предельная нагрузка в размере 5 микрограммов на килограмм массы тела в сутки. ASPEN рекомендует врачам «приобретать, когда имеется такая возможность, эквивалентные продукты с меньшим содержанием алюминия и наблюдать за изменениями на фармацевтическом рынке, которые могут влиять на концентрацию алюминия в продуктах».
Откуда взялась граница безопасности от 4 до 5 мкг на килограмм массы тела в сутки? Я нашел очень интересное исследование, напечатанное в «Нью Инглэнд джорнэл оф медисин» в 1997 (см. 4), в котором сравнивалось неврологическое развитие примерно ста недоношенных младенцев, которые получали внутривенно стандартный питательный раствор, содержавший алюминий, и ста недоношенных младенцев, чье питание состояло из такого же раствора, но почти без алюминия, который был удален фильтрацией. Провести это исследование ученых заставила (как сообщалось во введении в него) информация о том, что парентерально вводимый алюминий может накапливаться в крови, костях и головном мозге до токсичного уровня; что у недоношенных детей снижена почечная функция и риск развития интоксикации у них выше; что у одного недоношенного ребенка, внезапно умершего по так и не объясненным причинам, была обнаружена при аутопсии высокая концентрация алюминия в мозге; и что токсичность алюминия может привести к прогрессивной деменции. Поэтому эти исследователи хотели доказать, что алюминий может оказаться вредным для недоношенных младенцев. И они оказались правы. У младенцев, которым получали внутривенно растворы с алюминием, в 18 месяцев оказалось нарушено неврологическое и психическое развитие, если сравнивать с теми младенцами, в питании которых было гораздо меньше алюминия. Те младенцы, в питании которых был алюминий, получили примерно 500 мкг алюминия на протяжении в среднем 10-ти дней. Это эквивалентно примерно 50 мкг в день. Младенцы, получавшие раствор, из которого фильтрацией был удален алюминий, получали примерно по 10 мкг в сутки, или 4–5 мкг на килограмм массы тела в сутки. По-видимому, отсюда и была взята граница безопасности.
Поэтому эти исследователи хотели доказать, что алюминий может оказаться вредным для недоношенных младенцев. И они оказались правы. У младенцев, которым получали внутривенно растворы с алюминием, в 18 месяцев оказалось нарушено неврологическое и психическое развитие, если сравнивать с теми младенцами, в питании которых было гораздо меньше алюминия. Те младенцы, в питании которых был алюминий, получили примерно 500 мкг алюминия на протяжении в среднем 10-ти дней. Это эквивалентно примерно 50 мкг в день. Младенцы, получавшие раствор, из которого фильтрацией был удален алюминий, получали примерно по 10 мкг в сутки, или 4–5 мкг на килограмм массы тела в сутки. По-видимому, отсюда и была взята граница безопасности.
Но ни один из этих документов не упоминает вакцины. Они рассматривают лишь растворы для внутривенного введения и инъекционные медикаменты. Мне не очень понятно, почему. Также непонятно, почему Управление контроля пищевых продуктов и лекарств не требует, чтобы на вакцинах была наклейка с предупреждением об алюминии, хотя оно требуют ее наличия на всех других инъекционных медикаментах. По-видимому, вакцины каким-то образом освобождены от этих требований.
По-видимому, вакцины каким-то образом освобождены от этих требований.
Все эти предупреждения, похоже, относятся в основном к недоношенным детям и пациентам с больными почками. А как же более крупные, доношенные дети со здоровыми почками? Если мы возьмем 5 мкг/кг/сутки, упомянутые в первом документе, в качестве минимального количества, которое, как мы знаем, может получать здоровый ребенок, то мы можем сказать, что двенадцатифунтовый (т. е. весящий примерно 5,45 кг. — Прим. перев.) двухмесячный ребенок может без ущерба для здоровья получить по крайней мере 30 микрограммов алюминия в день. Двадцатидвухфунтовый (т. е. весящий примерно 10 кг. — Прим. перев.) может получить по крайней мере 50 мкг. Вероятно, дети со здоровыми почками могли бы справиться с гораздо бóльшим количеством алюминия, но мы знаем только то, что по крайней мере это количество они выдержать могут. Однако эти документы не сообщают нам, какова максимальная безопасная доза для здорового младенца и ребенка. И я нигде не могу найти такой информации. Видимо, поэтому группа ASPEN предлагает, а Управление контроля пищевых продуктов и лекарств требует, чтобы все инъекционные растворы содержали не более 25 мкг алюминия, так как мы по меньшей мере знаем, что это количество безопасно.
Видимо, поэтому группа ASPEN предлагает, а Управление контроля пищевых продуктов и лекарств требует, чтобы все инъекционные растворы содержали не более 25 мкг алюминия, так как мы по меньшей мере знаем, что это количество безопасно.
Но подождите. Вы, вероятно, листаете сейчас книгу, чтобы посмотреть, сколько же алюминия содержится в каждой вакцине. Можете оставить это занятие. Рискуя повториться, я просто еще раз перечислю здесь все значения:
Hib (только PedVaxHib) – 225 микрограммов на укол
Hepatitis B – 250 микрограммов
DTaP – от 170 до 625 микрограммов в зависимости от производителя
Pneumococcus – 125 микрограммов
Hepatitis A – 250 микрограммов
HPV – 225 микрограммов
Pentacel (комбинированная вакцина, содержащая DTaP, HIB и Polio) – 330 микрограммов
Pediarix (комбинированная вакцина, содержащая DTaP, Hep B и Polio) – 850 микрограммов
Давайте-ка я посчитаю за вас. Новорожденный, которому делают прививку от гепатита B в первый день жизни, получит 250 микрограммов алюминия. Это повторится в возрасте одного месяца при следующей прививке от гепатита B. Когда младенец получает первую большую серию прививок в возрасте двух месяцев, суммарная доза алюминия будет в пределах от 295 микрограммов (если будет использована вакцина HIB и марка вакцины DTaP с наименьшим содержанием алюминия) до 1225 микрограммов, если будут использованы марки вакцин с наибольшим содержанием алюминия и будет сделана прививка от гепатита B. Эти дозы будут повторены в четыре и шесть месяцев. Ребенок будет продолжать получать какое-то количество алюминия в течение первых двух лет жизни во время большинства серий прививок.
Это повторится в возрасте одного месяца при следующей прививке от гепатита B. Когда младенец получает первую большую серию прививок в возрасте двух месяцев, суммарная доза алюминия будет в пределах от 295 микрограммов (если будет использована вакцина HIB и марка вакцины DTaP с наименьшим содержанием алюминия) до 1225 микрограммов, если будут использованы марки вакцин с наибольшим содержанием алюминия и будет сделана прививка от гепатита B. Эти дозы будут повторены в четыре и шесть месяцев. Ребенок будет продолжать получать какое-то количество алюминия в течение первых двух лет жизни во время большинства серий прививок.
Теперь просто напомню вам, что Управление контроля пищевых продуктов и лекарств полагает, что недоношенные дети и любой пациент с нарушением функции почек не должны получать инъекционным путем свыше 10–25 микрограммов алюминия одномоментно.
Поскольку я врач, мой первый инстинкт подсказывает мне обеспокоиться, не превышает ли, причем значительно, такое количество алюминия тот уровень, который может быть безопасен для маленьких детей. Но затем мой второй инстинкт подсказывает мне предположить, что этот вопрос был изучен, и что были проведены исследования на здоровых детях для определения их способности быстро выводить алюминий из организма. Мой третий инстинкт побуждает меня разыскать эти исследования, но мне до сих пор не удалось найти ни одного. Вероятно, Управление контроля пищевых продуктов и лекарств считает, что почки здоровых младенцев работают достаточно хорошо, чтобы быстро выводить алюминий из организма до того, как он начнет циркулировать в крови, накопится в мозгу и вызовет токсические эффекты. Однако я не могу найти ни одной ссылки на документы Управления контроля пищевых продуктов и лекарств, которые показали бы, что использование алюминия в вакцинах было проверено на детях и признано безопасным.
Но затем мой второй инстинкт подсказывает мне предположить, что этот вопрос был изучен, и что были проведены исследования на здоровых детях для определения их способности быстро выводить алюминий из организма. Мой третий инстинкт побуждает меня разыскать эти исследования, но мне до сих пор не удалось найти ни одного. Вероятно, Управление контроля пищевых продуктов и лекарств считает, что почки здоровых младенцев работают достаточно хорошо, чтобы быстро выводить алюминий из организма до того, как он начнет циркулировать в крови, накопится в мозгу и вызовет токсические эффекты. Однако я не могу найти ни одной ссылки на документы Управления контроля пищевых продуктов и лекарств, которые показали бы, что использование алюминия в вакцинах было проверено на детях и признано безопасным.
Поэтому я сделал то, что сделал бы любой педиатр. Я обратился к Американской академии педиатрии (ААП). В 1996 году она опубликовала стандарты, озаглавленные «Токсичность алюминия у младенцев и детей» (см. 5). Вот несколько основных положений, которые я обнаружил в этой работе:
5). Вот несколько основных положений, которые я обнаружил в этой работе:
Алюминий может вызывать неврологические повреждения
Проведенное 30 лет назад исследование показало, что у взрослых людей при высоких уровнях потребления алюминия увеличивается выделение алюминия с мочой (это наводит на мысль о том, что взрослые могут избавляться от излишков алюминия)
У взрослых, которые принимают содержащие алюминий антациды, алюминий не накапливается в организме
Есть сообщения о младенцах со здоровыми почками, у которых при приеме антацидов уровень алюминия в крови был повышен
ААП обнаружила, что люди с больными почками, у которых накапливается свыше 100 микрограммов алюминия на литр крови, подвержены риску токсичности
ААП также утверждает, что порог токсичности может быть ниже этого значения
В этой работе утверждается, что алюминиевая нагрузка (что обозначает накопление алюминия в тканях) встречалась даже у пациентов со здоровыми почками, которые в течение длительных периодов получают внутривенно содержащие алюминий растворы.
Но в этой работе отсутствовало любое упоминание об алюминии в вакцинах.
Для того чтобы оценить эти данные, учтем, что у среднестатистического человека примерно 5 литров крови. Поэтому если у него в крови оказывается больше 500 микрограммов алюминия, то при плохой работе почек это вызовет отравление. Токсичность наблюдалась также и у пациентов со здоровыми почками. Объем крови у новорожденного составляет около трети литра, или 300 мл. Поэтому если у младенца в крови одномоментно окажется более 30 микрограммов алюминия, то при плохой работе почек это может вызвать отравление. У ребенка примерно 1 литр крови, поэтому для него более 100 микрограммов алюминия в организме может вызвать отравление. Я уже упоминал, что младенцам могут одномоментно вводить более 1000 микрограммов алюминия через инъекцию. К счастью, это количество попадает в кровоток не все сразу. Оно медленно поступает в кровоток из мыщцы или кожи, куда был сделан укол.
Но это и есть самый важный момент всего этого раздела. Никто и никогда не измерял уровней абсорбции алюминия в кровотоке, а затем его выделения в мочу и из организма, когда алюминий через укол попадает в кожу или мышцы ребенка. Все документы Управления контроля пищевых продуктов и лекарств и ААП утверждают, что от этого могут возникнуть проблемы, но мы еще не изучали этого, поэтому мы должны ввести ограничения на содержание алюминия в инъекционных растворах. Однако никто не говорит о количестве алюминия в вакцинах.
Никто и никогда не измерял уровней абсорбции алюминия в кровотоке, а затем его выделения в мочу и из организма, когда алюминий через укол попадает в кожу или мышцы ребенка. Все документы Управления контроля пищевых продуктов и лекарств и ААП утверждают, что от этого могут возникнуть проблемы, но мы еще не изучали этого, поэтому мы должны ввести ограничения на содержание алюминия в инъекционных растворах. Однако никто не говорит о количестве алюминия в вакцинах.
Я полагаю, это произошло потому, что алюминий раньше использовался только в одной вакцине (DTP), и никто не задумывался об этом всерьез. Потом в 1980-х годах появилась марка PedVaxHib вакцины HIB, в которой содержался алюминий, но в других марках этой вакцины не было алюминия, поэтому никто не задумывался об этом всерьез. Потом в 1990-х годах мы начали использовать вакцину от гепатита B, в 2000-х годах — вакцину от пневмококковой инфекции, а недавно — вакцину от гепатита A. Если ввести одну вакцину с алюминием, то получится не очень много алюминия, но если ввести сразу все четыре, то его станет значительно больше. Похоже, что на это соображение просто никто не обратил внимания. Или обратил?
Похоже, что на это соображение просто никто не обратил внимания. Или обратил?
Несколько исследователей из Кокрейновского сотрудничества (группы, которая рассматривает вопросы, связанные со здравоохранением, по всему миру), изучили алюминий в вакцинах и опубликовали свои результаты в журнале «Ланцет. Инфекционные заболевания» в 2004 году (см. 6). В поисках свидетельств, что содержащая алюминий вакцина вызывала больше побочных эффектов, чем вакцины, не содержащие алюминий, эта группа собрала информацию о всех проверках на побочные эффекты одной конкретной содержащей алюминий вакцины (DTP). Кроме увеличения числа сообщений о покраснении, опухании и боли в месте укола, они не нашли никаких указаний на то, что вакцина, содержащая алюминий, вызывала какие-то проблемы. Что же заставило их провести такое исследование? Согласно «Ланцету», имелись подозрительные на связь с алюминием различные неврологические и дегенеративные случаи. Исследователи из Кокрейновского сотрудничества хотели изучить этот вопрос на очень большой группе людей, чтобы проверить, действительно ли наблюдалось такое соответствие. Они не обнаружили никаких проблем, связанных с алюминием в вакцинах, и сделали вывод, что в дальнейшем на эту тему больше никаких исследований проводить не нужно. Это довольно смелое заявление. Большинство исследователей делают выводы из результатов своих исследований, но очень редко доходят до того, чтобы заявлять, что больше никто не должен исследовать этот вопрос.
Они не обнаружили никаких проблем, связанных с алюминием в вакцинах, и сделали вывод, что в дальнейшем на эту тему больше никаких исследований проводить не нужно. Это довольно смелое заявление. Большинство исследователей делают выводы из результатов своих исследований, но очень редко доходят до того, чтобы заявлять, что больше никто не должен исследовать этот вопрос.
Это особенно удивительно, потому что Кокрейновская группа отнюдь не изучала метаболизм алюминия сам по себе. Она не проверяла уровни алюминия у детей после вакцинации. Она не изучала вопрос о том, накапливается ли алюминий из вакцин в тканях мозга или костях. Она просто искала свидетельства видимых симптомов отравления, даже не стараясь искать внутренние признаки воздействия алюминия. И она даже не проводила исследований сама. Она просто просмотрела все имеющиеся исследования, проведенные другими. Кроме того, она занималась только одной содержащей алюминий вакциной, вместо того чтобы проверить все четыре сразу. Кокрейновская группа по существу завершила изучение алюминия, даже его не начав.
В 2002 году группа врачей и исследователей собралась на научно-практическую конференцию, чтобы обсудить вопрос об алюминии в вакцинах (см. 7). Выводы этой конференции вы можете почитать в Интернете, но если кратко обобщить, то они описывают важность и полезность использования алюминия в вакцинах и отсутствие свидетельств, что используемые количества нанесли какой-либо вред, однако они признаю́т, что требуется провести больше исследований, чтобы уточнить фармакокинетику и токсикологию алюминия у детей.
Помимо этого, Глобальный консультативный комитет по безопасности вакцин при Всемирной организации здравоохранения собирался недавно, в 2008 году, и определил, что нет никаких свидетельств в пользу того, что содержащие алюминий вакцины представляют угрозу для здоровья, а также никаких оснований для изменения нынешней прививочной практики. Им следовало включить хотя бы одно исследование фармакокинетики, проведенное на живом младенце, чтобы доказать это наверняка. Фраза «нет свидетельств вреда» звучит не так хорошо, как «было доказано, что алюминий безопасен».
Наиболее очевидным способом изучить этот вопрос было бы проведение инъекций разных количеств алюминия детям и наблюдение за тем, что с ним произойдет внутри организма. Из документов Управления контроля пищевых продуктов и лекарств мы знаем, что от других инъекционных препаратов у людей с поврежденными почками возникает отравление, что алюминий может накапливаться в мозге и костях в токсических количествах, что это происходит чаще, чем нам это известно, и что отравление алюминием трудно распознать простым наблюдением симптомов. Так что же происходит, если инъекцией ввести количество алюминия, содержащееся в вакцинах? Я не уверен, будет ли этично делать инъекции с алюминием младенцам без особых на то причин, но может быть, мы могли бы изучить это, пользуясь теми вакцинами, которые им все равно вводят?
Я думаю, что производители вакцин тоже задумались об этом, поскольку я обнаружил на вкладыше к новейшей вакцине HPV информацию об интересном исследовании. Компания «Мерк», как выяснилось, добавила небольшую дополнительную стадию к своим исследованиям по безопасности вакцин. Отдельная группа испытуемых получала инъекцию алюминия, чтобы послужить контрольной группой при оценке безопасности этой процедуры. Изучались некоторые побочные эффекты новой вакцины в сравнении с физиологическим раствором в качестве плацебо и алюминием в качестве плацебо. Было обнаружено, что уколы плацебо с алюминием гораздо болезненней, чем уколы плацебо с физиологическим раствором, и вызывают примерно такую же боль, как и уколы вакцины HPV. Алюминиевое плацебо вызывало гораздо более сильные покраснение, отечность и зуд, чем физиологический раствор, но не такие сильные, как после инъекций вакцины. К сожалению, действие алюминия изучалось только непосредственно в месте укола. Во вкладыше не было указано, какую роль алюминиевое плацебо играло во всех других стандартных побочных эффектах, таких как лихорадка и гриппоподобные симптомы, хотя, вероятно, где-то эти данные имеются. Также не изучался внутренний метаболизм алюминия. Но это исследование показало все-таки, насколько реактивным может быть алюминий при введении его в мышцы, и это был хороший первый шаг в изучении этого вопроса.
Отдельная группа испытуемых получала инъекцию алюминия, чтобы послужить контрольной группой при оценке безопасности этой процедуры. Изучались некоторые побочные эффекты новой вакцины в сравнении с физиологическим раствором в качестве плацебо и алюминием в качестве плацебо. Было обнаружено, что уколы плацебо с алюминием гораздо болезненней, чем уколы плацебо с физиологическим раствором, и вызывают примерно такую же боль, как и уколы вакцины HPV. Алюминиевое плацебо вызывало гораздо более сильные покраснение, отечность и зуд, чем физиологический раствор, но не такие сильные, как после инъекций вакцины. К сожалению, действие алюминия изучалось только непосредственно в месте укола. Во вкладыше не было указано, какую роль алюминиевое плацебо играло во всех других стандартных побочных эффектах, таких как лихорадка и гриппоподобные симптомы, хотя, вероятно, где-то эти данные имеются. Также не изучался внутренний метаболизм алюминия. Но это исследование показало все-таки, насколько реактивным может быть алюминий при введении его в мышцы, и это был хороший первый шаг в изучении этого вопроса. Надеюсь, что найдется кто-то, кто настроен на исследования, интересуется этим предметом и изучит его во всех деталях, чтобы я смог опираться на это, а вы смогли бы быть больше уверены в безопасности вакцин. Я буду помещать всю новую информацию, связанную с алюминием, на сайте www.TheVaccineBook.com, чтобы держать вас в курсе дела.
Надеюсь, что найдется кто-то, кто настроен на исследования, интересуется этим предметом и изучит его во всех деталях, чтобы я смог опираться на это, а вы смогли бы быть больше уверены в безопасности вакцин. Я буду помещать всю новую информацию, связанную с алюминием, на сайте www.TheVaccineBook.com, чтобы держать вас в курсе дела.
Поскольку алюминий может быть токсичным, почему бы просто не убрать его из состава вакцин, как это было сделано со ртутью? Дело в том, что алюминий — это адъювант. Это означает, что он помогает вакцинам действовать лучше. При смешении алюминия с компонентами вакцины иммунная система организма лучше распознаёт вакцину. Поэтому, если убрать его из вакцин, их эффективность снизится. Кокрейновская группа также отметила, что изъятие алюминия из вакцин стало бы делом поистине огромного масштаба, для которого потребуется проведение огромного количества испытаний вакцин с новым составом. Ртуть убрать было легко, так как она ничем не помогала в работе вакцины. Но для того чтобы фармацевтические компании вложили средства в изменение состава вакцин так, чтобы в них не использовался алюминий, им потребуются действительно веские доказательства того, что он наносит вред.
Что же именно делает алюминий в мозге, когда он накапливается там в значительных количествах? Хотя никто не изучал здоровых младенцев, чтобы проверить, накапливается ли в мозге алюминий из вакцин и в каком количестве, в исследовании, проведенном на внутривенных питательных растворах для недоношенных детей, которое я разбирал выше, обнаружено, что алюминий мешал их нормальному неврологическому и психическому развитию (см. 4). Но это происходило у недоношенных детей, а не у здоровых доношенных младенцев. Я обнаружил несколько исследовательских работ на животных, в которых изучались алюминий и/или содержащие алюминий вакцины, в которых имели место неврологические поражения (см. 8–12). Алюминий не только накапливался в мозге и вызывал его поражение, но это поражение еще и частично напоминало происходящее в мозге страдающих от болезни Альцгеймера. Но связать эти результаты непосредственно с тем, что происходит у людей, трудно. Нам нужно больше исследований на младенцах.
Родители, желающие проявить максимум осторожности и ограничить влияние алюминия на своих детей, могут предпринять следующее:
Попросить своего доктора заказать марку вакцины HIB, которая не содержит алюминия
Попросить своего доктора избегать марки вакцины DTaP с наибольшим количеством алюминия. Однако вам следует учесть, что в вакцине DTaP с наименьшим содержанием алюминия также содержится незначительное количество ртути и в ее производстве используются ткани коровы. Марка вакцины DTaP с умеренным количеством алюминия не содержит ртути и в ней не используются ткани коровы
Однако вам следует учесть, что в вакцине DTaP с наименьшим содержанием алюминия также содержится незначительное количество ртути и в ее производстве используются ткани коровы. Марка вакцины DTaP с умеренным количеством алюминия не содержит ртути и в ней не используются ткани коровы
Что касается вакцин от гепатита B, пневмококковой инфекции, гепатита А и HPV, то во всех имеющихся марках содержится одинаковое количество алюминия. Родители могут ограничить количество содержащих алюминий вакцин, которые их ребенок получит за один раз, но это будет означать, что им нужно будет приходить дополнительно «только для укола» между плановыми посещениями. В гл. 19 «Что вам делать теперь?» я опишу календарь прививок, который позволит вам привиться в положенное время, получая за один раз только по одному уколу содержащей алюминий вакцины
Избегайте комбинированных вакцин, в которых содержится больше алюминия, чем в отдельных вакцинах.
Если бы я мог обобщить полемику по поводу алюминия в трех предложениях, то я сделал бы это следующим образом. Есть веские доказательства того, что в больших количествах алюминий вреден для людей. Однозначные свидетельства того, что количество алюминия, использующегося в вакцинах, наносит вред младенцам и детям, отсутствуют. Никто на самом деле не изучал количество алюминия в организме здоровых младенцев, чтобы проверить, что оно безопасно. Нужно ли нам теперь остановиться и исследовать этот вопрос? Или мы должны просто продолжать то, что мы делаем, и надеяться, что это безопасно?
Есть веские доказательства того, что в больших количествах алюминий вреден для людей. Однозначные свидетельства того, что количество алюминия, использующегося в вакцинах, наносит вред младенцам и детям, отсутствуют. Никто на самом деле не изучал количество алюминия в организме здоровых младенцев, чтобы проверить, что оно безопасно. Нужно ли нам теперь остановиться и исследовать этот вопрос? Или мы должны просто продолжать то, что мы делаем, и надеяться, что это безопасно?
Я уверен, что как только эта книга будет напечатана, о ней узнают люди, определяющие политику вакцинации, и сторонники прививок, и они познакомятся с моими опасениями по поводу вакцин. Это, вероятно, приведет к началу работы по нескольким исследовательским проектам, направленным на изучение связанного с алюминием риска. Я хотел бы попросить тех из вас, кто займется этими исследованиями, об одном одолжении. Пожалуйста, не проводите простого ретроспективного обзора всех старых исследований по безопасности вакцин и журнальных статей, чтобы найти побочные эффекты алюминия. Вы их не найдете. Отравление алюминием, как утверждают Управление контроля пищевых продуктов и лекарств, Американская академия педиатрии и другие, нельзя заметить лишь путем наблюдения за внешними проявлениями. Было бы обидно, если бы в медицинской литературе появилось несколько работ, предназначенных исключительно для того, чтобы попытаться прикрыть это вопрос. Единственный способ положить конец дискуссиям о безопасности алюминия — провести несколько исследовательских работ на тысячах детей и измерить уровни алюминия после прививок. И следует смотреть не только на уровень алюминия в крови. Необходимо выяснить, где алюминий накапливается в организме, если это вообще происходит, как и с какой скоростью он выводится из организма. Как только я увижу такую исследовательскую работу, в которой, к моему удовлетворению, будет доказано, что алюминий безопасен, тогда я помещу обновление на сайте www.TheVaccineBook.com и внесу изменения в этот раздел в следующем издании этой книги. Если мы обнаружим, что алюминий может оказаться небезопасным, то я буду надеяться на принятие нового календаря прививок, в котором будут увеличены временны́е промежутки между прививками вакцинами с алюминием.
Вы их не найдете. Отравление алюминием, как утверждают Управление контроля пищевых продуктов и лекарств, Американская академия педиатрии и другие, нельзя заметить лишь путем наблюдения за внешними проявлениями. Было бы обидно, если бы в медицинской литературе появилось несколько работ, предназначенных исключительно для того, чтобы попытаться прикрыть это вопрос. Единственный способ положить конец дискуссиям о безопасности алюминия — провести несколько исследовательских работ на тысячах детей и измерить уровни алюминия после прививок. И следует смотреть не только на уровень алюминия в крови. Необходимо выяснить, где алюминий накапливается в организме, если это вообще происходит, как и с какой скоростью он выводится из организма. Как только я увижу такую исследовательскую работу, в которой, к моему удовлетворению, будет доказано, что алюминий безопасен, тогда я помещу обновление на сайте www.TheVaccineBook.com и внесу изменения в этот раздел в следующем издании этой книги. Если мы обнаружим, что алюминий может оказаться небезопасным, то я буду надеяться на принятие нового календаря прививок, в котором будут увеличены временны́е промежутки между прививками вакцинами с алюминием. Я также буду рассчитывать на то, что производители вакцин начнут искать и находить способы снизить содержание алюминия в вакцинах или удалить его оттуда, не снижая эффективности вакцин. Для того чтобы работала одна марка вакцины HIB, алюминий требуется, а для другой марки этого не требуется. Почему это так? В одной марке вакцины DTaP содержится в четыре раза больше алюминия, чем в другой. Почему?
Я также буду рассчитывать на то, что производители вакцин начнут искать и находить способы снизить содержание алюминия в вакцинах или удалить его оттуда, не снижая эффективности вакцин. Для того чтобы работала одна марка вакцины HIB, алюминий требуется, а для другой марки этого не требуется. Почему это так? В одной марке вакцины DTaP содержится в четыре раза больше алюминия, чем в другой. Почему?
Как врачи мы можем выбирать определенные марки вакцин, в которых алюминия меньше или не содержится совсем. Мы можем стараться делать за раз только одну прививку содержащей алюминий вакциной. И еще мы можем говорить об этом, вместо того чтобы замалчивать этот вопрос. Я молю Бога, чтобы мои страхи по поводу алюминия были необоснованными и чтобы несколько непредвзятых, объективных исследований, проведенных полностью независимыми группами, никак не связанными с производителями вакцин или политическими организациями, показали, что алюминий безопасен. А если нет, то я хотел бы надеяться, что производители вакцин как можно быстрее начнут снижать содержание алюминия в вакцинах и искать новые адъюванты. Я знаю, что это будет нелегко, но наши дети того стоят.
Я знаю, что это будет нелегко, но наши дети того стоят.
Источник: https://1796web.com/vaccines/opinions/aluminium/aluminium9.htm
А вот видео официального ТВ канала: https://youtu.be/zqF59MeKHV4
тестов для поиска множественной миеломы
Если симптомы указывают на то, что у человека может быть множественная миелома, проводятся дополнительные анализы.
Лабораторные испытания
Анализ крови
Общий анализ крови (CBC) — это тест, который измеряет уровни эритроцитов, лейкоцитов и тромбоцитов в крови. Если в костном мозге слишком много миеломных клеток, некоторые из этих клеток крови могут быть низкими. Наиболее частая находка — низкое количество эритроцитов (анемия).
Химический анализ крови
Проверяются уровни креатинина, альбумина, кальция и других электролитов в крови.
- Уровни креатинина показывают, насколько хорошо работают ваши почки. Высокий уровень означает, что почки не функционируют должным образом.
 Это часто встречается у людей с миеломой.
Это часто встречается у людей с миеломой. - Альбумин — это белок, содержащийся в крови. Низкий уровень можно увидеть при миеломе.
- Уровень кальция может быть высоким у людей с развитой миеломой. Высокий уровень кальция (гиперкальциемия) может вызывать симптомы усталости, слабости и спутанности сознания.
Также может быть сделан анализ крови для измерения уровня лактодегидрогеназы (ЛДГ).Это может быть полезным индикатором прогноза (перспектив) пациента. Высокие уровни означают, что болезнь находится на более поздней стадии и может иметь худший прогноз.
Анализы мочи
Обычный образец мочи обычно берут для поиска белка миеломы, который просочился через почки. Скорее всего, вас также попросят сдать образец мочи, собранный за 24-часовой период, чтобы он мог определить, сколько присутствует миеломного белка. Эти тесты называются электрофорезом белков мочи (UPEP) и иммунофиксацией мочи.
Количественные иммуноглобулины
Этот тест измеряет уровни в крови различных антител (также называемых иммуноглобулинами). В крови есть несколько различных типов антител: IgA, IgD, IgE, IgG и IgM. Уровни этих иммуноглобулинов измеряются, чтобы увидеть, являются ли они ненормально высокими или низкими. При множественной миеломе уровень одного типа может быть высоким, а других — низким.
В крови есть несколько различных типов антител: IgA, IgD, IgE, IgG и IgM. Уровни этих иммуноглобулинов измеряются, чтобы увидеть, являются ли они ненормально высокими или низкими. При множественной миеломе уровень одного типа может быть высоким, а других — низким.
Электрофорез
Антитело, продуцируемое клетками миеломы, является ненормальным, потому что оно моноклональное (все точно так же).Электрофорез сывороточного белка (SPEP) — это тест, который измеряет антитела в крови и может обнаружить моноклональные антитела. Другой тест, называемый иммунофиксацией или иммуноэлектрофорезом, используется для определения точного типа аномального антитела (IgG, IgA или какой-либо другой). Обнаружение моноклональных антител в крови может быть первым шагом в диагностике множественной миеломы. Этот аномальный белок известен под несколькими разными названиями, включая моноклональный иммуноглобулин , моноклональный белок (M-белок ) , M spike или парапротеин .
Антитела состоят из цепочек белков: 2 длинных (тяжелых) цепей и 2 более коротких (легких) цепей. Иногда кусочки аномального миеломного белка фильтруются через почки в мочу. Этот белок мочи, известный как белок Бенс-Джонса , является частью антитела, называемой легкой цепью. Тесты, используемые для обнаружения моноклональных антител в моче, называются электрофорезом белков мочи (UPEP) и иммунофиксацией мочи. Чаще всего это делается на основе мочи, собранной в течение 24 часов, а не только на обычном образце мочи.
Легкие цепи без сыворотки
Этот анализ крови позволяет измерить уровень легкой цепи в крови и проводится при поиске миеломы или амилоидоза легких цепей.
Это наиболее полезно в редких случаях миеломы, при которых М-белок не обнаруживается с помощью SPEP. Поскольку SPEP измеряет уровни интактных (целых) антител, он не может измерять количество только легких цепей.
Этот тест также вычисляет соотношение легкой цепи , которое используется, чтобы увидеть, есть ли у одного типа легкой цепи больше, чем у другого. Есть 2 вида легких цепей: каппа и лямбда. Обычно они присутствуют в крови в равных количествах, что дает соотношение 1: 1. Если одного типа легкой цепи больше, чем другого, соотношение будет другим, что может быть признаком миеломы.
Есть 2 вида легких цепей: каппа и лямбда. Обычно они присутствуют в крови в равных количествах, что дает соотношение 1: 1. Если одного типа легкой цепи больше, чем другого, соотношение будет другим, что может быть признаком миеломы.
Бета-2 микроглобулин
Это еще один белок, вырабатываемый клетками миеломы. Хотя сам по себе этот белок не вызывает проблем, он может быть полезным индикатором прогноза (перспектив) пациента. Высокие уровни означают, что болезнь находится на более поздней стадии и может иметь худший прогноз.
Типы биопсий
Биопсия костного мозга
У людей с множественной миеломой слишком много плазматических клеток в костном мозге. Процедура, используемая для проверки костного мозга, называется биопсией костного мозга и аспирацией . Это можно сделать как в кабинете врача, так и в больнице.
При аспирации костного мозга задняя часть тазовой кости обезболивается местной анестезией. Затем в кость вводится игла и с помощью шприца удаляется небольшое количество жидкого костного мозга.Это вызывает кратковременную резкую боль. Для биопсии используется игла, чтобы удалить крошечный осколок кости и костного мозга. Пациенты могут чувствовать некоторое давление во время биопсии. Когда действует обезболивающее, в области биопсии появляется некоторая болезненность. Большинство пациентов могут отправиться домой сразу после процедуры.
Затем в кость вводится игла и с помощью шприца удаляется небольшое количество жидкого костного мозга.Это вызывает кратковременную резкую боль. Для биопсии используется игла, чтобы удалить крошечный осколок кости и костного мозга. Пациенты могут чувствовать некоторое давление во время биопсии. Когда действует обезболивающее, в области биопсии появляется некоторая болезненность. Большинство пациентов могут отправиться домой сразу после процедуры.
Ткань костного мозга исследуется в лаборатории, чтобы увидеть внешний вид, размер и форму клеток, их расположение и определить, есть ли в костном мозге миеломные клетки и если да, то сколько.Аспират (жидкая часть костного мозга) также может быть отправлен на другие тесты, включая иммуногистохимию и проточную цитометрию, а также хромосомные анализы, включая кариотип и флуоресцентную гибридизацию in situ (также известную как FISH).
- Иммуногистохимия : Часть образца биопсии обрабатывается специальными белками, которые вызывают изменение цвета и помогают идентифицировать клетки миеломы.
- Проточная цитометрия: Образец костного мозга обрабатывают специальными белками, которые прикрепляются только к определенным клеткам.Это может помочь определить, являются ли эти клетки аномальными, и являются ли они клетками миеломы, клетками лимфомы, каким-либо другим раком или незлокачественным заболеванием.
- Цитогенетика : Тест, оценивающий хромосомы (длинные цепи ДНК) в нормальных клетках костного мозга и клетках миеломы. Некоторые клетки миеломы могут иметь слишком много хромосом, слишком мало хромосом или другие хромосомные аномалии (например, транслокации и делеции). Обнаружение этих изменений иногда может помочь в прогнозировании прогноза (мировоззрения) человека.Цитогенетическое тестирование обычно занимает от 2 до 3 недель, чтобы получить результат.
- Флуоресцентная гибридизация in situ (FISH): В ней используются специальные флуоресцентные красители, которые прикрепляются только к определенным частям хромосом.
 Он может обнаружить большинство хромосомных изменений (таких как транслокации и делеции), которые можно увидеть в лаборатории при стандартных цитогенетических тестах, а также некоторые изменения, которые слишком малы, чтобы их можно было увидеть при обычном цитогенетическом тестировании. Он очень точен, и результаты часто можно получить в течение нескольких дней.
Он может обнаружить большинство хромосомных изменений (таких как транслокации и делеции), которые можно увидеть в лаборатории при стандартных цитогенетических тестах, а также некоторые изменения, которые слишком малы, чтобы их можно было увидеть при обычном цитогенетическом тестировании. Он очень точен, и результаты часто можно получить в течение нескольких дней.
Аспирационная биопсия тонкой иглой
При аспирации тонкой иглой (FNA) используется очень тонкая игла и шприц для забора небольшого количества ткани из опухоли или лимфатического узла. Врач может направить иглу, чувствуя увеличенный лимфатический узел у поверхности тела. Если аномальная область (опухоль) находится глубоко в теле, иглу можно направлять, наблюдая за ней на компьютерной томографии (КТ) (см. Обсуждение тестов визуализации далее в этом разделе). Главное преимущество FNA в том, что она не требует хирургического вмешательства.Недостатком является то, что в некоторых случаях тонкая игла не может удалить достаточно ткани для постановки точного диагноза.
Биопсия стержневой иглой
Этот тест аналогичен FNA, но используется игла большего размера и отбирается образец ткани большего размера.
Если область на рентгеновском снимке выглядит ненормально, может потребоваться биопсия, чтобы подтвердить, что это плазмоцитома. Чаще всего используется игольчатая биопсия (тонкая или стержневая).
Визуальные тесты
Визуализирующие тесты используют звуковые волны, рентгеновские лучи, магнитные поля или радиоактивные вещества для создания изображений внутренней части вашего тела.Визуализационные тесты могут проводиться по ряду причин, например:
- Чтобы посмотреть на подозрительные участки, которые могут быть раковыми
- Чтобы узнать, как далеко распространился рак
- Чтобы помочь определить, работает ли лечение
Рентгенография костей
Рентген позволяет обнаружить разрушение кости, вызванное миеломными клетками. Часто врачи делают серию рентгеновских снимков, охватывающих большую часть костей..jpg) Это называется обследованием костей или обследованием скелета .
Это называется обследованием костей или обследованием скелета .
Компьютерная томография (компьютерная томография)
При компьютерной томографии используются рентгеновские снимки, полученные под разными углами, которые компьютер комбинирует для получения подробных снимков органов. Иногда этот тест может помочь определить, были ли ваши кости повреждены миеломой. Его также можно использовать для ввода иглы для биопсии в проблемную область.
Магнитно-резонансная томография (МРТ)
Как и компьютерная томография, МРТ показывает подробные изображения мягких тканей тела.Но при МРТ вместо рентгеновских лучей используются радиоволны и сильные магниты. Контрастное вещество, называемое гадолинием, может быть введено в вену перед сканированием, чтобы лучше рассмотреть детали.
МРТ очень полезны при изучении костей, головного и спинного мозга. Поскольку МРТ может обнаружить плазмоцитомы, которые нельзя увидеть на обычных рентгеновских снимках, они могут быть полезны, если у пациента есть боль в кости, но на рентгеновском снимке не видно никаких аномалий. МРТ также можно использовать для исследования костного мозга у пациентов с множественной миеломой.
МРТ также можно использовать для исследования костного мозга у пациентов с множественной миеломой.
Сканы позитронно-эмиссионной томографии (ПЭТ)
Для этого теста радиоактивный сахар вводится в вену и перемещается по телу. Раковые клетки поглощают большое количество этого сахара. Затем специальная камера делает снимки, которые показывают участки, где сахар собирается по всему телу. ПЭТ-сканирование часто сочетается с компьютерной томографией (известной как ПЭТ / КТ-сканирование ).
Когда у пациента обнаруживается одиночная плазмоцитома, можно использовать ПЭТ-сканирование для поиска других плазмоцитом.Как и МРТ, ПЭТ позволяет обнаружить плазмоцитомы, которые нельзя увидеть на обычных рентгеновских снимках, поэтому они полезны, если у пациента есть боль в кости, но результат рентгенографии отрицательный.
Эхокардиограмма (ЭХО)
Амилоидоз часто поражает сердце, поэтому, если ваш врач диагностирует или подозревает у вас это заболевание, может быть назначена эхокардиограмма (ЭХО). Этот тест в основном представляет собой ультразвуковое исследование сердца. Он использует звуковые волны, чтобы посмотреть на сердечную мышцу и на то, насколько хорошо она работает. На эхокардиограмме можно увидеть, нормальный ли размер сердца и нормально ли оно перекачивает кровь.Это также особенно полезно при подозрении на амилоид, потому что амилоид в сердечной мышце отличается от нормальной сердечной мышцы.
Этот тест в основном представляет собой ультразвуковое исследование сердца. Он использует звуковые волны, чтобы посмотреть на сердечную мышцу и на то, насколько хорошо она работает. На эхокардиограмме можно увидеть, нормальный ли размер сердца и нормально ли оно перекачивает кровь.Это также особенно полезно при подозрении на амилоид, потому что амилоид в сердечной мышце отличается от нормальной сердечной мышцы.
Диагностика множественной миеломы
Множественная миелома часто диагностируется на основании тестов, симптомов пациента и медицинского осмотра пациента врачом. Для диагностики множественной миеломы необходимо:
1. Опухоль плазматических клеток (подтвержденная биопсией) ИЛИ не менее 10% плазматических клеток в костном мозге И
2. Хотя бы одно из следующего:
- Повышенный уровень кальция в крови
- Почечная недостаточность
- Низкое содержание эритроцитов (анемия)
- Дыры в костях от опухоли, обнаруженные при визуализирующих исследованиях (КТ, МРТ, ПЭТ)
- Увеличение одного типа легкой цепи в крови, так что один тип встречается в 100 раз чаще, чем другой
- 60% или более плазматических клеток в костном мозге
Тлеющая миелома
Этот термин используется для обозначения ранней миеломы, не вызывающей никаких симптомов. Люди с тлеющей миеломой имеют некоторые признаки множественной миеломы, например любые из следующих:
Люди с тлеющей миеломой имеют некоторые признаки множественной миеломы, например любые из следующих:
- Плазматические клетки костного мозга от 10% до 60%
- Высокий уровень моноклонального иммуноглобулина (М-протеин) в крови
- Высокий уровень легких цепей в моче (также называемый белком Бенс-Джонса)
Но у них нормальный анализ крови, нормальный уровень кальция, нормальная функция почек, отсутствие повреждений костей или органов и никаких признаков амилоидоза.
Амилоидоз легкой цепи
Диагноз амилоидоза легких цепей ставится, когда у пациента есть ВСЕ из следующего:
- Признаки и симптомы амилоидоза
- Биопсия, показывающая амилоид в любой ткани (жировой ткани, костном мозге или органе, таком как сердце)
- Положительный тест, показывающий, что амилоидный белок представляет собой легкую цепь, а не тяжелую цепь
- Аномальные плазматические клетки в костном мозге, высокий уровень М-белка в крови или высокий уровень М-белка в моче.

Амилоид может накапливаться в любой ткани, и биопсия может помочь диагностировать это заболевание. Иногда это можно увидеть на биопсии костного мозга. При биопсии, которая проводится чаще всего для поиска амилоида, используется игла для удаления жира со стенки живота (живота). Это происходит после того, как кожа над местом биопсии обезболивается лекарством. Врач использует специальное пятно на удаленном жире, чтобы найти амилоид.
Поскольку амилоид часто поражает сердце и почки, их также можно сделать биопсией для поиска амилоида.Это редко требуется, чтобы выяснить, есть ли у пациента амилоидоз легких цепей, но иногда это делают у кого-то с амилоидом, если не ясно, что его проблемы с сердцем или почками вызваны амилоидом или какой-либо другой проблемой.
Часто проводятся и другие тесты, чтобы подтвердить, что у пациента амилоидоз легких цепей, а не какой-либо другой вид. К ним относятся биопсия костного мозга, свободные легкие цепи сыворотки и электрофорез мочи (это обсуждалось ранее в этом разделе).
Флуоресцентное сканирование плазмы и анализ кала на порфирин для диагностики разнообразной порфирии: точное определение чувствительности и специфичности с обнаружением мутаций протопорфириногеноксидазы в качестве эталонного стандарта
Фон: Вариегатная порфирия (VP) — аутосомно-доминантное заболевание, связанное с дефицитом фермента протопорфириногеноксидазы (PPOX).Сообщается, что флуоресцентное сканирование плазмы является более чувствительным тестом на VP, чем традиционная фекальная хроматография. Предыдущие сравнения этих методов предшествовали идентификации гена PPOX. Мы оценили эти методы на большой группе пациентов с ВП на уровне ДНК.
Методы: Мы оценили всех пациентов, для которых были доступны генотип и результаты сканирования плазмы или порфирина фекалий. Мутации были обнаружены с помощью рестрикционного анализа. Сканирование флуоресценции плазмы проводили в соответствии с опубликованными методами. Фекальные порфирины идентифицировали и количественно определяли с помощью тонкослойной хроматографии.
Мутации были обнаружены с помощью рестрикционного анализа. Сканирование флуоресценции плазмы проводили в соответствии с опубликованными методами. Фекальные порфирины идентифицировали и количественно определяли с помощью тонкослойной хроматографии.
Полученные результаты: Сканирование флуоресценции плазмы было оценено у 679 пациентов (205 с VP, которые были носителями мутации PPOX, либо с симптомами заболевания, либо бессимптомными), а анализ кала — у 473 (190 с VP).Чувствительность и специфичность обоих тестов были выше у взрослых, чем у детей, и выше у взрослых с симптомами заболевания, чем у бессимптомных носителей. При прямом сравнении у 168 взрослых (73 с VP) сканирование плазмы было значительно более чувствительным, чем анализ кала на порфирин [чувствительность 0,96 (95% доверительный интервал 0,89–0,99) против 0,77 (0,66–0,85)]. Копропорфирин в фекалиях [площадь под кривой 0,87 (0,83–0,90)] был лучшим предиктором ВП, чем протопорфирин [0,80 (0,76–0,84)].
Выводы: Плазменное сканирование — более чувствительный и специфический тест на ВП, чем анализ порфирина фекалий.Ни один из тестов не является чувствительным у детей, и оба теста менее чувствительны у бессимптомных носителей, чем в случаях с симптомами. Поэтому анализ ДНК остается предпочтительным методом выявления носителей, особенно у детей.
Компьютерная томография грудной клетки, латекс-агглютинация и анализ плазмы (1AE3) -бета-D-глюкана в ранней диагностике инвазивного легочного аспергиллеза: проспективное исследование 215 пациентов
Предпосылки и цели: Кровь и рентгенологические исследования часто используются для диагностики инвазивного легочного аспергиллеза, но остается неизвестным, что более полезно для его ранней диагностики. Целью исследования было сравнить полезность компьютерной томографии (КТ) грудной клетки, теста латексной агглютинации (ЛА) и определения уровней (1 -> 3) -бета-D-глюкана (БДГ) в плазме для ранней диагностики инвазивных заболеваний. легочный аспергиллез (ИПА).
Целью исследования было сравнить полезность компьютерной томографии (КТ) грудной клетки, теста латексной агглютинации (ЛА) и определения уровней (1 -> 3) -бета-D-глюкана (БДГ) в плазме для ранней диагностики инвазивных заболеваний. легочный аспергиллез (ИПА).
Дизайн и методы: Мы пролечили 215 пациентов, прошедших цитотоксическую химиотерапию. От начала химиотерапии до смерти или выписки еженедельно брались образцы крови и подвергались тестам на LA и BDG.Мы выполняли компьютерную томографию грудной клетки, когда у пациентов были какие-либо признаки легочной инфекции или лихорадки, устойчивой к антибиотикам.
Полученные результаты: Из 215 пациентов у 30 (14,0%) был диагностирован ИПА. В 16 случаях диагноз был поставлен точно, а в 14 — подозрение. При анализе пациентов чувствительность к LA и BDG составила 44% и 63% соответственно. Чувствительность, как правило, была ниже у пациентов с ИПА, локализованным в легких, чем у пациентов с диссеминированным инвазивным аспергиллезом.Специфичность составила 93% и 74% соответственно. Ореол или воздушный серп наблюдался у 7 из 16 пациентов с IPA, и все пациенты с IPA показали некоторые аномальные признаки на компьютерной томографии грудной клетки. В среднем признаки компьютерной томографии предшествовали положительному тесту на LA на 7,1 дня и положительному анализу BDG на 11,5 дней. У 6 из 11 пациентов, которые дали положительный результат либо на анализ LA, либо на BDG, признаки компьютерной томографии опередили положительные результаты более чем на семь дней.
При анализе пациентов чувствительность к LA и BDG составила 44% и 63% соответственно. Чувствительность, как правило, была ниже у пациентов с ИПА, локализованным в легких, чем у пациентов с диссеминированным инвазивным аспергиллезом.Специфичность составила 93% и 74% соответственно. Ореол или воздушный серп наблюдался у 7 из 16 пациентов с IPA, и все пациенты с IPA показали некоторые аномальные признаки на компьютерной томографии грудной клетки. В среднем признаки компьютерной томографии предшествовали положительному тесту на LA на 7,1 дня и положительному анализу BDG на 11,5 дней. У 6 из 11 пациентов, которые дали положительный результат либо на анализ LA, либо на BDG, признаки компьютерной томографии опередили положительные результаты более чем на семь дней.
Толкование и выводы: КТ грудной клетки более полезна, чем анализы крови и рентген для ранней диагностики ИПА.
Множественная миелома: диагноз | Cancer.Net
НА ЭТОЙ СТРАНИЦЕ: Вы найдете список общих тестов, процедур и сканирований, которые врачи используют для поиска причины медицинских проблем. Используйте меню для просмотра других страниц.
Врачи используют множество тестов для обнаружения или диагностики рака. Они также проводят тесты, чтобы узнать, распространился ли рак на другую часть тела, откуда он начался. Если это происходит, это называется метастазированием. Например, визуализационные тесты могут показать, распространился ли рак.Визуализирующие тесты показывают изображения внутренней части тела. Врачи также могут провести тесты, чтобы узнать, какое лечение лучше всего.
При большинстве видов рака биопсия — единственный надежный способ для врача узнать, есть ли рак в той или иной области тела. При биопсии врач берет небольшой образец ткани для исследования в лаборатории. Если биопсия невозможна, врач может предложить другие тесты, которые помогут поставить диагноз.
Как диагностируют множественную миелому
Существует множество тестов, используемых для диагностики множественной миеломы.Не все тесты, описанные здесь, подходят для каждого человека. Ваш врач может учитывать следующие факторы при выборе диагностического теста:
Тип подозреваемого рака
Ваши признаки и симптомы
Ваш возраст и общее состояние здоровья
Результаты ранее проведенных медицинских обследований
Для диагностики множественной миеломы можно использовать следующие тесты:
Анализы крови и мочи. Анализы крови и мочи играют ключевую роль в диагностике миеломы.
М белок. Клетки миеломы часто секретируют антитело моноклональный иммуноглобулин, известный как М-белок. Уровни М-белка в крови и моче пациента используются для определения степени заболевания, а также для отслеживания эффективности лечения и того, прогрессирует ли болезнь или возвращается ли она.
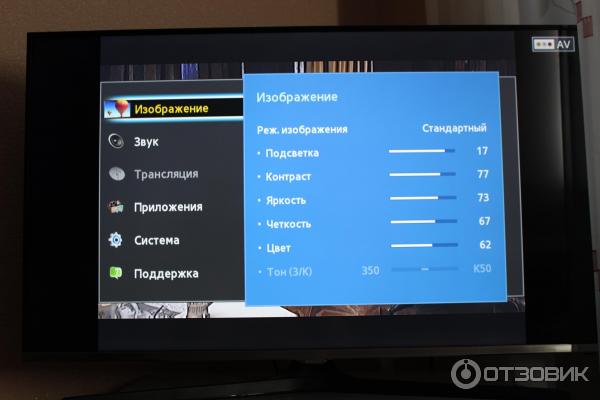 У некоторых людей миеломные клетки секретируют только часть антитела, которая называется легкой цепью.Количество белка М в крови или моче измеряется электрофорезом белков сыворотки (SPE или SPEP) или электрофорезом белков мочи (UPE или UPEP).
У некоторых людей миеломные клетки секретируют только часть антитела, которая называется легкой цепью.Количество белка М в крови или моче измеряется электрофорезом белков сыворотки (SPE или SPEP) или электрофорезом белков мочи (UPE или UPEP).Иммуноглобулин. Уровни иммуноглобулинов измеряются, чтобы помочь проверить уровень антител в крови. Эти антитела представляют собой иммуноглобулин G (IgG), иммуноглобулин A (IgA) и иммуноглобулин M (IgM). При множественной миеломе, когда уровень ракового белка повышается, нормальный уровень антител снижается.
Легкие цепи. Количество свободных легких цепей в крови можно измерить до того, как кровь будет отфильтрована почками. Этот тест называется анализом свободных легких цепей в сыворотке. Это более чувствительный тест, чем измерение белка М в моче, но оба критерия важны для измерения. Когда в моче обнаруживается легкая цепь, она называется белком Бенс-Джонса.
Сывороточный альбумин и сывороточный бета-2 микроглобулин (β2-M).
 Уровни сывороточного альбумина и сывороточного β2-M измеряются с помощью анализов крови.Сывороточный альбумин — это белок крови, вырабатываемый печенью, который необходим для поддержания надлежащего объема крови и общего состояния здоровья. β2-M — это небольшой белок, который играет роль в иммунном ответе организма.
Уровни сывороточного альбумина и сывороточного β2-M измеряются с помощью анализов крови.Сывороточный альбумин — это белок крови, вырабатываемый печенью, который необходим для поддержания надлежащего объема крови и общего состояния здоровья. β2-M — это небольшой белок, который играет роль в иммунном ответе организма.Лактазодегидрогеназа (ЛДГ). ЛДГ — это фермент, который представляет собой белок. Он есть почти во всех тканях организма. Поврежденные ткани выделяют ЛДГ в кровоток, поэтому ЛДГ используется как признак травмы или наличия заболевания. При миеломе уровни ЛДГ могут использоваться для определения прогноза, то есть вероятности выздоровления, и стадии (см. Стадии).
Эти результаты анализов важны для определения стадии миеломы. Анализы крови также используются для измерения функции почек, уровня кальция и количества клеток крови на предмет возможной анемии и других низких показателей крови.
Рентген. Рентгеновский снимок — это способ получить изображение структур внутри вашего тела с использованием небольшого количества радиации. Рентгеновские снимки, сделанные в рамках оценки врачом скелетной системы пациента, обычно являются первым шагом в оценке костей при подозрении или диагнозе миеломы.Рентгенологическое исследование скелета может не выявить миелому на более ранних стадиях, описанных ниже.
Рентгеновский снимок — это способ получить изображение структур внутри вашего тела с использованием небольшого количества радиации. Рентгеновские снимки, сделанные в рамках оценки врачом скелетной системы пациента, обычно являются первым шагом в оценке костей при подозрении или диагнозе миеломы.Рентгенологическое исследование скелета может не выявить миелому на более ранних стадиях, описанных ниже.
Магнитно-резонансная томография (МРТ). МРТ использует магнитные поля, а не рентгеновские лучи, для получения детальных изображений тела. МРТ может показать, заменен ли нормальный костный мозг миеломными клетками или плазмоцитомой, особенно в черепе, позвоночнике и тазу. Плазмацитома — это опухоль плазматических клеток, растущая в кости или мягких тканях. На подробных изображениях также могут быть видны компрессионные переломы позвоночника или опухоль, давящая на нервные корешки.МРТ также можно использовать для измерения размера опухоли.
Компьютерная томография (КТ или CAT). Компьютерная томография создает подробный вид в разрезе, который показывает любые аномалии или опухоли в мягких тканях. Затем компьютер объединяет эти изображения в трехмерное изображение внутренней части тела. Важно отметить, что внутривенный контрастный краситель, часто используемый для компьютерной томографии при других типах рака, особенно рекомендуется избегать людям с множественной миеломой. Сообщите радиологу или радиологу о своем диагнозе перед инъекцией красителя в вену, поскольку это может вызвать повреждение почек у людей с миеломой.
Компьютерная томография создает подробный вид в разрезе, который показывает любые аномалии или опухоли в мягких тканях. Затем компьютер объединяет эти изображения в трехмерное изображение внутренней части тела. Важно отметить, что внутривенный контрастный краситель, часто используемый для компьютерной томографии при других типах рака, особенно рекомендуется избегать людям с множественной миеломой. Сообщите радиологу или радиологу о своем диагнозе перед инъекцией красителя в вену, поскольку это может вызвать повреждение почек у людей с миеломой.
Позитронно-эмиссионная томография (ПЭТ) или ПЭТ-КТ. ПЭТ-сканирование обычно сочетается с компьютерной томографией (см. Выше), называемой ПЭТ-КТ-сканированием. Но вы можете услышать, что ваш врач называет эту процедуру просто ПЭТ-сканированием. ПЭТ-сканирование — это способ создания изображений органов и тканей внутри тела. В организм пациента вводится небольшое количество радиоактивного сахарного вещества. Это сахарное вещество поглощается клетками, которые потребляют больше всего энергии. Поскольку рак имеет тенденцию активно использовать энергию, он поглощает больше радиоактивного вещества.Однако количество радиации в веществе слишком мало, чтобы причинить вред. Затем сканер обнаруживает это вещество и создает изображения внутренней части тела.
Это сахарное вещество поглощается клетками, которые потребляют больше всего энергии. Поскольку рак имеет тенденцию активно использовать энергию, он поглощает больше радиоактивного вещества.Однако количество радиации в веществе слишком мало, чтобы причинить вред. Затем сканер обнаруживает это вещество и создает изображения внутренней части тела.
Аспирация и биопсия костного мозга. Эти 2 процедуры похожи и часто выполняются одновременно для исследования костного мозга. Костный мозг имеет как твердую, так и жидкую части. При аспирации костного мозга образец жидкости удаляется с помощью иглы. Биопсия костного мозга — это удаление небольшого количества твердой ткани с помощью иглы.Это важно для диагностики миеломы.
Затем патологоанатом анализирует образец (ы). Патолог — это врач, который специализируется на интерпретации лабораторных тестов и оценке клеток, тканей и органов для диагностики заболеваний. Гены миеломы исследуются цитогенетическими методами (см. Ниже) и специальным тестированием, называемым флуоресцентной гибридизацией in situ (FISH). Эти тесты определяют генетический состав миеломы и определяют, является ли она стандартным или высоким риском. Образцы также можно исследовать с помощью геномного секвенирования, чтобы с большой точностью определить, какие именно изменения произошли в ДНК раковых клеток.
Ниже) и специальным тестированием, называемым флуоресцентной гибридизацией in situ (FISH). Эти тесты определяют генетический состав миеломы и определяют, является ли она стандартным или высоким риском. Образцы также можно исследовать с помощью геномного секвенирования, чтобы с большой точностью определить, какие именно изменения произошли в ДНК раковых клеток.
Обычным местом аспирации и биопсии костного мозга является тазовая кость, которая расположена в пояснице у бедра. Кожу в этой области предварительно обезболивают лекарствами. Это лекарство называется анестезией. Другие типы анестезии также могут использоваться, чтобы блокировать осознание боли.
Аспират жировой подушечки. Если определенные M-белки, которые неправильно свернуты определенным образом, откладываются в тканях организма, это может привести к прекращению нормального функционирования органов. Это состояние называется амилоидозом.Если ваш врач подозревает, что у вас амилоидоз, может потребоваться взять образец брюшной жировой подушечки (скопление жира вокруг живота человека) для исследования под микроскопом, что называется биопсией.
Тестирование биомаркера опухоли. Ваш врач может порекомендовать провести лабораторные исследования образца опухоли и / или костного мозга для выявления конкретных хромосом (цитогенетика), генов (FISH или геномное секвенирование; см. Выше), белков и других факторов, уникальных для опухоли, как указано выше.Это также можно назвать молекулярным тестированием опухоли. Результаты этих тестов могут помочь определить варианты лечения.
Цитогенетика. Цитогенетика, то есть изучение генетических изменений в клетках, и молекулярные исследования могут проводиться на образце ткани, взятом во время биопсии, чтобы выяснить, насколько агрессивен рак. При миеломе гены плазматических клеток обычно изучаются с помощью теста FISH для выявления стандартного заболевания и заболевания высокого риска. Это может помочь в лечении.Разрабатываются дополнительные генетические тесты, обычно в рамках текущих исследований.
Флуоресцентная гибридизация in situ (FISH).
 FISH-тест — это тип цитогенетического теста, в котором используется флуоресцентный краситель для обнаружения изменений в хромосомах человека. FISH помогает врачу узнать, относится ли миелома к высокому риску и агрессивна, а также помогает предсказать прогноз. Тест FISH будет использоваться для большинства людей с миеломой.
FISH-тест — это тип цитогенетического теста, в котором используется флуоресцентный краситель для обнаружения изменений в хромосомах человека. FISH помогает врачу узнать, относится ли миелома к высокому риску и агрессивна, а также помогает предсказать прогноз. Тест FISH будет использоваться для большинства людей с миеломой.Тесты на минимальную остаточную болезнь (MRD). По мере того, как методы лечения миеломы становятся все более эффективными, были разработаны новые подходы к измерению эффективности лечения, в том числе для MRD. Принцип заключается в том, что чем сложнее выявить болезнь, тем лучше. Если после лечения обнаруживается очень небольшое количество заболевания (так называемое «MRD-положительное») с помощью этого тестирования, может быть предложено дальнейшее лечение для дальнейшего подавления заболевания.
После того, как диагностические тесты будут выполнены, ваш врач вместе с вами ознакомится с результатами. Если диагноз миелома, эти результаты также помогают врачу описать рак. Это называется постановкой.
Если диагноз миелома, эти результаты также помогают врачу описать рак. Это называется постановкой.
Следующий раздел в этом руководстве — этапы . Он объясняет систему, которую используют врачи для описания степени заболевания. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Сканирование ракового генома в плазме: обнаружение связанных с опухолью аберраций числа копий, однонуклеотидных вариантов и опухолевой гетерогенности путем массового параллельного секвенирования | Клиническая химия
ИСТОРИЯ ВОПРОСА
ДНК опухолевого происхождения может быть обнаружена в плазме больных раком.В этом исследовании мы исследовали использование массового параллельного секвенирования (MPS) плазменной ДНК больных раком для неинвазивного сканирования генома рака.
МЕТОДЫ
Были набраны четыре пациента с гепатоцеллюлярной карциномой и пациентка с синхронным раком груди и яичников. ДНК была извлечена из опухолевых тканей, и предоперационные и послеоперационные образцы плазмы этих пациентов были проанализированы с помощью дробовика MPS.
ДНК была извлечена из опухолевых тканей, и предоперационные и послеоперационные образцы плазмы этих пациентов были проанализированы с помощью дробовика MPS.
РЕЗУЛЬТАТЫ
Мы достигли полногеномного профилирования аберраций числа копий и точечных мутаций в плазме больных раком.Обнаруживая и количественно оценивая агрегированную аллельную потерю по всему геному и точечные мутации, мы определили фракционные концентрации опухолевой ДНК в плазме и коррелировали эти значения с размером опухоли и хирургическим лечением. Мы также продемонстрировали потенциальную полезность этого подхода для анализа сложных онкологических сценариев, изучая пациента с двумя синхронными раками. Посредством использования мультирегионального секвенирования опухолевых тканей и секвенирования плазменной ДНК мы показали, что секвенирование плазменной ДНК является ценным подходом для изучения опухолевой гетерогенности.
ВЫВОДЫ
Секвенирование ДНК плазмы с помощью дробовика — потенциально мощный инструмент для обнаружения, мониторинга и исследования рака.
Присутствие ДНК опухолевого происхождения в плазме больных раком открывает прекрасные возможности для обнаружения и мониторинга рака (1, 2). Действительно, связанные с раком микросателлитные изменения (3, 4), генные мутации (5–9), изменения ДНК-метилирования (10, 11) и вирусные нуклеиновые кислоты (12) были обнаружены в плазме пациентов с различными типами рака. .Большая часть ранее опубликованных работ о плазменной ДНК как маркере рака была сосредоточена на обнаружении конкретных и заранее определенных молекулярных мишеней, которые, как известно, связаны с раком, с помощью таких методов, как ПЦР (3, 4, 12), цифровая ПЦР (5 –7) и цифровые тесты лигирования (9). С появлением массового параллельного секвенирования (MPS), 8 несколько групп внедрили этот подход для разработки новых онкологических маркеров на основе ДНК плазмы. Один из подходов заключается в использовании MPS на образцах опухолей, чтобы сначала идентифицировать специфические геномные перестройки, которые впоследствии могут быть обнаружены в плазме (13, 14). Другой подход основан на использовании целевого секвенирования ампликонов для поиска мутаций генов, которые обычно встречаются при раке (8).
Другой подход основан на использовании целевого секвенирования ампликонов для поиска мутаций генов, которые обычно встречаются при раке (8).
Из-за их целенаправленной природы описанные выше подходы могут дать лишь частичное представление о геноме опухоли в плазме больных раком. Для полногеномного обзора опухолевого генома в кровообращении был бы желателен нецелевой метод случайного или дробного секвенирования. В этом отношении был достигнут значительный прогресс в области неинвазивной пренатальной диагностики благодаря результатам, полученным с помощью дробового МПС ДНК из плазмы беременных женщин (15).Этот подход позволил неинвазивно обнаруживать хромосомные анеуплоидии плода (16–18) и сканировать геном плода (19, 20).
В этой статье мы сообщаем об использовании дробовика MPS для получения неинвазивного, общегеномного представления о связанных с раком вариациях числа копий и мутациях в ДНК в плазме. Мы также стремились продемонстрировать использование этого подхода для выяснения важных опухолевых характеристик на примере опухолевой гетерогенности.
Материалы и методы
СБОР ОБРАЗЦОВ
Пациенты с гепатоцеллюлярной карциномой (ГЦК) и носители хронического гепатита В были набраны из Департамента хирургии и Департамента медицины и терапии соответственно больницы Принца Уэльского, Гонконг, и было получено информированное согласие и одобрение институционального наблюдательного совета. .Все пациенты с ГЦК страдали раком печени А1 в клинике Барселоны. Информированное согласие было получено после объяснения характера и возможных последствий исследований. Пациентка с синхронным раком груди и яичников была набрана из отделения клинической онкологии больницы принца Уэльского. Образцы периферической крови всех участников были собраны в пробирки с ЭДТА. Опухолевые ткани пациентов с ГЦК были получены во время операций по удалению рака.
ОБРАБОТКА КРОВИ
Образцы периферической крови центрифугировали при 1600 g в течение 10 мин при 4 ° C. Порцию плазмы повторно центрифугировали при 16 000 г в течение 10 мин при 4 ° C, а затем хранили при -80 ° C. Бесклеточные молекулы ДНК из 4,8 мл плазмы экстрагировали в соответствии с протоколом крови и биологических жидкостей мини-набора QIAamp DSP DNA Blood Mini Kit (Qiagen). ДНК плазмы концентрировали с помощью SpeedVac® Concentrator (Savant DNA120; Thermo Scientific) до конечного объема 40 мкл на контейнер для последующего приготовления библиотеки секвенирования ДНК.
Порцию плазмы повторно центрифугировали при 16 000 г в течение 10 мин при 4 ° C, а затем хранили при -80 ° C. Бесклеточные молекулы ДНК из 4,8 мл плазмы экстрагировали в соответствии с протоколом крови и биологических жидкостей мини-набора QIAamp DSP DNA Blood Mini Kit (Qiagen). ДНК плазмы концентрировали с помощью SpeedVac® Concentrator (Savant DNA120; Thermo Scientific) до конечного объема 40 мкл на контейнер для последующего приготовления библиотеки секвенирования ДНК.
ГЕНОМНАЯ ЭКСТРАКЦИЯ ДНК
Геномная ДНК была выделена из образцов лейкоцитарной пленки пациентов в соответствии с протоколом крови и биологических жидкостей мини-набора QIAamp DSP DNA Blood Mini Kit.ДНК выделяли из опухолевых тканей с помощью набора QIAamp DNA Mini Kit (Qiagen).
ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК
Библиотеки секвенирования образцов геномной ДНК были сконструированы с помощью набора для подготовки образцов с парными концами (Illumina) в соответствии с инструкциями производителя. Вкратце, 1–5 мкг геномной ДНК сначала разрезали с помощью фокусированного ультразвукового устройства Covaris S220 на фрагменты размером 200 п.н. После этого молекулы ДНК подвергались репарации концов ДНК-полимеразой Т 4 и полимеразой Кленова; Затем использовали полинуклеотидкиназу T 4 для фосфорилирования 5′-концов.3′-выступ был создан с 3′-к-5′-дефицитным по экзонуклеазе фрагментом Кленова. Адаптерные олигонуклеотиды Illumina лигировали к липким концам. ДНК с лигированием адаптера обогащали с помощью 12-цикловой ПЦР. Поскольку молекулы ДНК плазмы были короткими фрагментами (21), а количество общей ДНК в образцах плазмы было относительно небольшим, мы пропустили этапы фрагментации и использовали 15-цикловую ПЦР при построении библиотек ДНК из образцов плазмы.
Вкратце, 1–5 мкг геномной ДНК сначала разрезали с помощью фокусированного ультразвукового устройства Covaris S220 на фрагменты размером 200 п.н. После этого молекулы ДНК подвергались репарации концов ДНК-полимеразой Т 4 и полимеразой Кленова; Затем использовали полинуклеотидкиназу T 4 для фосфорилирования 5′-концов.3′-выступ был создан с 3′-к-5′-дефицитным по экзонуклеазе фрагментом Кленова. Адаптерные олигонуклеотиды Illumina лигировали к липким концам. ДНК с лигированием адаптера обогащали с помощью 12-цикловой ПЦР. Поскольку молекулы ДНК плазмы были короткими фрагментами (21), а количество общей ДНК в образцах плазмы было относительно небольшим, мы пропустили этапы фрагментации и использовали 15-цикловую ПЦР при построении библиотек ДНК из образцов плазмы.
Биоанализатор Agilent 2100 (Agilent Technologies) использовался для проверки качества и размера библиотек ДНК, лигированных адаптером.Затем библиотеки ДНК измеряли с помощью набора для количественного анализа библиотек KAPA (Kapa Biosystems) в соответствии с инструкциями производителя.
Библиотеку ДНК разводили и гибридизовали с проточными ячейками для секвенирования парных концов. Кластеры ДНК генерировали в системе генерации кластеров cBot (Illumina) с помощью TruSeq PE Cluster Generation Kit v2 (Illumina), после чего следовали 51 × 2 цикла или 76 × 2 цикла секвенирования в системе HiSeq 2000 (Illumina) с TruSeq SBS. Комплект v2 (Illumina).
ВЫРАВНИВАНИЕ И ФИЛЬТРАЦИЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данные секвенирования по парным концам анализировали с помощью программы 2 Short Oligonucleotide Alignment Program 2 (SOAP2) в режиме парных концов (22).Для каждого считывания парных концов 50 или 75 пар оснований с каждого конца выравнивали с эталонным геномом человека без маскировки повторов (Hg18). Допускалось до 2 несовпадений нуклеотидов для выравнивания каждого конца. Затем были проанализированы геномные координаты этих потенциальных выравниваний для 2 концов, чтобы определить, позволит ли какая-либо комбинация выровнять 2 конца с одной и той же хромосомой с правильной ориентацией, охватывая размер вставки ≤600 п. н., и сопоставить с одним местоположением. в эталонном геноме человека.Дублированные считывания были определены как считывания с парным концом, в которых молекула вставки ДНК показывала идентичные начальные и конечные положения в геноме человека; повторяющиеся чтения были удалены, как описано ранее (19).
н., и сопоставить с одним местоположением. в эталонном геноме человека.Дублированные считывания были определены как считывания с парным концом, в которых молекула вставки ДНК показывала идентичные начальные и конечные положения в геноме человека; повторяющиеся чтения были удалены, как описано ранее (19).
АНАЛИЗ МИКРОМАТЧ
ДНК, выделенная из лейкоцитов и опухолевых тканей пациентов с ГЦК, была генотипирована с помощью системы Affymetrix Genome-Wide Human SNP Array 6.0, как описано ранее (23). Данные микрочипа обрабатывались с помощью Affymetrix Genotyping Console версии 4.1. Анализ генотипа и определение однонуклеотидного полиморфизма (SNP) выполняли с помощью алгоритма Birdseed v2, как описано ранее (24). Данные генотипирования лейкоцитарной пленки и опухолевых тканей использовали для идентификации областей потери гетерозиготности (LOH) и для выполнения анализа количества копий. Анализ количества копий выполнялся с помощью Genotyping Console с параметрами по умолчанию от Affymetrix и с минимальным размером геномного сегмента 100 п. н. и минимум 5 генетическими маркерами в сегменте.Области с LOH были идентифицированы как области, имеющие 1 копию в опухолевой ткани и 2 копии в лейкоцитарной пленке, при этом SNP в этих областях были гетерозиготными в лейкоцитарной пленке, но гомозиготными в опухолевой ткани. Для области генома, демонстрирующей LOH в опухолевой ткани, аллели SNP, которые присутствовали в лейкоцитной пленке, но отсутствовали или имели пониженную интенсивность в опухолевых тканях, считались аллелями на удаленном сегменте хромосомной области. Считалось, что аллели, которые присутствовали как в лейкоцитной пленке, так и в опухолевой ткани, происходили из не удаленного сегмента хромосомной области.
н. и минимум 5 генетическими маркерами в сегменте.Области с LOH были идентифицированы как области, имеющие 1 копию в опухолевой ткани и 2 копии в лейкоцитарной пленке, при этом SNP в этих областях были гетерозиготными в лейкоцитарной пленке, но гомозиготными в опухолевой ткани. Для области генома, демонстрирующей LOH в опухолевой ткани, аллели SNP, которые присутствовали в лейкоцитной пленке, но отсутствовали или имели пониженную интенсивность в опухолевых тканях, считались аллелями на удаленном сегменте хромосомной области. Считалось, что аллели, которые присутствовали как в лейкоцитной пленке, так и в опухолевой ткани, происходили из не удаленного сегмента хромосомной области.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ГЕНОМНОЙ ГИБРИДИЗАЦИИ МАССИВОВ
образцов ДНК, экстрагированных из лейкоцитарной пленки и опухолевых тканей пациентов с ГЦК, были проанализированы с помощью набора SurePrint G3 Human High Resolution Microarray Kit (Agilent), как описано ранее (25). Сравнительные данные геномной гибридизации массивов для пациентов с ГЦК были проанализированы на предмет изменения количества копий с помощью Partek® Genomics Suite. Вкратце, необработанные интенсивности зондов были скорректированы в соответствии с GC-содержанием последовательности.За этой регулировкой следовала нормализация интенсивности сигнала на уровне зонда с одновременной регулировкой длины фрагмента и последовательностей зондов для всех образцов. Увеличение и уменьшение количества копий было обнаружено путем применения параметров по умолчанию алгоритма геномной сегментации, доступного в Partek Genomics Suite версии 6.5, для получения различных разделов состояния количества копий.
Сравнительные данные геномной гибридизации массивов для пациентов с ГЦК были проанализированы на предмет изменения количества копий с помощью Partek® Genomics Suite. Вкратце, необработанные интенсивности зондов были скорректированы в соответствии с GC-содержанием последовательности.За этой регулировкой следовала нормализация интенсивности сигнала на уровне зонда с одновременной регулировкой длины фрагмента и последовательностей зондов для всех образцов. Увеличение и уменьшение количества копий было обнаружено путем применения параметров по умолчанию алгоритма геномной сегментации, доступного в Partek Genomics Suite версии 6.5, для получения различных разделов состояния количества копий.
ОБНАРУЖЕНИЕ АБЕРРАЦИИ КОПИЙНОГО НОМЕРА В ОБРАЗЦАХ ОПУХОЛЕВОЙ ТКАНИ ПОСЛЕДОВАТЕЛЬНОСТЬЮ
Чтобы исследовать аберрации числа копий генома (например,g., прирост числа копий и убыток числа копий), мы разделили геном на сегменты равного размера (1 Мб на окно / интервал) и подсчитали количество операций чтения последовательностей, отображаемых в каждый интервал. Из-за наличия систематических ошибок, связанных с GC, с высокопроизводительными технологиями секвенирования (26), мы использовали метод статистической коррекции, локально взвешенное сглаживание диаграммы разброса (LOESS), для исправления ошибок, связанных с GC (27). В этом методе поправочный коэффициент рассчитывается для каждого бина в соответствии с регрессионной моделью LOESS, как описано ранее (28).Затем счетчики считывания для каждого бина были скорректированы с помощью поправочного коэффициента, зависящего от бункера, и нормализованы с помощью средних значений счетчиков чтений для всех бинов. После GC-коррекции отношение скорректированного количества считываний опухоли к количеству считываний лейкоцитарной пленки было рассчитано по следующему уравнению: где A опухоль — нормализованные GC скорректированные считанные значения опухолевой ткани и A BC — это нормализованное количество считываний лейкоцитарной пленки с поправкой на ГХ.Затем мы построили частотное распределение log 2 ( R ) для всех интервалов.Этот график распределения использовали для оценки доли опухолевых клеток ( F ) в опухолевой ткани, которая показала конкретное распределение числа копий и, следовательно, изменение числа копий в каждом интервале.
На графике частотного распределения был идентифицирован центральный пик, на котором R приблизительно равно 1 [т.е. log 2 ( R ) = 0]; этот пик представляет геномные области без аберраций числа копий. Затем были идентифицированы пики, расположенные слева и справа от центрального пика.Эти пики представляют области с потерей одной копии и усилением одной копии соответственно. Расстояния левого и правого пиков от центрального пика использовали для определения доли опухолевых клеток ( F ) в опухолевой ткани в соответствии со следующим уравнением: где R справа — значение R правого пика и R левого — это значение R левого пика. Затем значения изменения числа копий (CN) для всех бинов размером 1 Мб были рассчитаны по следующему уравнению: где R bin — это значение интервала R , а R cen — значение R центрального пика.ОБНАРУЖЕНИЕ АБЕРРАЦИЙ КОПИЙНОГО НОМЕРА В ПЛАЗМЕ
Мы проанализировали геномное представление ДНК плазмы для различных областей генома. Сначала весь геном был разделен на окна размером 1 Мб, аналогично анализу аберраций числа копий в опухолевых тканях. Затем определяли счетчик считывания с поправкой на GC (как описано выше) для каждого окна размером 1 Мбайт. Статистический показатель z использовали для определения того, будет ли значительно увеличиваться или уменьшаться представление ДНК плазмы в окне размером 1 Мб по сравнению с контрольной группой.Контрольную группу составили образцы плазмы от 16 здоровых контрольных лиц. В текущем исследовании подсчеты считывания с поправкой на GC для каждого бина размером 1 Мб были нормализованы к среднему количеству считываний с поправкой на GC для всех бинов в образце. Затем нормализованное представление ДНК в плазме сравнивали с данными из контроля. Затем была рассчитана оценка z для каждого окна размером 1 Мб с использованием среднего и стандартного отклонения контрольных значений. Регионы с оценками z <−3 и> 3 были расценены как значительно недопредставленные и перепредставленные, соответственно.
КОЛИЧЕСТВО МОЛЕКУЛ, НЕОБХОДИМОЕ ДЛЯ ОПРЕДЕЛЕНИЯ АБЕРРАЦИЙ КОПИЙНОГО НОМЕРА В ПЛАЗМЕ
Для анализа аберраций числа копий чувствительность и специфичность обнаружения связанных с опухолью аберраций числа копий в плазме определялись точностью измерения репрезентативности плазменной ДНК в хромосомной области и фракционной концентрации опухолевой ДНК в плазме. больного раком. На точность измерения репрезентативности ДНК в плазме, в свою очередь, влияет количество анализируемых молекул ДНК в плазме.В связи с этим мы провели имитационный анализ, чтобы определить взаимосвязь между количеством молекул ДНК в плазме, необходимых для анализа, и фракционной концентрацией ДНК опухолевого происхождения в плазме, чтобы мы могли достичь чувствительности 95% для обнаружения опухоль-ассоциированных аберрации числа копий. Компьютерное моделирование было выполнено для сценариев, в которых пораженная область имела изменение числа копий на -1, +1 и +2, а также для фракционных концентраций ДНК, полученной из опухоли, в диапазоне от 1% до 50%.В каждом анализе моделирования весь геном был разделен на 3000 ячеек. Это число было похоже на то, которое мы использовали в реальном экспериментальном анализе, когда использовалось разрешение 1 Мб.
Мы предположили, что 10% бункеров будут иметь хромосомные аберрации в опухолевой ткани. В опухолевой ткани ожидаемая доля ( P ) всех молекул, попадающих в ячейку в пораженной области, будет:P = 2 + CN2 × 3000 + 3000 × 10% × CN,
, где CN — количество копий. изменение. На основе этой информации мы рассчитали ожидаемое изменение плазмы.В плазме ожидаемая доля всех молекул ( E ), попадающих в ячейку внутри пораженной области, может быть рассчитана как: где f — фракционная концентрация ДНК, полученной из опухоли, в плазме.Моделирование 1000 нормальных случаев и 1000 случаев рака было выполнено на основе предположения о биномиальном распределении молекул ДНК в плазме, с ожидаемыми представлениями в плазме, как рассчитано выше, и с увеличивающимся количеством молекул, анализируемых до тех пор, пока не будет достигнут уровень обнаружения 95%. .Моделирование проводилось с помощью функции rbinom в R (http://www.r-project.org/).
ОБНАРУЖЕНИЕ ОПУХОЛЕВЫХ ОДНОНУКЛЕОТИДНЫХ ВАРИАНТОВ
Мы секвенировали парные образцы опухолевой и конституциональной ДНК, чтобы идентифицировать связанные с опухолью однонуклеотидные варианты (SNV). Мы сосредоточились на SNV, встречающихся в гомозиготных сайтах конституциональной ДНК (т.е. ДНК лейкоцитной оболочки). В принципе, любая нуклеотидная вариация, обнаруженная в данных секвенирования опухолевых тканей, но отсутствующая в конституционной ДНК, может быть потенциальной мутацией (т.е.е., SNV). Однако из-за ошибок секвенирования (0,1–0,3% секвенированных нуклеотидов) (29) в геноме будут идентифицированы миллионы ложноположительных результатов, если рассматривать единичное изменение нуклеотидов в данных секвенирования опухолевой ткани. как ассоциированный с опухолью SNV. Один из способов уменьшить количество ложных срабатываний — это установить критерий наблюдения множественных проявлений одного и того же нуклеотидного изменения в данных секвенирования в опухолевой ткани до того, как будет вызван связанный с опухолью SNV.Поскольку возникновение ошибок секвенирования является случайным процессом, количество ложных срабатываний из-за ошибок секвенирования будет экспоненциально уменьшаться с увеличением числа вхождений, необходимых для того, чтобы наблюдаемый SNV был квалифицирован как связанный с опухолью. С другой стороны, количество ложных срабатываний будет экспоненциально увеличиваться с увеличением глубины секвенирования. Эти отношения можно предсказать с помощью функций Пуассона и биномиального распределения. В связи с этим мы разработали математический алгоритм для определения динамического порога возникновения для квалификации наблюдаемого SNV как ассоциированного с опухолью.Этот алгоритм учитывает фактический охват конкретного нуклеотида в данных секвенирования опухоли, частоту ошибок секвенирования, максимально допустимую частоту ложноположительных результатов и желаемую чувствительность для обнаружения мутаций.
В этом исследовании мы установили очень строгие критерии для уменьшения количества ложных срабатываний. Мы требовали, чтобы мутация полностью отсутствовала в конституционном секвенировании ДНК, и глубина секвенирования для конкретного положения нуклеотида должна быть> 20-кратной. Этот порог возникновения был необходим для управления частотой обнаружения ложных срабатываний на уровне <1 × 10 -7 .В этом алгоритме мы также отфильтровали SNV, которые находились в центромерных, теломерных областях и областях с низкой сложностью, чтобы минимизировать ложные срабатывания из-за артефактов выравнивания. Кроме того, предполагаемое сопоставление SNV с известными SNP в базе данных dbSNP build 135 также было удалено.
Результаты
АБЕРРАЦИИ КОПИЙНОГО НОМЕРА, СВЯЗАННЫЕ С ОПУХОЛЕЙ, В ПЛАЗМЕ
Мы исследовали, могут ли ассоциированные с опухолью аберрации числа копий быть обнаружены в плазме больных раком с помощью дробовика MPS.Образцы периферической крови были взяты как до, так и через 1 неделю после хирургической резекции с лечебной целью у 4 пациентов с ГЦК. Образцы крови фракционировали на плазму и клетки крови. ДНК также была получена из каждой опухоли. Аберрации числа копий в 4 образцах опухолей анализировали с помощью MPS и с помощью 1 или 2 платформ микрочипов (Affymetrix и Agilent). Аберрации числа копий анализировали в окнах размером 1 Мб по всему геному в опухолевых тканях и сравнивали с образцами плазмы от группы из 16 здоровых контрольных лиц.Данные были согласованы на всех трех платформах (см. Рис. 1 в Приложении к данным, которое прилагается к онлайн-версии этой статьи по адресу http://www.clinchem.org/content/vol59/issue1).
Затем мы использовали MPS для анализа образцов плазмы до и после резекции, полученных от всех 4 пациентов с ГЦК. Средняя глубина секвенирования составляла 17-кратный охват гаплоидного генома человека (диапазон от 15,2 до 18,5 раз). На рис. 1 показаны графики Circos (30) аберраций числа копий в геноме опухоли, образца плазмы до резекции и образца плазмы после резекции для каждого пациента.В каждом случае характерные аберрации количества копий, наблюдаемые в образце опухолевой ткани, также наблюдались в образце плазмы перед резекцией (рис. 1). Значительное изменение в региональном представлении ДНК плазмы было определено как> 3 SD от среднего представления 16 здоровых контролей для соответствующего окна размером 1 Мб.
Аберрации числа копий, обнаруженные в образце опухолевой ткани (внутреннее кольцо), дооперационном образце плазмы (среднее кольцо) и послеоперационном образце плазмы (внешнее кольцо) для 4 случаев ГЦК (A – D) и геномное представление образцов ДНК плазмы для носитель вируса гепатита B (HBV1) без HCC (E).
Рис. 1.
Идеограммы хромосом (вне графиков) ориентированы по часовой стрелке. Для опухолевых тканей представлено количество полученных (зеленый) или потерянных (красный) копий. Для образцов плазмы области с повышенной и пониженной представленностью в плазме показаны зеленым и красным соответственно. Области с оценкой z от −3 до +3 представлены серыми точками. Для HCC1 расстояние между двумя последовательными горизонтальными линиями составляет 30 баллов по шкале z .Для других случаев расстояние представляет собой оценку z , равную 10.
Рис. 1.
Аберрации числа копий, обнаруженные в образце опухолевой ткани (внутреннее кольцо), дооперационном образце плазмы (среднее кольцо) и послеоперационном образце плазмы. (внешнее кольцо) для 4 случаев HCC (A – D) и геномное представление образцов ДНК плазмы для носителя вируса гепатита B (HBV1) без HCC (E).
Идеограммы хромосом (за пределами графиков) ориентированы по часовой стрелке.Для опухолевых тканей представлено количество полученных (зеленый) или потерянных (красный) копий. Для образцов плазмы области с повышенной и пониженной представленностью в плазме показаны зеленым и красным соответственно. Области с оценкой z от −3 до +3 представлены серыми точками. Для HCC1 расстояние между двумя последовательными горизонтальными линиями представляет собой оценку z , равную 30. Для других случаев расстояние представляет собой оценку z , равную 10.
Во всех случаях такие аберрации числа копий почти полностью исчезли в Образец плазмы после резекции (рис.1). Выявление различных классов генетических изменений, связанных с опухолью, в плазме крови показано на рис. 2. Для сравнения мы использовали тот же подход для анализа образцов ДНК плазмы от 4 носителей гепатита В без ГЦК (рис. 1E; см. Рис. 2). в онлайн-дополнении к данным). Эти люди наблюдались еще в течение 1 года после забора крови, и у них не было доказательств ГЦК. Для этих людей 99% секвенированных бункеров показали нормальное представление в плазме (см. Таблицу 1 в онлайн-приложении к данным).Аналогичным образом, в среднем 98,9% секвенированных бункеров в 16 здоровых контрольных группах показали нормальные представления в плазме (см. Таблицу 2 и Рис. 3 в онлайн-приложении к данным). Эти результаты показывают, что анализ аберраций числа копий в плазме специфичен для дифференциации онкологических больных и людей без рака; однако специфичность анализа количества копий в плазме оказалась сниженной у пациентов с ГЦК. Следовательно, у 4 пациентов с ГЦК в среднем 15% (диапазон 2–48%) областей, в которых не произошло никаких аберраций числа копий в соответствующей опухолевой ткани, показали аберрантное представление ДНК в плазме (см. Таблицу 1 в онлайн-версии). Дополнение к данным).Более подробно этот вопрос будет рассмотрен в разделе «Обсуждение».
(A), Степень обнаружения различных классов опухолевых аберраций числа копий в плазме пациентов с ГЦК.
Рис. 2.
Относительная концентрация ДНК опухолевого происхождения в плазме (в скобках), определенная для каждого случая с помощью GAAL-анализа. (B): количество молекул, необходимое для анализа в каждой интересующей области (окно размером 1 Мб) для обнаружения 95% связанных с раком аберраций числа копий в плазме.
Рис. 2.
(A), Скорость обнаружения для различных классов опухолевых аберраций числа копий в плазме пациентов с ГЦК.
Дробная концентрация ДНК опухолевого происхождения в плазме (в скобках), определенная для каждого случая с помощью анализа GAAL. (B): количество молекул, необходимое для анализа в каждой интересующей области (окно размером 1 Мб) для обнаружения 95% связанных с раком аберраций числа копий в плазме.
ФРАКЦИОННАЯ КОНЦЕНТРАЦИЯ ОПУХОЛЕВОЙ ДНК В ПЛАЗМЕ, ОПРЕДЕЛЯЕМАЯ АНАЛИЗОМ ОБЩЕЙ АГРЕГИРОВАННОЙ АЛЛЕЛИЧЕСКОЙ ПОТЕРЯ
Фракционные концентрации опухолевой ДНК в плазме определяли путем анализа в масштабе всего генома подсчетов аллелей для SNP, демонстрирующих LOH, в данных MPS плазменного дробовика, что мы называем анализом «агрегированная аллельная потеря по всему геному» (GAAL).Для такого анализа мы выбрали SNP, которые проявляли LOH в опухолях, как продемонстрировано с помощью микроматрицы Affymetrix SNP 6.0. Аллели, удаленные в опухолях, будут иметь более низкие концентрации в плазме, чем те, которые не были удалены. Разница в их концентрациях была связана с концентрацией ДНК опухолевого происхождения в образце плазмы. Таким образом, плазменная концентрация ДНК опухолевого происхождения ( C ) может быть вычислена с помощью следующего уравнения: где N nondel представляет собой количество секвенированных считываний, несущих неделетированные аллели в опухолевых тканях, а N del представляет собой количество секвенированных считываний, несущих удаленные аллели в опухолевых тканях.В таблице 1 перечислены фракционные концентрации опухолевой ДНК в образцах плазмы для каждого из 4 случаев. Размер опухоли, по-видимому, коррелирует с расчетной фракционной концентрацией ДНК, полученной из опухоли, в плазме до хирургической резекции. Например, мы подсчитали, что ДНК опухолевого происхождения составляла 52% от общей ДНК плазмы пациента, у которого была самая большая опухоль (13 см) из 4 случаев ГЦК. Для каждого из 4 случаев мы наблюдали снижение фракционной концентрации опухолевой ДНК после хирургической резекции опухоли (таблица 1).
Фракционная концентрация ДНК опухолевого происхождения в плазме по данным GAAL-анализа.
Таблица 1.Фракционная концентрация ДНК опухолевого происхождения в плазме по данным GAAL-анализа.
| Корпус . | Максимальный размер опухоли, см . | SNP с LOH в опухоли, n . | Плазма . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время сбора . | N nondel a . | N del . | Фракционная концентрация ДНК опухолевого происхождения . | |||||||
| HCC1 | 13,0 | 11 310 | До операции | 88499 | 42 829 | 52% | ||||
| 0.На 9% | 0,9% | |||||||||
| HCC3 | 4,2 | 24 783 | До операции | 198 688 | 1 | 4,3% | ||||
| 906 | 280 | 1.3% | ||||||||
| Корпус . | Максимальный размер опухоли, см . | SNP с LOH в опухоли, n . | Плазма . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время сбора . | N nondel a . | N del . | Фракционная концентрация ДНК опухолевого происхождения . | |||||||
| HCC1 | 13,0 | 11 310 | До операции | 88499 | 42 829 | 52% | ||||
| 0.На 9% | 0,9% | |||||||||
| HCC3 | 4,2 | 24 783 | До операции | 198 688 | 1 | 4,3% | ||||
| 906 | 280 | 1.3% | ||||||||
Фракционная концентрация опухолевой ДНК в плазме по данным GAAL-анализа.
| Корпус . | Максимальный размер опухоли, см . | SNP с LOH в опухоли, n . | Плазма . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время сбора . | N nondel a . | N del . | Фракционная концентрация ДНК опухолевого происхождения . | |||||||
| HCC1 | 13,0 | 11 310 | До операции | 88499 | 42 829 | 52% | ||||
| 0.На 9% | 0,9% | |||||||||
| HCC3 | 4,2 | 24 783 | До операции | 198 688 | 1 | 4,3% | ||||
| 906 | 280 | 1.3% | ||||||||
| Корпус . | Максимальный размер опухоли, см . | SNP с LOH в опухоли, n . | Плазма . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время сбора . | N nondel a . | N del . | Фракционная концентрация ДНК опухолевого происхождения . | |||||||
| HCC1 | 13,0 | 11 310 | До операции | 88499 | 42 829 | 52% | ||||
| 0.На 9% | 0,9% | |||||||||
| HCC3 | 4,2 | 24 783 | До операции | 198 688 | 1 | 4,3% | ||||
| 906 | 280 | 1.3% | ||||||||
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ОБНАРУЖЕНИЕ АБЕРРАЦИЙ КОПИЙНОГО НОМЕРА В ПЛАЗМЕ
Фракционная концентрация опухолевой ДНК в плазме и класс аберраций числа копий сильно повлияли на обнаруживаемость таких изменений в плазме.На рис. 1 и 2А показано, что пропорции связанных с опухолью генетических аберраций, которые можно было увидеть в результатах секвенирования ДНК в плазме, коррелировали с фракционными концентрациями ДНК опухоли в плазме. Например, случай HCC1, который имел самую большую опухоль и самую высокую фракционную концентрацию опухолевой ДНК в плазме, также имел самую большую долю связанных с опухолью аберраций числа копий, обнаруженных в плазме (рис. 1A).
В случае HCC1 фракционная концентрация ДНК опухолевого происхождения составляет 52%.До лечения большинство аберраций количества опухолевых копий также можно было увидеть в плазме. В большинстве хромосомных областей с увеличением одной копии в опухоли (например, хромосомы 1p, 3 и 6) баллы z были> 20, что указывает на то, что представление в плазме было на 20 SD выше среднего представления здоровые контрольные особи для этих регионов. С другой стороны, в случае HCC3 фракционная концентрация опухолевой ДНК в плазме составляла 4,3%, и меньшая доля связанных с раком аберраций могла наблюдаться в плазме.Ни одна из областей с усилением одной копии (7q, 8q, 13q и 14p) не имела баллов z > 10 в плазме.
Классы аберраций числа копий, которые были изучены, включали потерю одной копии, усиление одной копии и усиление двух копий. Процент таких изменений, которые были обнаружены в плазме в каждом из 4 случаев ГЦК, показаны на рис. 2А и перечислены в таблице 3 в онлайн-приложении к данным. В каждом случае прирост 2 копий может быть обнаружен с более высокой чувствительностью в плазме, чем изменения 1 копии.Для всех 4 пациентов с ГЦК большинство этих хромосомных аберраций, связанных с опухолью, исчезли после хирургической резекции опухоли (рис. 1; см. Таблицу 3 в онлайн-приложении к данным).
Предыдущая работа по неинвазивной пренатальной диагностике показала, что большая глубина секвенирования позволит обнаружить в плазме анеуплоидного плода при более низкой фракционной концентрации ДНК плода (31). Используя компьютерное моделирование, мы исследовали взаимосвязь между глубиной секвенирования, которая может потребоваться для обнаружения различных классов связанных с опухолью аберраций числа копий в плазме при различных фракционных концентрациях опухолевой ДНК в плазме (рис.2Б). В целях иллюстрации мы установили уровень обнаружения на уровне 95% и исследовали 3 класса генетических аберраций: потеря одной копии, увеличение одной копии и увеличение двух копий. Когда фракционная концентрация ДНК, полученной из опухоли, составляла 40%, обнаружение аберраций с увеличением 2 копий и усилением 1 копии потребовало бы анализа примерно 180 и 800 молекул, соответственно, на 1-мегабайтное окно. Когда фракционная концентрация ДНК, полученной из опухоли, падает до 10%, для обнаружения этих соответствующих изменений необходим анализ примерно 2500 и 12 000 молекул на 1-мегабайтное окно.Требование экспоненциального увеличения числа молекул с уменьшением фракционной концентрации ДНК, полученной из опухоли, соответствовало требованию неинвазивной пренатальной диагностики хромосомных анеуплоидий плода с помощью анализа ДНК материнской плазмы (32).
ОПУХОЛЬНЫЕ SNV В ПЛАЗМЕ
Затем мы исследовали полногеномное обнаружение SNV опухолевого происхождения в плазме 4 пациентов с ГЦК. Мы секвенировали ДНК опухоли и ДНК лейкоцитарной пленки до средней глубины 29.5-кратный (диапазон от 27 до 33 раз) и 43-кратный (диапазон от 39 до 46 раз) покрытие гаплоидного генома, соответственно. Сравнивались данные MPS опухолевой ДНК и ДНК лейкоцитарной пленки от каждого из 4 пациентов с HCC, и SNV, присутствующие в ДНК опухоли, но не в ДНК лейкоцитарной пленки, были получены с помощью строгого биоинформатического алгоритма. Этот алгоритм требовал, чтобы предполагаемый SNV присутствовал по крайней мере в пороговом количестве секвенированных фрагментов опухолевой ДНК, прежде чем он будет классифицирован как истинный SNV. Пороговое число определялось с учетом глубины секвенирования конкретного нуклеотида и частоты ошибок секвенирования.
Число ассоциированных с опухолью SNV колебалось от 1334 до 3171 в 4 случаях ГЦК. Доли таких SNV, которые были обнаружены в плазме, перечислены в таблице 2. Перед лечением в плазме было обнаружено 15–94% связанных с опухолью SNV. Фракционные концентрации опухолевой ДНК в плазме определяли путем фракционного подсчета мутанта по отношению к общим (т.е. мутант плюс дикий тип) последовательностям (таблица 2). Эти фракционные концентрации хорошо коррелировали с теми, которые были определены с помощью анализа GAAL, и были снижены после операции (таблица 2).
Фракционные концентрации опухолевой ДНК в плазме, определяемые анализом SNV.
Таблица 2.Фракционные концентрации опухолевой ДНК в плазме, определенные анализом SNV.
| Чемодан . | Количество SNV, обнаруженных в опухолевой ткани . | Момент времени . | Количество связанных с опухолью SNV, секвенированных из плазмы (процент SNV, обнаруженных в опухолевой ткани) . | Число считываний последовательностей ДНК плазмы, показывающих SNV ( p ) . | Количество считываний последовательности ДНК плазмы, показывающих последовательность дикого типа ( q ) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа SNV (2pp + q) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа GAAL . | ||
|---|---|---|---|---|---|---|---|---|---|
| HCC1 | 2840 | До операции | 2569 (94%) | 11389 | 31 602 | 53% | 52% | (1.5%) | 91 | 46898 | 0,4% | 0,9% |
| HCC2 | 3105 | До операции | 1097 (35%) | 1490 | % 5,6% | ||||
| После операции | 72 (2,3%) | 206 | 66692 | 0,6% | 0,9% | ||||
| HCC3 | |||||||||
| HCC3 | 9039 до операции До операции 15%) | 525 | 48 886 | 2.1% | 4,3% | ||||
| После операции | 31 (1%) | 67 | 58 862 | 0,2% | 1,4% | ||||
| 6 | |||||||||
| 6 | 201 (15%) | 248 | 18 527 | 2,6% | 7,6% | ||||
| После операции | 74 (5,5%) | 149 | 149 | 3% | 2,7% |
| Корпус . | Количество SNV, обнаруженных в опухолевой ткани . | Момент времени . | Количество связанных с опухолью SNV, секвенированных из плазмы (процент SNV, обнаруженных в опухолевой ткани) . | Число считываний последовательностей ДНК плазмы, показывающих SNV ( p ) . | Количество считываний последовательности ДНК плазмы, показывающих последовательность дикого типа ( q ) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа SNV (2pp + q) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа GAAL . | ||
|---|---|---|---|---|---|---|---|---|---|
| HCC1 | 2840 | До операции | 2569 (94%) | 11389 | 31 602 | 53% | 52% | (1.5%) | 91 | 46898 | 0,4% | 0,9% |
| HCC2 | 3105 | До операции | 1097 (35%) | 1490 | % 5,6% | ||||
| После операции | 72 (2,3%) | 206 | 66692 | 0,6% | 0,9% | ||||
| HCC3 | |||||||||
| HCC3 | 9039 до операции До операции 15%) | 525 | 48 886 | 2.1% | 4,3% | ||||
| После операции | 31 (1%) | 67 | 58 862 | 0,2% | 1,4% | ||||
| 6 | |||||||||
| 6 | 201 (15%) | 248 | 18 527 | 2,6% | 7,6% | ||||
| После операции | 74 (5,5%) | 149 | 149 | 3% | 2,7% |
Фракционные концентрации опухолевой ДНК в плазме, определяемые анализом SNV.
| Чемодан . | Количество SNV, обнаруженных в опухолевой ткани . | Момент времени . | Количество связанных с опухолью SNV, секвенированных из плазмы (процент SNV, обнаруженных в опухолевой ткани) . | Число считываний последовательностей ДНК плазмы, показывающих SNV ( p ) . | Количество считываний последовательности ДНК плазмы, показывающих последовательность дикого типа ( q ) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа SNV (2pp + q) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа GAAL . | ||
|---|---|---|---|---|---|---|---|---|---|
| HCC1 | 2840 | До операции | 2569 (94%) | 11389 | 31 602 | 53% | 52% | (1.5%) | 91 | 46898 | 0,4% | 0,9% |
| HCC2 | 3105 | До операции | 1097 (35%) | 1490 | % 5,6% | ||||
| После операции | 72 (2,3%) | 206 | 66692 | 0,6% | 0,9% | ||||
| HCC3 | |||||||||
| HCC3 | 9039 до операции До операции 15%) | 525 | 48 886 | 2.1% | 4,3% | ||||
| После операции | 31 (1%) | 67 | 58 862 | 0,2% | 1,4% | ||||
| 6 | |||||||||
| 6 | 201 (15%) | 248 | 18 527 | 2,6% | 7,6% | ||||
| После операции | 74 (5,5%) | 149 | 149 | 3% | 2,7% |
| Корпус . | Количество SNV, обнаруженных в опухолевой ткани . | Момент времени . | Количество связанных с опухолью SNV, секвенированных из плазмы (процент SNV, обнаруженных в опухолевой ткани) . | Число считываний последовательностей ДНК плазмы, показывающих SNV ( p ) . | Количество считываний последовательности ДНК плазмы, показывающих последовательность дикого типа ( q ) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа SNV (2pp + q) . | Выведенная фракционная концентрация опухолевой ДНК с помощью анализа GAAL . | ||
|---|---|---|---|---|---|---|---|---|---|
| HCC1 | 2840 | До операции | 2569 (94%) | 11389 | 31 602 | 53% | 52% | (1.5%) | 91 | 46898 | 0,4% | 0,9% |
| HCC2 | 3105 | До операции | 1097 (35%) | 1490 | % 5,6% | ||||
| После операции | 72 (2,3%) | 206 | 66692 | 0,6% | 0,9% | ||||
| HCC3 | |||||||||
| HCC3 | 9039 до операции До операции 15%) | 525 | 48 886 | 2.1% | 4,3% | ||||
| После операции | 31 (1%) | 67 | 58 862 | 0,2% | 1,4% | ||||
| 6 | |||||||||
| 6 | 201 (15%) | 248 | 18 527 | 2,6% | 7,6% | ||||
| После операции | 74 (5,5%) | 149 | 149 | 3% | 2,7% |
Чтобы оценить специфичность подхода к анализу SNV, мы проанализировали плазму здоровых контролей на предмет связанных с опухолью SNV (см. Таблицу 4 в онлайн-приложении к данным). Присутствие небольшого числа этих предполагаемых связанных с опухолью мутаций в плазме 16 здоровых контролей представляло «стохастический шум» этого метода и, вероятно, было связано с ошибками секвенирования. Средняя относительная концентрация, оцененная по такому шуму, была равна 0.38%.
АНАЛИЗ ПЛАЗМЕННОЙ ДНК У ПАЦИЕНТА С НЕСКОЛЬКИМИ СИНХРОННЫМИ РАКАМИ
Чтобы проиллюстрировать использование дробовика MPS плазменной ДНК для мониторинга сложного онкологического сценария, мы изучили 58-летнюю пациентку с мутацией BRCA1 (рак груди 1, раннее начало) (p.Cys1697 *), представляющей синхронный рак груди и яичников (рис. 3). Раком молочной железы была 3-сантиметровая инфильтрация протоковой карциномы, расположенная в левой груди. У пациентки были серозные аденокарциномы обоих яичников.Опухоль в левом яичнике имела размер 6 см в наибольшем измерении, а опухоль на правой стороне — 12 см. Также были обнаружены множественные внутрибрюшные отложения опухоли, затрагивающие сальник и толстую кишку. Хирургические резекции опухоли груди и яичников, а также сальника и сигмовидной кишки были выполнены в один день. Для этого исследования собирали опухоль груди и ткани опухоли яичника с левой и правой сторон. Образцы плазмы также были собраны при постановке диагноза и через 1 день после операции.ДНК опухоли молочной железы и 4 области опухолей яичников (2 из левого яичника и 2 из правого яичника) анализировали с помощью MPS. Области, отобранные для опухоли яичника с той же стороны, были разделены на 4 см.
Иллюстрация, показывающая расположение опухолей у пациентки с синхронным раком груди и яичников.
Рис. 3.
Были взяты образцы из четырех областей (A, B, C и D) опухолей яичников. Показаны фракционные концентрации ДНК плазмы опухолевого происхождения, оцененные с помощью SNV, связанных с каждой из опухолевых областей яичников.Рассчитанная фракционная концентрация опухолевой ДНК в плазме увеличивается, если оценка основана на SNV, связанных с несколькими областями опухоли.
Рис. 3.
Иллюстрация, показывающая расположение опухолей у пациентки с синхронным раком груди и яичников.
Были взяты образцы из четырех областей (A, B, C и D) опухолей яичников. Показаны фракционные концентрации ДНК плазмы опухолевого происхождения, оцененные с помощью SNV, связанных с каждой из опухолевых областей яичников.Рассчитанная фракционная концентрация опухолевой ДНК в плазме увеличивается, если оценка основана на SNV, связанных с несколькими областями опухоли.
Аберрации числа копий для рака груди и яичников показаны на рис. 4A. 4 опухолевые области яичников показали очень похожие паттерны аберраций числа копий. С другой стороны, рак груди демонстрировал иную картину аберраций числа копий. Характер аберраций в образце плазмы до операции был составлен из паттернов аберраций при раке груди и яичников (рис.4Б). Примеры генетических аберраций, специфичных для рака груди, включали удаленный сегмент на хромосоме 6p и амплификации на хромосомах 1q, 7p и 15q (рис. 4A). С другой стороны, примеры генетических аберраций, специфичных для опухолей яичников, включали делеции на хромосомах 2, 4p, 11p, 12q, 18q и 22q и амплификации на хромосомах 3q, 5p и 21q (рис. 4B). Все эти генетические отклонения, специфичные для рака груди или рака яичников, наблюдались в образце плазмы до операции, но были устранены в образце плазмы после операции (рис.4А). Расширенный вид 2 геномных областей, демонстрирующих аберрации числа копий, которые присутствовали при раке груди, но отсутствовали в опухолях яичников, показано на фиг. 4C.
(A), Аберрации числа копий, обнаруженные в раке груди (внутреннее кольцо) и опухолях яичников (второе внутреннее кольцо наружу: области A, B, C и D).
Рис. 4.
(B), Аберрации числа копий в опухоли груди, опухоли яичников (область A), предоперационной плазме и послеоперационной плазме (изнутри наружу).Две области генома, демонстрирующие аберрации числа копий, характерные для рака груди, отмечены прямоугольником (хромосома 1q) и стрелкой (хромосома 6p). (C) Расширенный вид участков хромосомы 1q и 6p в образцах опухоли и плазмы.
Рис. 4.
(A), Аберрации числа копий, обнаруженные в раке груди (самое внутреннее кольцо) и опухолях яичников (второе внутреннее кольцо наружу: области A, B, C и D).
(B), Аберрации числа копий в опухоли груди, опухоли яичников (область A), предоперационной плазме и послеоперационной плазме (изнутри наружу).Две области генома, демонстрирующие аберрации числа копий, характерные для рака груди, отмечены прямоугольником (хромосома 1q) и стрелкой (хромосома 6p). (C) Расширенный вид участков хромосомы 1q и 6p в образцах опухоли и плазмы.
Чтобы изучить относительный вклад рака груди и яичников в плазменную ДНК пациента, мы провели анализ GAAL для участков генома, в которых обнаружены делеции, характерные либо для опухоли груди, либо для опухолей яичников. Эти результаты показали, что рак груди и рак яичников способствовали 2.1% и 46% соответственно ДНК в плазме до операции (см. Таблицу 5 в онлайн-приложении к данным). После операции фракционные концентрации ДНК, вносимые каждой из этих опухолей, упали до 1,3% и 0,66% соответственно (см. Таблицу 5 в онлайн-приложении к данным).
ИССЛЕДОВАНИЕ ГЕТЕРОГЕННОСТИ ОПУХОЛЕЙ
Мы дополнительно исследовали феномен опухолевой гетерогенности (33), изучив 4 области, взятые из опухолей яичников. Между этими 4 регионами не было заметных различий в отношении аберраций числа копий (рис.4А). Мы сравнили профиль SNV из каждой из этих областей с ДНК лейкоцитов пациента. Мы классифицировали SNV на 7 групп: 4 группы, содержащие мутации, уникальные для каждого региона (т. Е. Группы A, B, C и D), 2 группы, содержащие мутации, общие для 2 регионов на каждой стороне тела (т.е. , группы AB и CD), и последняя группа, содержащая мутации, общие для всех 4 областей (т. е. группа ABCD) (таблица 3 и рис. 3). Мы случайным образом выбрали приблизительно 10 SNV для каждой из 7 групп SNV для проверки с помощью метода однонуклеотидного удлинения на основе масс-спектрометрии (анализ iPLEX; Sequenom) (см. Таблицу 6 в онлайн-дополнении к данным).Валидации прошли 67 мутаций. Более 95% результатов SNV, определенных путем секвенирования, были подтверждены в анализах iPLEX.
SNV-анализ нескольких областей рака яичников у пациентки с синхронным раком.
Таблица 3.SNV-анализ нескольких областей рака яичников у пациентки с синхронным раком.
| Группа SNV . | №SNV в опухоли . | Предоперационная плазма . | Послеоперационная плазма . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество считываний последовательностей, показывающих SNV в плазме ( p ) . | Количество считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | Количество считываний последовательностей, показывающих SNV в плазме ( p ) . | Количество считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | ||||||||||
| A | 71 | 37 | 3321 | 2,2% | 5 | 2149 | 0,46% | ||||||||
| B | 6 122 833 | 122 833 | 122 1 | 3516 | 0.6% | 2 | 7060 | 0,06% | |||||||
| AB | 10 | 21 | 423 | 9,5% | 0 | 297 | 0% | ||||||||
| 1.2% | Группа SNV . | Число SNV в опухоли . | Предоперационная плазма . | Послеоперационная плазма . | |||||||||||
| №считываний последовательностей, показывающих SNV в плазме ( p ) . | Количество считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | Количество считываний последовательностей, показывающих SNV в плазме ( p ) . | Количество считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | ||||||||||
| A | 71 | 37 | 3321 | 2,2% | 5 | 2149 | 0,46% | ||||||||
| B | 6 122 833 | 122 833 | 13516 | 0,06% | |||||||||||
| C | 168 | 51 | 8507 | 1.3% | 21 | 423 | 9,5% | 0 | 297 | 0% | |||||
| CD | 12 | 3 | 569 | 1,1% | 0 | 903 | ABCD | 2216 | 21 344 | 70 940 | 46% | 54 | 61417 | 0.18% | |
SNV-анализ множественных областей рака яичников у пациентки с синхронным раком.
| Группа SNV . | Число SNV в опухоли . | Предоперационная плазма . | Послеоперационная плазма . | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество считываний последовательностей, показывающих SNV в плазме ( p ) . | №считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | Количество считываний последовательностей, показывающих SNV в плазме ( p ) . | Количество считываний последовательностей, показывающих последовательность дикого типа в плазме ( q ) . | Выведенная фракционная концентрация ДНК опухолевого происхождения (2pp + q) . | |||||||
| A | 71 | 37 | 3321 | 2,2% | 5 | 2149 | 0,46% | |||||
| B | 6 122 833 | 122 833 | 122 1 | 3516 | 0,06% | |||||||
| C | 168 | 51 | 8507 | 1,2% | 2 | 5438 | 0,07% | 908 2639 | 908 880 | 0.48% | 2 | 7060 | 0,06% |
| AB | 10 | 21 | 423 | 9,5% | 0 | 297 | 6 0% | 3569 | 1,1% | 0 | 333 | 0% |
| ABCD | 2216 | 21 344 | 70 940 | 46% | 18% | |||||||

 получено: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира — Рандомизация к GH или плацебо — Научите самостоятельно принимать GH или плацебо Посещение 2, окончательная оценка первой фазы лечения (неделя 12 +/- 1 неделя) (амбулаторно) Ниже приводится описание оценок, которые будут выполнены в конце первая фаза лечения либо GH, либо плацебо. Субъекты также будут контролироваться на предмет безопасности с набором следующего: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Запись нежелательного явления — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира Период вымывания и кроссовер после первой фазы лечения GH или плацебо, субъекты будет 4-недельный период вымывания, и лечение будет перенесено еще на 12 недель фаза лечения либо GH, либо плацебо.
получено: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира — Рандомизация к GH или плацебо — Научите самостоятельно принимать GH или плацебо Посещение 2, окончательная оценка первой фазы лечения (неделя 12 +/- 1 неделя) (амбулаторно) Ниже приводится описание оценок, которые будут выполнены в конце первая фаза лечения либо GH, либо плацебо. Субъекты также будут контролироваться на предмет безопасности с набором следующего: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Запись нежелательного явления — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира Период вымывания и кроссовер после первой фазы лечения GH или плацебо, субъекты будет 4-недельный период вымывания, и лечение будет перенесено еще на 12 недель фаза лечения либо GH, либо плацебо. В течение этого времени испытуемым будет рекомендовано поддерживать стабильный режим питания и вес. Визит 3, исходная оценка для второй фазы лечения (16 неделя +/- 1 неделя) (как амбулаторно) Ниже приводится описание оценок, которые будут выполнены: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира — Лечение заменено на плацебо или GH Посещение 4, окончательная оценка для второй фазы лечения (28 неделя +/- 1 неделя) (в стационаре) Ниже приводится описание оценок, которые будут выполнены в конце вторая фаза лечения либо GH, либо плацебо.
В течение этого времени испытуемым будет рекомендовано поддерживать стабильный режим питания и вес. Визит 3, исходная оценка для второй фазы лечения (16 неделя +/- 1 неделя) (как амбулаторно) Ниже приводится описание оценок, которые будут выполнены: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира — Лечение заменено на плацебо или GH Посещение 4, окончательная оценка для второй фазы лечения (28 неделя +/- 1 неделя) (в стационаре) Ниже приводится описание оценок, которые будут выполнены в конце вторая фаза лечения либо GH, либо плацебо. Субъекты также будут контролироваться на предмет безопасности с набором следующего: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира Из-за потенциально большой продолжительности визитов 1, 2 и 4 исследования могут быть разделен на два отдельных приема по предварительной договоренности или может быть выполнен сразу с один прием, в зависимости от желания и расписания предмета. .
Субъекты также будут контролироваться на предмет безопасности с набором следующего: — Физический осмотр и история болезни — Показатели жизнедеятельности, например, измерения пульса и артериального давления — Рост и вес — Измерение окружности талии — Обзор сопутствующих лекарств — Тест на беременность в моче для беременных женщин — Оценка крови натощак, например, гемоглобин, глюкоза, инсулин, С-пептид, общий сывороточный уровень и свободный IGF-I, IGFBP-3, C-реактивный белок, неэтерифицированные жирные кислоты (NEFA), адипонектин и грелин — 3-часовой одноэтапный зажим для гиперинсулинемии и эугликемии — Сканы MRS и DEXA — Оценка скорости выведения кортизола — Биопсия жира Из-за потенциально большой продолжительности визитов 1, 2 и 4 исследования могут быть разделен на два отдельных приема по предварительной договоренности или может быть выполнен сразу с один прием, в зависимости от желания и расписания предмета. .